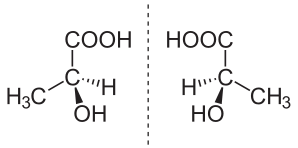Interested Article - Хиральность (химия)

- 2020-06-08
- 1
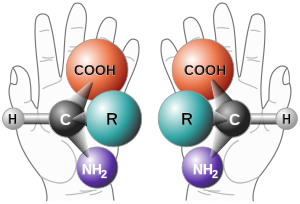
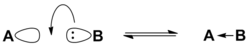
Хиральность ( др.-греч. «рука») — свойство молекулы не совмещаться в пространстве со своим зеркальным отражением . Термин основан на древнегреческом названии наиболее узнаваемого хирального предмета — руки . Так, левая и правая руки являются зеркальными отражениями, но не могут быть совмещены друг с другом в пространстве. Подобным образом, свойством хиральности обладают молекулы, в которых отсутствуют зеркально-поворотные оси симметрии S n , что эквивалентно наличию в молекуле элементов хиральности: центра, оси, плоскости хиральности и др. Такие зеркально-симметричные формы химических соединений называются энантиомерами .
История

Хиральность молекул была открыта Л. Пастером в 1848 году. Пастер обратил внимание на то, что кристаллы, выпадающие из раствора рацемического тартрата натрия - аммония , имеют две формы, представляющие собой зеркальные отражения, которые не совмещаются друг с другом в пространстве. Напротив, кристаллы индивидуального правовращающего тартрата натрия-аммония имели одинаковую форму с малыми плоскостями, направленными в одну сторону. Пастер провёл подобные кристаллизации с тринадцатью энантиомерно чистыми соединениями (различными тартратами и винной кислотой ), а также с шестью рацемическими тартратами и сделал вывод о существовании хиральности молекул и объяснил ранее неизвестный вид изомерии винных кислот — энантиомерию .
Структурная трактовка хиральности стала возможной после введения в 1874 году Я. Вант-Гоффом и Ж. Ле Белем концепции асимметрического атома углерода, то есть тетраэдрического атома углерода с четырьмя различными заместителями .
Понятие хиральности было введено лордом Кельвином в конце XIX в.
Я называю какую-либо геометрическую фигуру, или группу точек, хиральной и говорю, что она обладает хиральностью, если её изображение в идеальном плоском зеркале не может быть с ней совмещено.
Оригинальный текст (англ.) [ показать скрыть ]I call any geometrical figure, or group of points, chiral, and say it has chirality, if its image in a plane mirror, ideally realized, cannot be brought to coincide with itself.— У. Т. Кельвин. Балтиморские лекции по молекулярной динамике и волновой теории света, 1904
Позже В. Мейер распространил понятие о хиральности на соединения азота , а — на атомы серы , селена и олова . Хиральность комплексных соединений металлов была изучена А. Вернером .
Симметрия хиральных молекул
Поскольку хиральность является геометрической характеристикой, её можно определить путём отнесения молекулы к той или иной группе симметрии . Очевидно, не являются хиральными молекулы с центром инверсии ( i ) или плоскостью симметрии ( s ), поскольку эти молекулы состоят из двух одинаковых частей, которые при отражении превращаются друг в друга, и отражение является эквивалентным исходной молекуле. Ранее геометрический критерий хиральности формулировали так: «у хиральной молекулы не должно быть плоскости симметрии и центра инверсии». В настоящее время пользуются более точным критерием, который предполагает отсутствие у хиральной молекулы также S n .
Виды хиральности
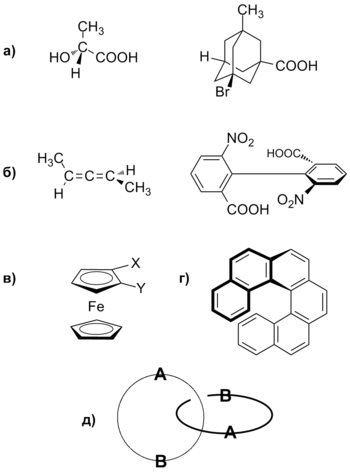
В зависимости от элемента молекулы, наличие которого приводит к возникновению хиральности, различают следующие виды хиральности:
- центральная (центр хиральности)
- аксиальная (ось хиральности)
- планарная (плоскость хиральности)
- спиральная (спираль)
- топологическая.
Центральная хиральность
Центральная хиральность возникает в результате наличия в молекуле центра хиральности (хирального центра), которым, как правило, является асимметрический атом углерода , имеющий 4 различных заместителя. Хиральными центрами могут быть также атомы Si , P , S , реже — N . В хиральных производных адамантана центр хиральности находится в середине углеродного каркаса, где атомов нет вовсе .
Аксиальная (осевая) хиральность
Аксиальная хиральность возникает в результате неплоского расположения заместителей относительно некоторой оси — оси хиральности . Ось хиральности существует в несимметрично замещённых алленах. sp -гибридный атом углерода в аллене имеет две взаимно перпендикулярные p -орбитали. Их перекрывание с p -орбиталями соседних атомов углерода приводит к тому, что заместители в аллене лежат во взаимно перпендикулярных плоскостях. Подобная ситуация наблюдается также в замещённых бифенилах , в которых вращение вокруг связи, соединяющей ароматические кольца , затруднено, а также в спироциклических соединениях.
Планарная хиральность
Плоскость хиральности присутствует в производных ферроцена , замещённых и др. При помощи данного термина описывают хиральное расположение внеплоскостных элементов молекулы относительно плоскости хиральности .
Спиральная хиральность
Спиральная хиральность характерна для соединений, имеющих элементы в форме спирали, пропеллера или винта, например для . Шесть ароматических колец в гексагелицене не могут уложиться в одной плоскости, поэтому образовывают спираль, которая может быть закручена влево или вправо. Данный вид хиральности наблюдается также в белках и нуклеиновых кислотах .
Топологическая хиральность
Топологическая хиральность связана с наличием структурной несимметричности, характерной для супрамолекул , например, катенанов , ротаксанов , молекулярных узлов .
Хиральность соединений со стереогенной парой электронов
В аминах , фосфинах , ионах сульфония, оксония, сульфоксидах хиральность может возникать из-за пространственного окружения атомов азота , фосфора , серы и кислорода . Несмотря на то, что в данных соединениях все они имеют только три заместителя, четвёртое координационное место занимает и происходит возникновение центра хиральности.
Хиральные амины отличаются от хиральных соединений кислорода, фосфора и серы, поскольку энантиомеры аминов, возникающие из-за стереогенного атома азота, редко могут быть разделены, так как они легко превращаются друг в друга за счёт (рассчитанная энергия активации E A для триметиламина составляет около 30 ккал / моль ). В то же время соответствующие фосфины подвергаются инверсии весьма медленно (рассчитанная энергия активации E A для составляет около 190 ккал / моль ) . Исключением из данной особенности являются амины, в которых инверсия азота невозможна, поскольку его конфигурация пространственно закреплена, как, например, в .

Хиральность в неорганической химии
Многие комплексные соединения обладают хиральностью. Классическими в данной области являются работы А. Вернера , синтезировавшего более 40 оптически активных координационных соединений. Например, октаэдрический комплекс рутения с [Ru(bipy) 3 ] 2+ является хиральным, поскольку три бипиридиновых лиганда в нём занимают хиральное расположение в форме пропеллера.

Связь с оптической активностью
Хиральные соединения и их растворы обладают способностью вращать плоскость поляризации плоскополяризованного света, что можно наблюдать при помощи поляриметра . По этой причине хиральные вещества также называют оптически активными , или оптически деятельными.
Световую волну, проходящую через раствор оптически активного вещества, можно представить в виде правой и левой циркулярно поляризованных составляющих, которые в хиральной среде распространяются с различными фазовыми скоростями , за счёт чего и возникает вращение плоскости поляризации света .
Хиральность в биологии
Многие биологически активные молекулы обладают хиральностью, причём природные аминокислоты и сахара представлены в природе преимущественно в виде одного из энантиомеров : аминокислоты, в основном, имеют l -конфигурацию, а сахара — d -конфигурацию .
Две энантиомерные формы одной молекулы обычно имеют различную биологическую активность. Это связано с тем, что рецепторы , ферменты , антитела и другие элементы организма также обладают хиральностью, и структурное несоответствие между этими элементами и хиральными молекулами препятствует их взаимодействию. Например, ферменты , являющиеся хиральными молекулами, часто проявляют специфическую реакционную способность по отношению к одному из энантиомеров. Подобные примеры характерны и для лекарственных соединений. Так, биологической активностью обладает лишь один энантиомер ибупрофена — ( S )-(+)-ибупрофен, в то время как его оптический антипод ( R )-(−)-ибупрофен в организме неактивен .
Гомохиральность
За редкими исключениями, природные хиральные аминокислоты и моносахариды представлены в виде единственного изомера из двух возможных. Так, в состав белков входят практически исключительно l -аминокислоты, а ДНК и РНК построены только на основе d - углеводов . Данное свойство химических соединений называется гомохиральностью (хиральной чистотой). Происхождение и назначение данного явления до конца не установлены, однако его часто связывают с проблемой происхождения жизни .
См. также
Примечания
- ↑ (неопр.) . Дата обращения: 24 февраля 2013. 26 февраля 2013 года.
- ↑ Flack H. D. (англ.) // Acta Cryst. Sect. A. — 2009. — Vol. A65 . — P. 371–389 . — doi : . 6 сентября 2012 года.
- Kelvin W. T. . — London: C. J. Clay and sons, 1904.
- Cintas P. Tracing the Origins and Evolution of Chirality and Handedness in Chemical Language (англ.) // Angew. Chem. Int. Ed. — 2007. — Vol. 46 , no. 22 . — P. 4016–4024 . — doi : .
- Азимов А. = A Short History of Chemistry / Пер. с англ. З. Е. Гельмана, под ред. А. Н. Шамина. — М. : Мир, 1983. — С. —89.
- ↑ Бутин К. П. (неопр.) . Дата обращения: 23 февраля 2013.
- Потапов В. М. . — М. : Химия, 1988. — С. -20. — ISBN 5-7245-0376-X .
- (неопр.) . Дата обращения: 24 февраля 2013. 26 февраля 2013 года.
- (неопр.) . Дата обращения: 24 февраля 2013. Архивировано из 23 декабря 2010 года.
- (неопр.) . Дата обращения: 24 февраля 2013. 26 февраля 2013 года.
- (неопр.) . Дата обращения: 24 февраля 2013. 26 февраля 2013 года.
- Kölmel С., Oehsenfeld C., Ahlrichs R. An ab initio investigation of structure and inversion barrier of triisopropylamine and related amines and phosphines (англ.) // Theor. Chim. Acta. — 1991. — Vol. 82 , no. 3-4 . — P. 271-284 . — ISSN . — doi : .
- Трофимова Т. И. . — М. : Высшая школа, 1990. — С. . — 478 с. — ISBN 5-06-001540-8 .
- Овчинников Ю. А. . — М. : Просвещение, 1987. — С. .
- Tracy T. S., Hall S. D. Metabolic inversion of (R)-ibuprofen. Epimerization and hydrolysis of ibuprofenyl-coenzyme A (англ.) // Drug Metab. Dispos. — 1992. — Vol. 20 , no. 2 . — P. 322-327 . — .
- Bonner W. A. Origins of Chiral Homogeneity in Nature (англ.) // Topics in Stereochemistry. — 2007. — Vol. 18 . — P. 1-96 . — doi : .
Литература
- 2020-06-08
- 1