Interested Article - Липопротеинлипаза
- 2021-05-05
- 1
| Липопротеинлипаза | |
|---|---|
| Обозначения | |
| Символы | ; LIPD |
| HGNC | |
| OMIM | |
| RefSeq | |
| UniProt | |
| Другие данные | |
| Шифр КФ | |
| Локус | 8-я хр. , |
| ? | |
Липопротеинлипаза (ЛПЛ, КФ ) — фермент , относящийся к классу липаз . ЛПЛ расщепляет триглицериды самых крупных по размеру и богатых липидами липопротеинов плазмы крови — хиломикронов и липопротеинов очень низкой плотности (ХМ и ЛПОНП)). ЛПЛ регулирует уровень липидов в крови, что определяет её важное значение в атеросклерозе .
Синтез липопротеинлипазы
ЛПЛ синтезируется в большинстве тканей организма кроме печени, где синтезируется специфическая печёночная липаза . Наиболее богаты липопротеинлипазой сердце , скелетные мышцы и жировая ткань .
После трансляции белок гликозилируется в эндоплазматическом ретикулуме . ЛПЛ человека гликозилируется по аминокислотным остаткам Асп -43, −257 и −359 . После этого глюкозидазы удаляют остатки глюкозы . В аппарате Гольджи олигосахаридная часть ЛПЛ трансформируется либо в две сложные цепи, либо в одну полиманнозную цепь . В зрелом белке ЛПЛ углеводная часть составляет 12 % от общей молекулярной массы, составляющей 55-58 кДа .
Гомодимеризация ЛПЛ требуется для секреции фермента из клетки . ЛПЛ секретируется клетками в виде гликозилированного гомодимера, после чего фермент транслоцируется во внеклеточный матрикс , проходит через слой эндотелиальных клеток кровеносного сосуда и выходит в просвет капилляров. В просвете капилляров ЛПЛ гликозилфосфатидилинозитол -заякоренному белку GPIHBP1 .
Структура
Кристаллическая структура была разрешена для комплекса ЛПЛ/GPIHBP1 . ЛПЛ состоит из двух отдельных доменов: более крупный N-терминальный домен, который включает липолитический активный сайт , и меньший C-терминальный домен. N-терминальный домен имеет глобулярную α/β-гидролазную структуру, включающую центральный бета-лист , окружённый альфа-спиралями . C-терминальный домен представляет собой удлинённый цилиндрический бета-сэндвич из двух бета-листов.
Механизм
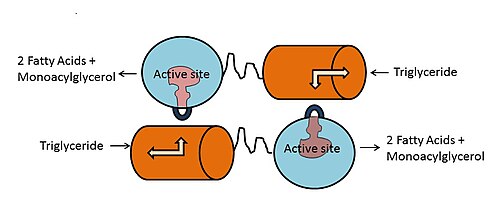
Активный центр ЛПЛ состоит из триады Сер -132, Асп -156 и Гис -241. Другие каталитически-важные регионы N-терминального домена включают т. н. оксианионную дыру (аминокислотные остатки Три -55 и Лей 133), покрывающий фрагмент (остатки 216—239) и петля бета-5 (остатки 54-64) . Локализация участка связывания аполипопротеина апоС-II неизвестна, но взаимодействие ЛПЛ с ним требует обоих N- и C-теминальных доменов. C-теминальный домен определяет субстратную специфичность фермента, он обладает более высокой аффинностью к крупным триглицерид-богатм липопротеинам, чем к более мелким холестерин-обогащённым липопротеинам . C-терминальный домен также участвует в связывании с рецепторами ЛПНП . Оба N- и C-теминальные домены содержат гепарин -связывающие участки, удалённые от липид-связывающих участков, и, таким образом, молекула ЛПЛ может служить связывающим звеном между клеточной поверхностью и липопротеинами. Связывание ЛПЛ с поверхностью клетки и клеточными рецепторами не зависит от её ферментативной активности .
Мономеры ЛПЛ в димерном состоянии фермента находятся в перевёрнутом по отношению друг к другу положении. Триада серин-аспарагин-гистидин расположена в гидрофобном углублении, которое закрыто от внешней среды покрывающим фрагментом . При связывании апоС-II и липопротеинового липида с C-доменом представляет молекулу липида покрывающему фрагменту и гидрофобному углублению, что приводит к транслокации покрывающего фрагмента и открытию активного центра фермента. β5-петля уходит в центр белка и приближает электрофил оксианионной дыры в положение для липолиза . При этом глицеридная часть молекулы триглицерида входит в активный центр и эфирная связь гидролизуется.
Две молекулы апоС-II могут связаться с димером ЛПЛ . Оценено, что одновременно с одной частицей липопротеина может быть связано до 40 молекул ЛПЛ . Считается, что лимитирующим звеном катализа является высвобождение продукта реакции в среду .
Функции
Ген LPL кодирует фермент липопротеинлипазу, которая экспресирована в сердце , скелетных мышцах и жировой ткани . ЛПЛ существует как гомодимер и несёт двойную функцию: она действует как фермент, гидролизуя триглицериды и служит лиганд-связывающим мостиком при рецептор-опосредованной интернализации липопротеинов. Каталитическая активность ЛПЛ превращает ЛПОНП сначала в ЛППП , а затем в ЛПНП . Мутации, вызывающие тяжёлую недостаточность ЛПЛ, приводит к гиперлипопротеинемии I типа , а мутации, частично снижающие её ферментативную активность. вызывают различные нарушения липидного метаболизма .
Регуляция
ЛПЛ контролируется как транскрипционно, так и посттранскрипционно . Циркадный ритм может служить важным фактором в регуляции контроля за уровнем мРНК липопротеинлипазы в периферических тканях .
Изоферменты ЛПЛ регулируются различным образом в зависимости от ткани. Так, известно, что инсулин активирует ЛПЛ в адипоцитах и локализацию фермента на поверхности эндотелия капилляров и, наоборот, снижает экспрессию ЛПЛ в мышцах . ЛПЛ в скелетных мышцах и в миокарде активируется глюкагоном и адреналином . Такая регуляция объясняет, почему натощак активность ЛПЛ повышена в мышечной ткани и понижена в жировой, тогда как после приёма пищи наблюдается обратная картина .
В соответствии с описанной регуляцией различные диеты различным образом влияют на активность ЛПЛ в жировой и мышечной тканях. Показано, что после 16 дней высокоуглеводной или высокожировой диеты активность ЛПЛ значительно повышалась в обеих тканях через 6 часов после приёма пищи, но повышение было сильнее в жировой ткани в ответ на высокоуглеводную диету. При этом указанные диеты не влияли на чуствительность к инсулину и на уровень ЛПЛ натощак в обеих тканях .
Уровень ЛПЛ, локализованной на поверхности эндотелиальных клеток не регулируется этими клетками, так как они не синтезируют и не расщепляют фермент. Регуляция фермента осуществляется за счёт притока вновь синтезированной ЛПЛ и регуляции активности фермента, находящегося на поверхности эндотелия. Ключевым белком в этой регуляции является ANGPTL4 , играющий роль локального ингибитора ЛПЛ. Индукция ANGPTL4 отвечает за ингибирование активности ЛПЛ в белой жировой ткани в состоянии натощак. Кроме этого, ANGPTL4 также участвует в физиологической регуляции ЛПЛ в ряде других тканей
Для объяснения изменения активности ЛПЛ в ходе циклов (приём пищи) — (состояние натощак) была предложена модель ANGPTL3 -ANGPTL4- . Приём пищи индуцирует ANGPTL8, активируя сигнальный путь ANGPTL8-ANGPTL3, который ингибирует ЛПЛ в сердечной и скелетных мышцах, что обеспечивает высокий уровень триглицеридов в крови и их доступность для жировой ткани, в которой активность ЛПЛ повышается благодаря понижению в жировой ткани уровня ингибирующего ANGPTL4. Обратная ситуация возникает натощак, когда ANGPTL8 в мышцах подавляется, а ANGPTL4 в жировой ткани, наоборот, индуцируется, что приводит к притоку триглицеридов к мышечной ткани .
Клиническое значение
Недостаточность липопротеинлипазы приводит к гипертриглицеридемии (то есть повышенному содержанию триглицеридов в крови) . Было также показано, что у мышей избыточная экспрессия ЛПЛ может приводить к инсулинорезистентности и стимулировать ожирение .
Экспрессия ЛПЛ является прогностическим признаком хронического лимфолейкоза . При этом заболевании ЛПЛ, видимо, участвует в обеспечении злокачественных клеток жирными кислотами как источника энергии . Таким образом, повышенный уровень липопротеинлипазы ( мРНК или белка) считается индикатором неблагоприятного исхода .
Взаимодействия
ЛПЛ взаимодействует с рецептором LRP1 . Этот фермент также является лигандом для белков , и рецепторов ЛПОНП . Кроме этого, ЛПЛ является лигандом для рецептора , хотя и с меньшей аффинностью, чем для других рецепторов. Тем не менее, именно взаимодействие ЛПЛ с LRP2 отвечает за основную долю деградации ЛПОНП под действием ЛПЛ . Во всех случаях ЛПЛ играет роль мостика между соответствующим рецептором и липопротеином. ЛПЛ активируется аполипопротеином C2 и ингибируется аполипопротеином C2 .
В других организмах
Известно, что ген LPL — высококонсервативный ген среди позвоночных . ЛПЛ, например, участвует в липидном транспорте в плаценте у живородящих ящериц .
Примечания
- ↑ - Ensembl , May 2017
- ↑ - Ensembl , May 2017
- Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ↑ Mead JR, Irvine SA, Ramji DP (December 2002). "Lipoprotein lipase: structure, function, regulation, and role in disease". J. Mol. Med . 80 (12): 753—69. doi : . PMID . S2CID .
- ↑ Braun JE, Severson DL (October 1992). . The Biochemical Journal . 287 ( Pt 2) (2): 337—47. doi : . PMC . PMID .
- Semb H, Olivecrona T (March 1989). . J. Biol. Chem . 264 (7): 4195—200. doi : . PMID .
- ↑ Wong H, Davis RC, Thuren T, Goers JW, Nikazy J, Waite M, Schotz MC (April 1994). . J. Biol. Chem . 269 (14): 10319—23. doi : . PMID .
- ↑ Vannier C, Ailhaud G (August 1989). . J. Biol. Chem . 264 (22): 13206—16. doi : . PMID .
- Ong JM, Kern PA (February 1989). . J. Biol. Chem . 264 (6): 3177—82. doi : . PMID .
- Beigneux AP, Davies BS, Gin P, Weinstein MM, Farber E, Qiao X, Peale F, Bunting S, Walzem RL, Wong JS, Blaner WS, Ding ZM, Melford K, Wongsiriroj N, Shu X, de Sauvage F, Ryan RO, Fong LG, Bensadoun A, Young SG (2007). . Cell Metabolism . 5 (4): 279—291. doi : . PMC . PMID .
- Davies BS, Beigneux AP, Barnes RH, Tu Y, Gin P, Weinstein MM, Nobumori C, Nyrén R, Goldberg I, Olivecrona G, Bensadoun A, Young SG, Fong LG (July 2010). . Cell Metabolism . 12 (1): 42—52. doi : . PMC . PMID .
- PDB ; Birrane G, Beigneux AP, Dwyer B, Strack-Logue B, Kristensen KK, Francone OL, et al. (January 2019). . Proceedings of the National Academy of Sciences of the United States of America . 116 (5): 1723—1732. doi : . PMC . PMID .
- PDB ; Arora R, Nimonkar AV, Baird D, Wang C, Chiu CH, Horton PA, et al. (May 2019). . Proceedings of the National Academy of Sciences of the United States of America . 116 (21): 10360—10365. doi : . PMC . PMID .
- ↑ Wang CS, Hartsuck J, McConathy WJ (January 1992). (PDF) . Biochimica et Biophysica Acta . 1123 (1): 1—17. doi : . PMID . (PDF) из оригинала 21 января 2022 . Дата обращения: 12 декабря 2021 .
- Lookene A, Nielsen MS, Gliemann J, Olivecrona G (April 2000). "Contribution of the carboxy-terminal domain of lipoprotein lipase to interaction with heparin and lipoproteins". Biochem. Biophys. Res. Commun . 271 (1): 15—21. doi : . PMID .
- ↑ Medh JD, Bowen SL, Fry GL, Ruben S, Andracki M, Inoue I, Lalouel JM, Strickland DK, Chappell DA (July 1996). . J. Biol. Chem . 271 (29): 17073—80. doi : . PMID .
- Beisiegel U, Weber W, Bengtsson-Olivecrona G (October 1991). . Proc. Natl. Acad. Sci. U.S.A . 88 (19): 8342—6. Bibcode : . doi : . PMC . PMID .
- McIlhargey TL, Yang Y, Wong H, Hill JS (June 2003). . J. Biol. Chem . 278 (25): 23027—35. doi : . PMID .
- Protein Atlas, Protein Atlas . www.proteinatlas.org . The Human Protein Atlas. Дата обращения: 25 июля 2019. 25 июля 2019 года.
- Gene Cards, Gene Cards . www.genecards.org . GeneCardsSuite. Дата обращения: 25 июля 2019. 8 июня 2019 года.
- . Дата обращения: 12 декабря 2021. 17 октября 2009 года.
- Wang H, Eckel RH (2009). "Lipoprotein lipase: from gene to obesity". Am J Physiol Endocrinol Metab . 297 (2): E271—88. doi : . PMID .
- ↑ Delezie J, Dumont S, Dardente H, Oudart H, Gréchez-Cassiau A, Klosen P, et al. (2012). . FASEB J . 26 (8): 3321—35. doi : . PMID . S2CID .
- Kiens B, Lithell H, Mikines KJ, Richter EA (October 1989). . J. Clin. Invest . 84 (4): 1124—9. doi : . PMC . PMID .
- Yost TJ, Jensen DR, Haugen BR, Eckel RH (August 1998). (PDF) . Am. J. Clin. Nutr . 68 (2): 296—302. doi : . PMID . (PDF) из оригинала 12 декабря 2015 . Дата обращения: 6 января 2022 .
- Dijk W, Kersten S (2014). "Regulation of lipoprotein lipase by Angptl4". Trends Endocrinol. Metab . 25 (3): 146—155. doi : . PMID . S2CID .
- ↑ Zhang R (April 2016). . Open Biol . 6 (4): 150272. doi : . PMC . PMID .
- Okubo M, Horinishi A, Saito M, Ebara T, Endo Y, Kaku K, Murase T, Eto M (November 2007). "A novel complex deletion-insertion mutation mediated by Alu repetitive elements leads to lipoprotein lipase deficiency". Mol. Genet. Metab . 92 (3): 229—33. doi : . PMID .
- Ferreira LD, Pulawa LK, Jensen DR, Eckel RH (2001). . Diabetes . 50 (5): 1064—8. doi : . PMID .
- Kim JK, Fillmore JJ, Chen Y, Yu C, Moore IK, Pypaert M, et al. (2001). . Proc Natl Acad Sci U S A . 98 (13): 7522—7. Bibcode : . doi : . PMC . PMID .
- Prieto D, Oppezzo P (December 2017). . Molecules . 22 (12): 2083. doi : . PMC . PMID .
- Rozovski U, Hazan-Halevy I, Barzilai M, Keating MJ, Estrov Z (8 December 2015). . Leukemia & Lymphoma . 57 (4): 758—65. doi : . PMC . PMID .
- Oppezzo P, Vasconcelos Y, Settegrana C, Jeannel D, Vuillier F, Legarff-Tavernier M, Kimura EY, Bechet S, Dumas G, Brissard M, Merle-Béral H, Yamamoto M, Dighiero G, Davi F (July 2005). . Blood . 106 (2): 650—7. doi : . PMID .
- Heintel D, Kienle D, Shehata M, Kröber A, Kroemer E, Schwarzinger I, Mitteregger D, Le T, Gleiss A, Mannhalter C, Chott A, Schwarzmeier J, Fonatsch C, Gaiger A, Döhner H, Stilgenbauer S, Jäger U (July 2005). . Leukemia . 19 (7): 1216—23. doi : . PMID .
- van't Veer MB, Brooijmans AM, Langerak AW, Verhaaf B, Goudswaard CS, Graveland WJ, van Lom K, Valk PJ (January 2006). "The predictive value of lipoprotein lipase for survival in chronic lymphocytic leukemia". Haematologica . 91 (1): 56—63. PMID .
- Nückel H, Hüttmann A, Klein-Hitpass L, Schroers R, Führer A, Sellmann L, Dührsen U, Dürig J (June 2006). "Lipoprotein lipase expression is a novel prognostic factor in B-cell chronic lymphocytic leukemia". Leukemia & Lymphoma . 47 (6): 1053—61. doi : . PMID . S2CID .
- Mansouri M, Sevov M, Fahlgren E, Tobin G, Jondal M, Osorio L, Roos G, Olivecrona G, Rosenquist R (March 2010). "Lipoprotein lipase is differentially expressed in prognostic subsets of chronic lymphocytic leukemia but displays invariably low catalytical activity". Leukemia Research . 34 (3): 301—6. doi : . PMID .
- Kaderi MA, Kanduri M, Buhl AM, Sevov M, Cahill N, Gunnarsson R, Jansson M, Smedby KE, Hjalgrim H, Jurlander J, Juliusson G, Mansouri L, Rosenquist R (August 2011). . Haematologica . 96 (8): 1153—60. doi : . PMC . PMID .
- Porpaczy E, Tauber S, Bilban M, Kostner G, Gruber M, Eder S, Heintel D, Le T, Fleiss K, Skrabs C, Shehata M, Jäger U, Vanura K (June 2013). . Leukemia Research . 37 (6): 631—6. doi : . PMID .
- Mátrai Z, Andrikovics H, Szilvási A, Bors A, Kozma A, Ádám E, Halm G, Karászi É, Tordai A, Masszi T (January 2017). "Lipoprotein Lipase as a Prognostic Marker in Chronic Lymphocytic Leukemia". Pathology & Oncology Research . 23 (1): 165—171. doi : . PMID . S2CID .
- Prieto D, Seija N, Uriepero A, Souto-Padron T, Oliver C, Irigoin V, Guillermo C, Navarrete MA, Inés Landoni A, Dighiero G, Gabus R, Giordano M, Oppezzo P (August 2018). . British Journal of Haematology . 182 (4): 521—525. doi : . PMID .
- Rombout A, Verhasselt B, Philippé J (November 2016). . European Journal of Haematology . 97 (5): 409—415. doi : . PMID .
- Williams SE, Inoue I, Tran H, Fry GL, Pladet MW, Iverius PH, Lalouel JM, Chappell DA, Strickland DK (March 1994). . J. Biol. Chem . 269 (12): 8653—8. doi : . PMID .
- Nykjaer A, Nielsen M, Lookene A, Meyer N, Røigaard H, Etzerodt M, Beisiegel U, Olivecrona G, Gliemann J (December 1994). . J. Biol. Chem . 269 (50): 31747—55. doi : . PMID .
- Chappell DA, Fry GL, Waknitz MA, Iverius PH, Williams SE, Strickland DK (December 1992). . J. Biol. Chem . 267 (36): 25764—7. doi : . PMID .
- Griffith OW, Ujvari B, Belov K, Thompson MB (November 2013). "Placental lipoprotein lipase (LPL) gene expression in a placentotrophic lizard, Pseudemoia entrecasteauxii". Journal of Experimental Zoology Part B: Molecular and Developmental Evolution . 320 (7): 465—70. doi : . PMID .
Литература
- Zechner R. The tissue-specific expression of lipoprotein lipase: implications for energy and lipoprotein metabolism (англ.) // Curr. Opin. Lipidol. : journal. — 1997. — Vol. 8 , no. 2 . — P. 77—88 . — doi : . — .
- Fisher R.M., Humphries S.E., Talmud P.J. Common variation in the lipoprotein lipase gene: effects on plasma lipids and risk of atherosclerosis (англ.) // Atherosclerosis : journal. — 1998. — Vol. 135 , no. 2 . — P. 145—159 . — doi : . — .
- Beisiegel U. Lipoprotein metabolism (англ.) // : journal. — 1998. — Vol. 19 Suppl A . — P. A20—3 . — doi : . — .
- Pentikäinen M.O., Oksjoki R., Oörni K., Kovanen P.T. Lipoprotein lipase in the arterial wall: linking LDL to the arterial extracellular matrix and much more (англ.) // : journal. — 2002. — Vol. 22 , no. 2 . — P. 211—217 . — doi : . — .
- Lichtenstein L., Berbée J.F., van Dijk S.J., van Dijk K.W., Bensadoun A., Kema I.P., Voshol P.J., Müller M., Rensen P.C., Kersten S. Angptl4 upregulates cholesterol synthesis in liver via inhibition of LPL- and HL-dependent hepatic cholesterol uptake (англ.) // : journal. — 2007. — November ( vol. 27 , no. 11 ). — P. 2420—2427 . — doi : . — .
- Lichtenstein L., Mattijssen F., de Wit N.J., Georgiadi A., Hooiveld G.J., van der Meer R., He Y., Qi L., Köster A., Tamsma J.T., Tan N.S., Müller M., Kersten S. Angptl4 protects against severe proinflammatory effects of saturated fat by inhibiting fatty acid uptake into mesenteric lymph node macrophages (англ.) // : journal. — 2010. — December ( vol. 12 , no. 6 ). — P. 580—592 . — doi : . — . — PMC .
Ссылки
- 2021-05-05
- 1