Interested Article - Фенилаланин

- 2020-10-17
- 1
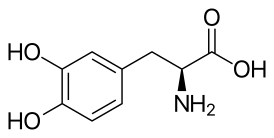
Фенилалани́н ( α-амино-β-фенилпропионовая кислота , сокр.: Фен, Phe, F) — ароматическая альфа-аминокислота . Существует в двух оптически изомерных формах l и d и в виде рацемата (dl). По химическому строению соединение можно представить как аминокислоту аланин , в которой один из атомов водорода замещён фенильной группой .
l -Фенилаланин является протеиногенной аминокислотой и входит в состав белков всех известных живых организмов. Участвуя в гидрофобных и стэкинг -взаимодействиях, фенилаланин играет значительную роль в фолдинге и стабилизации белковых структур, является составной частью функциональных центров.
Свойства
Фенилаланин представляет собой бесцветное кристаллическое вещество, разлагающееся при плавлении.
В вакууме при нагревании сублимирует . Ограниченно растворяется в воде, малорастворим в этаноле .
С азотной кислотой даёт . При нагревании подвергается декарбоксилированию .
Биосинтез
В процессе биосинтеза фенилаланина промежуточными соединениями являются шикимат , хоризмат , префенат . Фенилаланин в природе синтезируется микроорганизмами , грибами и растениями . Более подробно биосинтез фенилаланина рассмотрен в статье шикиматный путь .
Для человека, как и для всех Metazoa , фенилаланин является незаменимой аминокислотой и должен поступать в организм в достаточном количестве с белками пищи.
Суточная потребность взрослого человека — 4.4г
| Продукт | г/100г |
|---|---|
| Женское молоко | 5.9 |
| Коровье молоко | 5.7 |
| Куриное яйцо | 7.3 |
| Рыба | 4.8 |
| Мясо | 4.5 |
| Соевые бобы | 5.0 |
| Овсяные хлопья | 4.6 |
| Пшеничная мука | 4.8 |
| Картофель | 6.4 |
Катаболизм
В природе известно несколько путей биодеградации фенилаланина. Основными промежуточными продуктами катаболизма фенилаланина и метаболически связанного с ним тирозина у различных организмов выступают фумарат , пируват , сукцинат , ацетоацетат , ацетальдегид и др. У животных и человека фенилаланин и тирозин распадаются до фумарата (превращается в оксалоацетат , являющийся субстратом глюконеогенеза ) и ацетоацетата (повышает уровень кетоновых тел в крови), поэтому эти аминокислоты по характеру катаболизма у животных относят к глюко-кетогенным (смешанным) (см. классификацию аминокислот ). Основным метаболическим превращением фенилаланина у животных и человека является ферментативное гидроксилирование этой аминокислоты с образованием другой ароматической аминокислоты — тирозина .
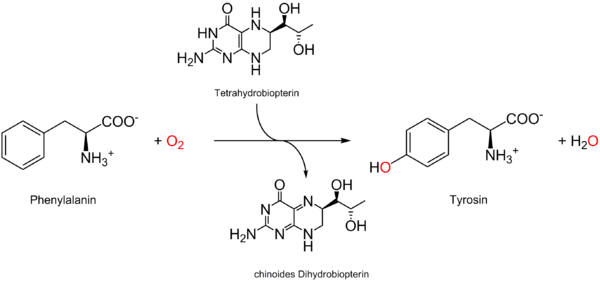
Превращение фенилаланина в тирозин в организме в большей степени необходимо для удаления избытка фенилаланина, а не для восстановления запасов тирозина, так как тирозин обычно в достаточном количестве поступает с белками пищи, и его недостатка, как правило, не возникает. Дальнейшим катаболическим превращениям подвергается именно тирозин .
Фенилаланин является предшественником циннамата — одного из основных предшественников фенилпропаноидов . Фенилаланин может метаболизироваться в один из биогенных аминов — фенилэтиламин .
При наследственном заболевании фенилкетонурии превращение фенилаланина в тирозин нарушено, и в организме происходит накопление фенилаланина и его метаболитов ( фенилпируват , , фенилацетат , орто -гидроксифенилацетат, фенилацетилглутамин), избыточное количество которых отрицательно сказывается на развитии нервной системы.
Аналоги
Известно, что некоторые соединения, структурно близкие (аналоги) протеиногенным аминокислотам, способны конкурировать с этими протеиногенными аминокислотами, и включаться вместо них в состав белков в процессе их биосинтеза (хотя, механизмы белкового синтеза способны дискриминировать аналоги в пользу канонических природных аминокислот). Такие аналоги (антагонисты протеиногенных аминокислот), являясь антиметаболитами , в той или иной мере токсичны для клеток. Для фенилаланина хорошо известны следующие аналоги.
- l -2,5-Дигидрофенилаланин (( S )-2-амино-3-(циклогекса-1,4-диенил)-пропановая кислота, pheH 2 , H 2 Phe, DHPA) — производится различными Actinobacteria (например, ) и Gammaproteobacteria (например, Photorhabdus luminescens ) как токсин, способствующий выживанию в межвидовой конкурентной борьбе, то есть играет роль антибиотика . l -2,5-Дигидрофенилаланин, как и фенилаланин, в природе синтезируется из префената , то есть шикиматным путём . В экспериментах с ауксотрофным по фенилаланину штаммом Escherichia coli ATCC 9723f удавалось добиться замещения в белках 65 % фенилаланина на 2,5-дигидрофенилаланин, без потери жизнеспособности, хотя скорость роста существенно снижалась пропорционально проценту замещения остатков фенилаланина . В клеточных белках саркомы 180 возможно замещение 33 % остатков фенилаланина, что также не летально для клеток. Показано, что l -2,5-дигидрофенилаланин способен индуцировать катепсин -зависимый апоптоз промиелоцитарных лейкозных клеток человека (HL-60) .
- Фторфенилаланины — синтетические аналоги , в которых определённые атомы водорода (обычно один из атомов водорода фенильной группы) замещён атомом фтора. Атом фтора стерически близок атому водорода (имеет чуть больший радиус Ван-дер-Ваальса (1,35 Å против 1,20 Å), хотя в других отношениях эти атомы различаются значительно — отличаясь высокой электроотрицательностью (4,0 против 2,1), фтор придаёт молекуле бо́льшую полярность , гидрофильность и создаёт так называемый), поэтому для определённых ауксотрофных по фенилаланину микроорганизмов возможна даже полная замена практически всего фенилаланина на его фторзамещённые аналоги, причём ущерб от такой замены может быть совместим с основными жизненными функциями клетки (рост, деление сильно угнетаются, замедляются, однако полностью не прекращаются) . Фторфенилаланины являются одними из самых широко используемых аналогов природных соединений в биохимических и физиологических исследованиях. Из фторфенилаланинов наиболее хорошо известен и наиболее популярен в исследованиях пара -фторфенилаланин (4-фторфенилаланин, 4fF, pFF, PFPA). Включение в белки п -фторфенилаланина вместо фенилаланина может положительно либо отрицательно сказываться на таких их свойствах, как активность, стабильность и термостойкость . Как правило, п -фторфенилаланин оказывает сильное ингибирующее влияние на темпы роста «отравленных» им микроорганизмов (в его присутствии лаг-фаза длится дольше, а экспоненциальный рост сменяется), а не его степень (урожайность клеточных культур при добавлении аналога может даже возрастать). Часто процессы деления подавляются сильнее, чем рост — в этом случае размер клеток с каждым делением возрастает вплоть до возникновения гигантских клеток (в случае дрожжей ) или аномально удлинённых палочек (в случае бактерий ). Включаясь в структуру флагеллинов , п -фторфенилаланин нарушает структуру и функционирование бактериальных ( Salmonella Typhimurium ) жгутиков (формируются функционально неполноценные «завитые» правозакрученные жгутики вместо нормальных левозакрученных) . В результате мутаций бактерии могут быстро развивать устойчивость к фторфенилаланинам, поэтому фторфенилаланины не могут быть эффективными противобактериальными средствами.
- Пиридилаланины — 2-азафенилаланин (2aF), 3-азафенилаланин (3aF), 4-азафенилаланин (4aF) — синтетические аналоги, структурное отличие от фенилаланина заключается в «замене» одной из бензольного остатка на атом азота ( пиридиновое ядро вместо бензольного ).
- Прочие аналоги фенилаланина: β-фенилсерин, β-2-тиенилаланин, β-3-тиенилаланин, β-2-фурилаланин, β-3-фурилаланин, β-(1-циклопентен)-аланин .
- Кроме вышеупомянутых аналогов известны и другие (например, α-азафенилаланин, конформационно-фиксированные аналоги, такие как 1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота ), которые фигурируют в различных исследованиях, в том числе и по поиску новых лекарств (биологически активные псевдопептиды и другие).
Производство и применение
Фенилаланин в промышленных масштабах получают микробиологическим способом . Возможен также химический синтез (синтез Эрленмейера из бензальдегида , синтез Штрекера из) с последующим разделением рацемической смеси при помощи ферментов . Используют фенилаланин для сбалансирования кормов для животных, как компонент спортивного питания, как пищевая добавка. Значительная часть фенилаланина идёт на производство дипептида аспартама — синтетического сахарозаменителя, активно использующегося в пищевой промышленности , чаще в производстве жевательной резинки и газированных напитков . Употребление таких продуктов противопоказано лицам, страдающим фенилкетонурией .
Примечания
- ↑ Лысиков Ю.А. // Экспериментальная и клиническая гастроэнтерология. — 2012. — Вып. 2 . — С. 88–105 . — ISSN . 28 января 2022 года.
- ↑ Robert E. Marquis. Fluoroamino Acids and Microorganisms (англ.) // Handbuch der experimentellen Pharmakologie : Научный журнал. — 1970. — Vol. 20 , no. 2 . — P. 166—192 . — doi : .
- Jason M. Crawford, Sarah A. Mahlstedt, Steven J. Malcolmson, Jon Clardy, Christopher T. Walsh. Dihydrophenylalanine: A Prephenate-Derived Photorhabdus luminescens Antibiotic and Intermediate in Dihydrostilbene Biosynthesis (англ.) // Chemistry & Biology : Научный журнал. — 2011. — Vol. 18 , no. 9 . — P. 1102—1112 . — doi : . — .
- ↑ Martin J. Pine. (англ.) // Antimicrobial Agents and Chemotherapy : Научный журнал. — 1975. — Vol. 7 , no. 5 . — P. 601—605 . — . 11 августа 2021 года.
- Kiso T., Usuki Y., Ping X., Fujita K., Taniguchi M. l -2,5-Dihydrophenylalanine, an inducer of cathepsin-dependent apoptosis in human promyelocytic leukemia cells (HL-60) (англ.) // The Journal of Antibiotics (Tokyo) : Научный журнал. — 2001. — Vol. 54 , no. 10 . — P. 810—817 . — doi : . — .
- Munier R. L. Substitution totale de la phénylalanine par l’ o - ou la m -fluorophénylalanine dans les protéines d’ Escherichia coli (фр.) // Comptes rendus hebdomadaires des séances de l’Académie des sciences : Научный журнал. — 1959. — Vol. 248 , n o 12 . — P. 1870—1873 . — .
- Peter James Baker and Jin Kim Montclare. Enhanced Refoldability and Thermoactivity of Fluorinated Phosphotriesterase (англ.) // ChemBioChem : Научный журнал. — 2011. — Vol. 12 , no. 12 . — P. 1845—1848 . — doi : . — .
- Iino T. (англ.) // Bacteriological Reviews : Научный журнал. — 1969. — Vol. 33 , no. 4 . — P. 454—475 . — . 11 августа 2021 года.
- M. H. Richmond. (англ.) // Bacteriological Reviews : Научный журнал. — 1962. — Vol. 26 , no. 4 . — P. 398—420 . — .
- Yingjie Zhang, Hao Fang, Wenfang Xu. Applications and Modifications of 1,2,3,4-Tetrahydroisoquinoline-3-Carboxylic Acid (Tic) in Peptides and Peptidomimetics Design and Discovery (англ.) // Current Protein & Peptide Science : Научный журнал. — 2010. — Vol. 11 , no. 8 . — P. 752—758 . — doi : . — .
- Johannes Bongaerts, Marco Krämer, Ulrike Müller, Leon Raeven, Marcel Wubbolts. (англ.) // Metabolic Engineering : Научный журнал. — 2001. — Vol. 3 , no. 4 . — P. 289—300 . — doi : . — . 11 марта 2016 года.
- K. Arvid J. Wretlind. (англ.) // Journal of Biological Chemistry : Научный журнал. — 1950. — Vol. 186 , no. 1 . — P. 221—224 . — . 23 марта 2020 года.
Литература
- Химическая энциклопедия / Редкол.: Зефиров Н. С. и др.. — М. : Большая Российская энциклопедия, 1998. — Т. 5 (Три-Ятр). — 783 с. — ISBN 5-85270-310-9 .
- 2020-10-17
- 1