Фторид марганца(III)
- 1 year ago
- 0
- 0

Фтори́д ура́на(VI) (другие названия — гексафторид урана , шестифтористый уран ) — бинарное соединение урана со фтором , прозрачные летучие светло-серые кристаллы. Связь уран-фтор в нём носит ковалентный характер. Обладает молекулярной кристаллической решеткой . Очень ядовит .
Является единственным соединением урана, переходящим в газообразное состояние при относительно низкой температуре , в связи с этим широко используется в обогащении урана — разделении изотопов 235 U и 238 U , одном из основных этапов производства топлива для ядерных реакторов и оружейного урана.
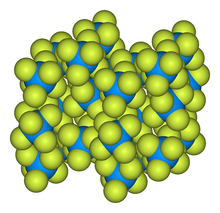

При нормальных условиях гексафторид урана представляет собой светло-серые, желтоватые или прозрачные летучие кристаллы ромбической сингонии , параметры ячейки a = 0,9924 нм , b = 0,8954 нм , c = 0,5198 нм , Z = 4 с плотностью 5,09 г/см 3 . При атмосферном давлении возгоняется при нагреве до 56,4 °C, однако при небольшом увеличении давления (например, при нагреве в запаянной ампуле ) может быть переведён в жидкость. Критическая температура 230,2 °C, критическое давление 4,61 МПа .
Энтальпия возгонки
Δ
H
0
возг = 48,07 кДж/моль (56,5 °C). Молярная теплоёмкость
C
0
p
= 167 Дж/(моль·К) . Энтальпия образования
Δ
H
0
обр = −2197 кДж/моль . Энтропия
S
0
298 = 227,6 Дж/(моль·К)
.
Гексафторид урана радиоактивен , вклад в его радиоактивность вносят все три природных изотопа урана ( 234 U, 235 U и 238 U). Удельная активность гексафторида урана с природным содержанием изотопов урана (не обеднённого и не обогащённого) составляет 1,7×10 4 Бк /г ; чуть меньше половины активности (48,9%) обусловлено распадом 238 U, такая же часть — распадом 234 U (эти два природных изотопа урана находятся в радиоактивном равновесии , поэтому их удельная активность в природном уране обычно одинакова); небольшая часть активности (2,3%) обусловлена 235 U. Удельная активность обеднённого (то есть с уменьшенным содержанием 235 U и 234 U) гексафторида урана до двух раз ниже, высокообогащённого по изотопу уран-235 может быть даже на два порядка выше и зависит от степени обогащения ураном-235 и ураном-234 .
Величины радиоактивности относятся к свежеприготовленному веществу, в котором отсутствуют все дочерние нуклиды уранового ряда , кроме урана-234. Со временем, в течение примерно 150 дней после получения соединения в гексафториде урана накапливаются дочерние изотопы и восстанавливается естественное радиоактивное равновесие по концентрации короткоживущих нуклидов 234 Th и 234 Pa (дочерние нуклиды урана-238) и 231 Th (дочерний нуклид урана-235); в результате удельная активность «старого» гексафторида урана с исходно природным содержанием изотопов увеличивается до 4,0×10 4 Бк /г .
Плотность паров гексафторида урана в большом диапазоне давлений и температур может быть выражена формулой:
где — плотность пара, кг/л;
Давление паров (мм рт. ст.) при температуре (°C) можно найти по следующим эмпирическим формулам :122 .
Для диапазона температур 0…64 °C (над твёрдым веществом, точность 0,05 %):
Для диапазона температур 64…116 °C (над жидкостью, точность 0,03 %):
Для диапазона температур 116…230 °C (над жидкостью, точность 0,3 %):
Бурно реагирует с водой и при нагревании с органическими растворителями; при обычных условиях растворяется в органических растворителях.
Взаимодействуя с водой, образует фторид уранила и фтороводород :
Сильный окислитель. В жидком виде реагирует со многими органическими веществами со взрывом, поэтому в аппаратах, заполняемых гексафторидом урана, нельзя использовать обычные углеводородные смазки, герметизирующие замазки и уплотнители.
Не реагирует с полностью фторированными углеводородами , такими как тефлон или . Не взаимодействует при нормальных условиях с кислородом и азотом , а также с сухим воздухом, однако реагирует с парами воды, содержащимися во влажном воздухе. В отсутствие паров и следов воды не вызывает существенной коррозии алюминия , меди , никеля , монель-металла , алюминиевой бронзы .
Взаимодействует с фторидами щелочных металлов ( LiF , NaF , KF ), фторидом аммония , фторидом нитрозила , некоторыми фторидами щёлочноземельных металлов , образуя фтороуранаты(IV). При нагревании восстанавливается водородом , аммиаком , тетрахлоруглеродом до UF 4 .
Фторид урана(VI) может быть использован в качестве фторирующего реагента в производстве фторорганических соединений . При фторировании органических соединений гексафторид обычно восстанавливается до тетрафторида урана . Процесс фторирования гексафторидом урана идёт с выделением большого количества тепла.
Фторирование непредельных органических соединений сопровождается присоединением фтора по двойной связи . Так, из гексафторпропилена образуется :
Из фтористого винилиденфторида образуется 1,1,1,2-тетрафторэтан :
Фторирование трихлорэтилена сопровождается образованием :
Фторирование предельных органических соединений фторидом урана(VI) сопровождается замещением одного или нескольких атомов водорода в исходном соединении на фтор :


Применяется при разделении изотопов 235 U и 238 U методами газовой диффузии или центрифугирования для обеспечения делящимся веществом различных ядерных технологий . При этом образуется значительное количество неиспользуемых остатков (обеднённых по урану-235), обычно хранимых в виде гексафторида урана в контейнерах (см. Обеднённый гексафторид урана ). Ныне на площадках при обогатительных заводах накоплены огромные количества гексафторида. Общее количество накопившегося гексафторида урана в мире на 2010 год составляет около 2 млн тонн .
Обеднённый гексафторид урана используют для фторирования органических соединений. Получаемые с использованием гексафторида урана в качестве фторирующего агента октафторпропан (C 3 F 8 , хладон-218, R-218, FC-218) и 1,1,1,2-тетрафторэтан (CF 3 -CFH 2 , хладон-134a, R-134, HFC-134a) являются альтернативной заменой озоноразрушающим хладоагентам. Озоноразрушающий потенциал ODP равен нулю. 1,2-Дифтортрихлорэтан (CFCl 2 CFClH, хладон-122а, R-122a, HCFC-122a) является альтернативной заменой озоноразрушающих фторхлоруглеродных растворителей. Его можно применить в качестве растворителя, экстрагента, вспенивающего агента при производстве полимерных изделий, анестетика для животных .
На конец 2010-х годов в результате изотопного обогащения урана в мире накоплено около 1,5-2 млн тонн обеднённого урана, ежегодно добавляется ещё 40-60 тыс. тонн обеднённого урана . Подавляющая часть этого объёма хранится в виде обеднённого гексафторида урана (ОГФУ) в специальных стальных ёмкостях. По мере совершенствования технологий изотопного обогащения старые запасы ОГФУ иногда дообогащают. Однако длительное хранение столь большого количества химически опасных веществ нежелательно, поэтому существуют технологии конверсии гексафторида урана в менее опасные формы, например оксиды урана или тетрафторид урана UF 4 .
Известны проекты химической переработки гексафторида во Франции, США, России, Великобритании . Производительность действующих на 2018 год предприятий конверсии ОГФУ — свыше 60 тыс. тонн в год в пересчете на уран. Во Франции конверсия ведётся с 1980-х годов, на 2018 год мощность — 20 тыс. тонн в год. В 2000-х годах две установки мощностью 18 тыс. и 13,5 тыс. тонн в год введены в строй в США. В Великобритании строят установку мощностью 7 тыс. тонн. В России первая промышленная установка по французской технологии введена в строй в 2009 году на Электрохимическом заводе в Зеленогорске (Красноярский край) . В 2010 году там же введена в строй установка восстановления ОГФУ в низкотемпературной плазме по российской технологии. Мощность этих двух установок — около 10 тыс. тонн в год. Все эти установки получают закись-окись урана и фтороводород . Также на Ангарском химкомбинате разрабатывают опытно-демонстрационную установку «Кедр» мощностью 2 тыс. тонн в год с получением тетрафторида урана по технологии восстановления ОГФУ в водородном пламени.


В России — класс опасности 1, максимальная разовая ПДК в воздухе рабочей зоны — 0,015 мг/м 3 (1998 год) . В США предельный пороговый уровень однократного воздействия согласно ACGIH — 0,6 мг/м 3 (1995 год).
Чрезвычайно едкое вещество, разъедающее любую живую органику с образованием химических ожогов. При контакте рекомендуется промывка большим количеством воды. Воздействие паров и аэрозолей вызывает отёк лёгких . Всасывается в организм через лёгкие или желудочно-кишечный тракт. Очень токсичен, вызывает тяжёлые отравления. Обладает кумулятивным эффектом с поражением печени и почек.
Уран слаборадиоактивен. Загрязнение окружающей среды соединениями урана создаёт риск радиационных аварий.
В нормальных условиях представляет собой быстро испаряющееся твёрдое вещество. Парциальное давление паров — 14 кПа. Вокруг твёрдого вещества быстро образуется опасная концентрация паров.
Бурно реагирует с водой, в том числе с атмосферной влагой с образованием UO 2 F 2 ( фторид уранила ) и фтороводорода HF.
Вещество является сильным окислителем. Хорошо реагирует с органическими веществами. Медленно реагирует со многими металлами, образуя фториды металлов. Агрессивен в отношении резины и многих пластиков. Реагирует с ароматическими соединениями типа бензола и толуола .
Не горюч, но при нагреве (в том числе в огне) выделяет едкие токсичные пары. Запрещается применение воды при тушении пожара. Допустимо применение порошковых и углекислотных средств тушения.