Ларри Краун
- 1 year ago
- 0
- 0

18-Краун-6 — органическое соединение состава C 12 H 24 O 6 , относящееся к классу циклических простых эфиров ( краун-эфиры ) и имеющее в единственном цикле 6 атомов кислорода, расположенных в симметричном порядке. Представляет собой белые гигроскопичные кристаллы с низкой температурой плавления. Находит широкое применение как специфичный комплексообразователь для ионов калия K + . Синтез краун-эфиров принёс Нобелевскую премию Чарлзу Педерсену (1987 год).
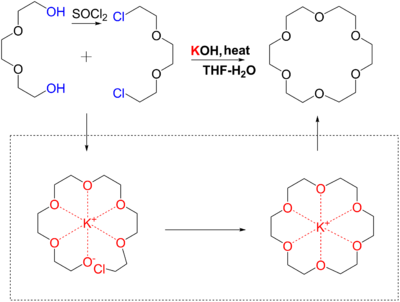
18-Краун-6 синтезируют по реакции Вильямсона , где в качестве строительных блоков выступают две олигоэтиленгликольные заготовки: одна — с гидроксильными группами, а другая — с какими-либо уходящими группами, например, хлоридом или тозилатом:
В данном синтезе катион калия выступает в качестве координирующего иона и позволяет получить именно циклический эфир, избежав образования эфирных макроцепей. Это достигается за счёт того, что при сшивке двух концов реагирующих молекул, другие два конца сближаются в пространстве за счёт координации атомов кислорода вокруг иона калия .
Также 18-краун-6 может быть получен путём олигомеризации оксида этилена в присутствии ионов калия .
18-Краун-6 представляет собой белые кристаллы, плавящиеся при температуре 36,5—38 °С. Он очень гигроскопичен и легко растворим в воде и большинстве органических растворителей .
Подобно другим простым эфирам, 18-краун-6 химически и термически стабилен .

18-Краун-6 позволяет солюбилизировать соли металлов в полярных и неполярных органических растворителях. Поскольку диаметр полости в молекуле этого краун-эфира составляет 2,6—3,2 Å, а и ионный диаметр иона калия равен 2,66 Å, 18-краун-6 более специфичен по отношению к этому металлу. Тем не менее, он также эффективно координируется с ионами натрия и цезия .
| Константы устойчивости (lg K s ) комплексов 18С6 с катионами металлов | |||||
|---|---|---|---|---|---|
| Растворитель | Na + | K + | Cs + | Sr 2+ | Ba 2+ |
| вода | 0,80 | 2,03 | 0,99 | 2,72 | 3,87 |
| метанол | 4,36 | 6,06 | 4,79 | >5,5 | 7,04 |
Вследствие комплексообразования краун-эфира с катионами калия происходит образование реакционноспособных анионов. Реакционноспособность анионов увеличивается по двум причинам. Во-первых, неполярные (например, бензол ) или полярные апротонные растворители ( ацетонитрил ) не должны иметь большого сродства к анионам, вследствие чего анион в их среде не сольватирован. Во-вторых, физическое удаление закомплексованного краун-эфиром катиона от аниона уменьшает силу кулоновского взаимодействия. За счёт этого в дальнейших реакциях аниона снижается энергия активации, и он приобретает более нуклеофильные и более основные свойства. Такие анионы получили название «голых» анионов ( англ. naked) .