Проба благородных металлов
- 1 year ago
- 0
- 0

Амиды металлов MeNH 2 — неорганические соединения, содержащие ионы NH 2 − . Являются производными аммиака , у которого атом водорода замещён на атом металла.
Устойчивые амиды получены для щелочных и щелочноземельных металлов.
Амиды являются аналогами гидроксидов, но являются более сильными основаниями. Некоторые амиды растворяются в аммиаке, причем амид растворим в аммиаке так же, как и гидроксид этого металла в воде. Аммиачные растворы амидов проводят электрический ток.
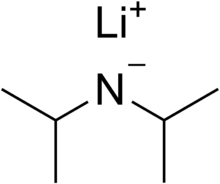
В амиде один или два атома водорода могут быть замещены на органические радикалы, как, например, в диизопропиламиде лития LiN(C 3 H 7 ) 2
Амиды образуются при взаимодействии активных металлов с аммиаком . Так, амид натрия NaNH 2 получают пропусканием газообразного аммиака над расплавленным натрием , либо реакцией натрия с жидким аммиаком. Эта реакциСя обусловлена кислотными свойствами аммиака :
Амиды подвергаются необратимому гидролизу:
а также алкоголизу , с образованием алкоголятов :
Амиды реагируют с солями аммония:
Амиды находят применение в качестве восстановителей в органическом синтезе.