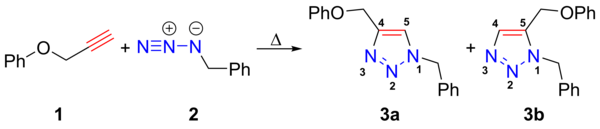
Interested Article - Азид бария
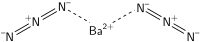
- 2020-04-27
- 1
Азид бария — неорганическое соединение , соль металла бария и азотистоводородной кислоты , бесцветное кристаллическое вещество, растворяется в воде, при выпаривании образует кристаллогидрат Ba(N 3 ) 2 · H 2 O.
Взрывоопасен, хотя менее чувствителен к механическим воздействиям, чем азид свинца .
Получение
Образуется при реакции свежеперегнанной азотистоводородной кислоты с гидроокисью бария :
Физические свойства
Азид бария образует бесцветные кристаллы моноклинной сингонии , пространственная группа P 2 1 /m , параметры ячейки a = 0,702 нм, b = 2,929 нм, c = 0,622 нм, β = 105,23°.
Применение
При нагревании свыше 45 °C разлагается:
Этот процесс может быть использован для получения особо чистого азота или чистого металлического бария (например, для использования в качестве геттера ). Быстрое разложение начинается при температуре 160 —180 °C; вспыхивает при 217 °C , взрывается при температуре свыше 225 °C .
Используется также для получения азидов других металлов (лития, натрия, калия, рубидия и цинка) из их сульфатов :
Токсичность
Как все азиды и растворимые соли бария, азид бария токсичен.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М. : Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М. - Л. : Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л. : Химия, 1971. — Т. 2. — 1168 с.
- Руководство по неорганическому синтезу: В 6-ти т. / Ред. Брауэр Г.. — М. : Мир, 1985. — Т. 3. — 392 с.
Примечания
- B. L. Evans, A. D. Yoffe, Peter Gray. Physics and Chemistry of the Inorganic Azides (англ.) // (англ.) (: journal. — 1959. — Vol. 59 , no. 4 . — P. 561 . — doi : .
- ↑ Tiede, E. (1916) «Die Zersetzung der Alkali- und Erdalkali-azide im Hochvakuum zur Reindarstellung von Stickstoff» Ber. Dtsch. Chem. Ges. 49 : 1742—1745. doi :
- ↑ Audrieth, L. F. (1934) «Hydrazoic Acid and Its Inorganic Derivatives» Chem. Rev. 15 : 169—224. doi :
- H. D. Fair and R. F. Walker. Physics and Chemistry of the Inorganic Azides // Energetic Materials. — New York and London: Plenum Press, 1977. — Vol. 1.
- 2020-04-27
- 1