Хорошие статьи
- 1 year ago
- 0
- 0
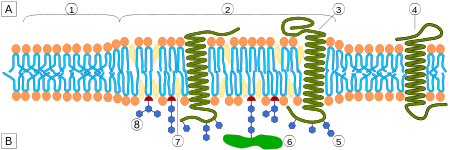
Липи́дные ра́фты — особые участки (микродомены) плазматической мембраны , обогащённые гликосфинголипидами и холестерином . Эти участки координируют клеточные процессы, влияют на , служат организующими центрами для сборки сигнальных молекул , регулируют перемещение мембранных белков , рецепторов , а также регулируют нейротрансмиссию . Липидные рафты более структурированы и упакованы плотнее, чем окружающий их липидный бислой ; при этом они способны свободно в нём перемещаться .
До 1982 года было широко распространено мнение, что фосфолипиды и мембранные белки распределены в клеточной мембране случайным образом — в соответствии с строения клеточной мембраны, предложенной в 1972 году и . В модели предполагалось, что мембранные белки «плавают» в однородном липидном море .
Однако в 1970-х годах А. Штир и Э. Закман, а также М. Дж. Карновски с коллегами с использованием физических методов доказали существование особых мембранных микродоменов . Существование этих микродоменов объяснялось физическими свойствами и организацией липидных смесей . В 1974 году наблюдение влияния температуры на поведение мембраны позволило выдвинуть предположение о существовании в мембранах «кластеров липидов», а в 1975 году было открыто, что эти кластеры могут представлять собой «квазикристаллические» участки, располагающиеся внутри более жидких липидных областей. В 1978 году исследования с использованием дали новый толчок развитию идеи «кластеров» и позволили определить микродомены как «липиды в более упорядоченном состоянии». В 1982 году Карновски и его сотрудники сформулировали концепцию липидных доменов в мембране. Их исследования установили неоднородность во времени жизни флуоресценции молекул 1,6-дифенил-1,3,5-гексатриена , что свидетельствует о наличии нескольких липидных фаз в мембране . Один тип таких микродоменов образован холестерином и сфинголипидами . Они формируются в результате выделения данных липидов в отдельную фазу, что было показано экспериментально . Также было установлено, что такие микродомены («рафты») имеются и в клеточных мембранах .
В результате постепенно сформировалась новая концепция строения клеточной мембраны, отражающая динамическую реструктуризацию с формированием молекулярных высокоуровневых кластеров . Термин «липидные рафты» был впервые предложен в 1988 году и . Они применили данный термин ( англ. lipid raft ‘липидный плот’) к участкам плотно упакованного липида, плавающего на поверхности более текучего фосфолипида . Первоначально концепция рафтов использовалась для объяснения транспорта холестерина из транс -отдела аппарата Гольджи в плазматическую мембрану. Эту идею впервые представили Симонс и Э. Иконен в 1997 году . В 2006 году на Главном симпозиуме по липидным рафтам и клеточным функциям ( англ. Keystone Symposium of Lipid Rafts and Cell Function ) липидные рафты были определены как «небольшие (10—200 нм), гетерогенные, высоко динамичные домены, обогащенные стеролами и сфинголипидами, которые компартментализуют клеточные процессы. Небольшие рафты могут иногда объединяться в более крупные через белок-белковые взаимодействия». В последнее время было опубликовано много противоречивых работ, касающихся липидных рафтов; к числу спорных моментов можно отнести размер и время существования липидных рафтов (подробнее ).
К настоящему моменту следующие вопросы о липидных рафтах остаются без ответов :
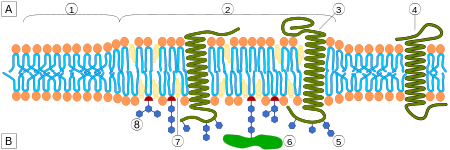
Одним из главных различий липидных рафтов и плазматической мембраны является их липидный состав. Исследования показали, что липидные рафты содержат в 3—5 раз больше холестерина, чем окружающий их липидный бислой . Кроме того, липидные рафты обогащены сфинголипидами — например, сфингомиелином , содержание которого в липидных рафтах обычно на 50 % превышает таковое в плазматической мембране. Глицерофосфолипидов в рафтах практически нет . Чтобы компенсировать повышенное содержание сфингомиелина, доля фосфатидилхолина в липидных рафтах снижена, в результате чего процент холин -содержащих липидов в них также почти на 50 % ниже по сравнению с окружающей мембраной. Холестерин предпочтительнее взаимодействует со сфинголипидами (хотя и не только с ними), что обусловлено их структурой и степенью насыщения их углеводородных цепочек. Хотя не все фосфолипиды в рафте полностью насыщены, их гидрофобные ацильные группировки более насыщены и упакованы плотнее, чем в липидах окружающего бислоя .
Холестерин служит динамическим «клеем», который скрепляет липиды рафта воедино и заполняет все пустоты между ними. Из-за жёсткой природы стерольной группы холестерин предпочтительнее располагается в рафтах, где длинные насыщенные ацильные хвосты сфинголипидов могут образовывать более компактные и прочные связи с его кольцевой системой, чем более короткие и часто ненасыщенные хвосты фосфолипидов окружающего бислоя. По этой причине липидные рафты являются менее жидкими по сравнению с остальным бислоем .
Некоторые исследователи связывают возникновение рафтов в модельных мембранах с разделением мембраны на (Lo-фаза) и неупорядоченную (Ld-, или Lα-фаза) жидкие фазы . Причины такого разделения на фазы неясны, однако их несмешиваемость, по-видимому, сводит к минимуму свободную энергию этих двух фаз. Показано, что липидные рафты и окружающая мембрана имеют различную толщину по причине того, что углеводородные цепи у сфинголипидов более длинные и прямые, чем у других липидов мембраны . Это приводит к тому, что гидрофобные слои рафтов и остального бислоя не стыкуются друг с другом на границе двух фаз. Было установлено, что такое различие в толщине увеличивает поверхностное натяжение на границе разделения двух фаз, в результате чего возникают более крупные рафты с округлыми границами, и тем самым затраты энергии на поддержание рафтов как отдельных фаз сводятся к минимуму. Другие спонтанные события — такие, как изгиб мембраны или слияние мелких рафтов в более крупные — могут также минимизировать натяжение на границе разделения фаз .
Из-за своего строения и устойчивости к действию не ионных детергентов — таких, как Triton X-100 или Brij-98 — липидные рафты также называют детергент-нерастворимыми комплексами, обогащёнными гликолипидами ( англ. detergent-insoluble glycolipid-enriched complexes (GEMs) or DIGs ) или детергент-устойчивыми мембранами ( англ. Detergent Resistant Membranes (DRMs) ). Это свойство липидных рафтов можно использовать для того, чтобы оценить долю поверхности клетки, занятой рафтами, по фракции, устойчивой к солюбилизации детергентами. В некоторых случаях она может составлять 50 %. Косвенные измерения размеров рафтов позволяют грубо оценить диаметр одного рафта в 50 нм (впрочем, на этот счёт есть и другие мнения, ).
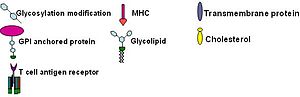
Липидные рафты чрезвычайно обогащены интегральными мембранными белками двух классов: одни заякорены в мембране при помощи двух ковалентно связанных с этими белками длинноцепочечных насыщенных жирных кислот (две пальмитоильные или пальмитоильная и миристоильная группы), а другие — посредством гликозилфосфатидилинозитольного (GPI-) якоря. Между белками рафта и остального бислоя происходит постоянный обмен: мембранные белки могут заходить внутрь рафтов и выходить наружу за время порядка нескольких секунд . Для процесса, в котором взаимодействуют два мембранных белка, их одновременное присутствие в одном и том же рафте очень сильно увеличивает вероятность их столкновения. Поэтому некоторые мембранные рецепторы и сигнальные белки обособляются вместе именно в мембранных рафтах, причём передачу сигнала через эти белки можно прервать с помощью манипуляций, которые выводят холестерин из мембраны и разрушают рафты; таким образом, липидные рафты принимают участие во многих сигнальных путях клетки .
Предполагают существование двух типов липидных рафтов: планарные (также известные как некавеолярные , или гликолипидные рафты) и кавеолярные липидные рафты. Планарные липидные рафты лежат в плоскости плазматической мембраны (не образуют впячиваний) и не имеют отличительных морфологических особенностей. Кавеолярные рафты, напротив, формируют в плазматической мембране колбообразные впячивания, содержащие белок кавеолин , который входит в состав особых углублений мембраны — кавеол ; большинство наблюдаемых рафтов относятся к этому типу. Кавеолины интенсивно экспрессируются в мозге , микрососудах нервной системы , эндотелиальных клетках, астроцитах , олигодендроцитах , шванновских клетках , спинальных ганглиях и нейронах гиппокампа . Планарные рафты содержат белок и встречаются в нейронах, лишённых кавеол. Оба типа рафтов имеют сходный липидный состав (обогащены холестерином и сфинголипидами). Флотиллин и кавеолин обладают способностью рекрутировать сигнальные молекулы к липидным рафтам, тем самым играя важную роль в передаче сигналов, опосредованной нейромедиаторами . Было высказано предположение, что эти микродомены отвечают за такую пространственную организацию сигнальных молекул, которая способствует кинетически выгодным взаимодействиям, необходимым для передачи сигнала. Впрочем, эти же микродомены и разделяют сигнальные молекулы, подавляя ненужные взаимодействия и приводя к затуханию сигнала .
Термин «передача сигнала» относится к любому процессу, при помощи которого клетка превращает один тип сигнала или стимула в другой. Путь сигнала или стимула может быть простым, как в случае с молекулами рецепторов. Более сложная передача сигнала включает участие комплексов лиганд -рецептор во многих внутриклеточных процессах, например, фосфорилирование тирозинкиназами или . Специфичность и точность передачи сигнала необходимы для эффективного ответа клетки на изменения окружающей среды . Отчасти это достигается при помощи различной локализации белков, участвующих в сигнальных путях. В плазматической мембране отчасти такую компартментализацию осуществляют липидные рафты .
Одним из важных доказательств в пользу существования липидных рафтов является их работа как платформ, на которых концентрируются отдельные рецепторы после активации при связывании с лигандом . Если же активация рецептора происходит в самом липидном рафте, то сигнальный комплекс оказывается защищённым рафтом от внешних ферментов , например, мембранных фосфатаз . В общем, липидные рафты привлекают белки в новую микросреду, так что их (де)фосфорилированное состояние может быть изменено локальными киназами и фосфатазами и дать начало последующим реакциям сигнального пути . Было установлено, что липидные рафты участвуют во многих сигнальных путях — например, сигнальном пути , Т- и В-клеточных антигеновых рецепторов, рецептора эпидермального фактора роста (EGF), инсулинового рецептора и др. Некоторые примеры таких сигнальных путей приведены ниже.
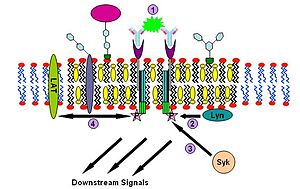
Изучение сигнального пути иммуноглобулина Е (IgE) впервые убедительно продемонстрировало участие липидных рафтов в передаче сигнала . Доказательствами участия липидных рафтов в этом процессе служат сниженная растворимость Fc-эпсилон рецепторов (FcεR) в детергенте Triton X-100 при переходе от одиночного состояния к связанному поперечными сшивками с другим рецептором того же типа ; формирование скоплений из ганглиозидов и GPI-заякоренных белков, достаточно больших для того, чтобы быть различимыми в флуоресцентный микроскоп ; прекращение работы пути при удалении поверхностного холестерина при помощи метил-β- циклодекстрина и др.
Последовательность событий этого сигнального пути такова. Сначала IgE связывается с Fc-эпсилон рецепторами, находящимися в плазматических мембранах тучных клеток и базофилов , через их Fc-сегмент. Тетрамер FcεR состоит из одной α-, одной β- и двух γ-цепей . Сначала один тетрамер FcεR связывается с одной молекулой IgE. С IgE связывается α-цепь, а три другие цепи содержат ( англ. immune receptor tyrosine-based activation motifs (ITAM) ). Далее олигомерный антиген связывается с несколькими молекулами IgE, уже связанным к тому моменту с FcεR, сшивая вместе два или более рецепторных комплексов. После такого соединения для фосфорилирования ITAM двух рецепторов привлекается дважды Src -подобная тирозинкиназа . Далее тирозинкиназа семейства Syk связывается с фосфотирозиновыми остатками ITAM (результат работы Lyn) и начинает сигнальный каскад . Syk, в свою очередь, может активировать другие белки, например, LAT. Белки LAT, связываясь друг с другом, могут рекрутировать в рафт другие белки и дополнительно амплифицировать (усиливать) сигнал .

Т-клеточный антигеновый рецептор (TCR) — это молекула, имеющаяся на поверхности Т-лимфоцитов (Т-клеток). Он включает в себя αβ- гетеродимер , CD3- (γδε) комплекс и ξ-гомодимер. α- и β- субъединицы содержат внеклеточные сайты связывания для пептидов , которые представлены на белках главного комплекса гистосовместимости (МНС) и классов, расположенных на поверхности антигенпрезентирующих клеток (APC). CD3- и ξ-субъединицы содержат цитоплазматические мотивы ITAM. При передаче сигнала молекулы MHC связываются с TCR, соединяя два или более рецептора вместе. Такое соединение рецепторов, как и в сигнальном пути IgE, рекрутирует дважды ацетилированные нерецепторные Src-подобные тирозинкиназы для фосфорилирования мотивов ITAM. TCR привлекает не только тирозинкиназу Lyn, но и Fyn . После этого белок , не участвующий в сигнальном пути IgE, связывается с фосфорилированными ITAM, благодаря чему активируется сам и активирует LAT. Активация LAT даёт амплификацию сигнала. Другое отличие сигнального пути TCR от сигнального пути IgE заключается в том, что TCR активируют белок Lck , что может приводить к более сильной кластеризации рафтов и тем самым дополнительно усиливать сигнал. Одним из возможных механизмов отрицательной регуляции этого пути может быть связывание цитозольной киназы Csk с ассоциированным с рафтами белком CBP . После этого Csk может подавлять работу киназ семейства Src через фосфорилирование .
В-клеточный антигеновый рецептор (BCR) представляет собой комплекс мембранносвязанной молекулы иммуноглобулина (mIg) и гетеродимера Igα-Igβ, состоящего из двух полипептидов , которые связаны друг с другом дисульфидными связями . И Igα, и Igβ содержат мотив ITAM.
Сигнальный путь BCR схож с сигнализацией IgE и TCR. Широко распространено мнение, что, помимо действия через BCR, липидные рафты могут принимать участие во многих событиях, происходящих на поверхности В-клетки при её активации. К функциям липидных рафтов в В-клетках относится их участие в сигнальном пути BCR, модуляция работы сигнальных путей при помощи корецепторов , сигнальные пути CD40 , эндоцитоз пептидных антигенов, связанных с BCR, и их последующая загрузка в ранние эндосомы (пептиды, образующиеся при разрушении пептидного антигена ферментами эндосом, в дальнейшем будут выставлена на поверхности клетки в комплексе с молекулами MHC II и презентированы Т-клеткам) .
Для проникновения в клетку вирусов , облигатных внутриклеточных паразитов , необходимо специфическое взаимодействие вируса и клеточных рецепторов на плазматической мембране. Накапливаются подтверждения того, что вирусы попадают в клетку через специфические мембранные микродомены, в том числе липидные рафты.
Наиболее хорошо изученными примерами проникновения в клетку через липидные рафты вирусов, не имеющих оболочки, являются вирус обезьян SV40 ( сем. Papovaviridae ) и эховирус I типа (EV1, сем. Picornaviridae ) .
Для проникновения в клетку SV40 использует два различных рецептора: ганглиозид , располагающийся в липидных рафтах, и молекулу MHC I типа . Связывание SV40 с молекулой MHC I типа вызывает кластеризацию и перераспределение рецепторов. SV40 может привлечь к себе больше кавеол из цитоплазмы и даже вызвать образование новых кавеол в месте проникновения. Сигнальный каскад, запускаемый при присоединении вируса к клетке, приводит к опосредованному кавеолами эндоцитозу вируса в течение 20 минут. В некоторых типах клеток вирус может проникать в кавеосомы (отпочковавшиеся от мембраны кавеолы) непосредственно из неокаймлённых везикул , отпочковавшихся от липидных рафтов .
EV1 в качестве клеточного рецептора использует интегрин α2β1 . Множество интегриновых гетеродимеров может связываться с соседними участками на капсиде вируса. Как и в случае с SV40, прикрепление вируса и его связывание с клеткой запускает кластеризацию и перемещение молекул интегрина из липидных рафтов в кавеолоподобные структуры. При удалении холестерина из липидных рафтов эховирусная инфекция не развивается .
Существуют также вирусы, которые используют некавеолярный эндоцитоз, опосредованный рафтами, например, эховирус 11 (EV11, сем. Picornaviridae ), однако детальный механизм этих процессов ещё не изучен .
Вирусы гриппа связываются с клеточным рецептором — сиаловой кислотой , которая присоединена к гликоконъюгату , инициирующему эндоцитоз. После переноса вируса в поздние эндосомы из-за низкого значения pH происходит изменение конформации вирусного гемагглютинина (HA), после чего липидная оболочка вируса сливается с мембраной эндосомы, и вирусные комплексы высвобождаются в цитоплазму. Этот выход запускается потоком протонов через вирусный протонный канал М2, для работы которого необходимо связывание с холестерином. Для проникновения в клетку (SFV, сем. Togaviridae ) и (SIN, сем. Togaviridae ) используют холестерин и сфинголипиды и задействуют липидные рафты для слияния их липидной оболочки с мембраной, опосредованного содержащимся в их оболочке гликопротеином , и последующего попадания в цитоплазму . Т-лимфотропный вирус человека (HTLV-1, сем. Retroviridae ) попадает в клетку через глюкозный транспортер 1 ( GLUT1 ). Вирус Эбола и вирус Марбург используют в качестве клеточного рецептора -α (FRα), являющийся GPI-заякоренным белком. Вирус гепатита B распознает человеческий рецептор комплемента 2-го типа (CR2, или CD21). Человеческий вирус герпеса 6 типа (HHV-6) связывается с рецептором CD46 на поверхности клетки. Все эти клеточные рецепторы располагаются в липидных рафтах или перемещаются туда при инфекции .
Вирус иммунодефицита человека (ВИЧ), передающийся половым путём , для проникновения в организм хозяина должен преодолеть барьер эпителиальных клеток, которые не экспрессируют рецептор CD4 или (эти рецепторы часто используются для попадания в клетку). Альтернативным рецептором для гликопротеина оболочки ВИЧ на эпителиальных клетках является гликосфинголипид (GalCer), которым изобилуют липидные рафты .
Одной из причин многочисленных противоречий, возникших вокруг липидных рафтов, является сложность их изучения в живых клетках, которые не находятся в термодинамическом равновесии . Липидные рафты представляют собой маленькие микродомены размером 10—200 нм . Поскольку их размер находится за дифракционным пределом светового микроскопа , визуализировать липидные рафты непосредственно чрезвычайно сложно. В настоящий момент исследуются искусственные мембраны, однако их использование имеет массу недостатков. Во-первых, содержание белков в искусственных мембранах значительно меньше такового в биологических мембранах. Во-вторых, сложно смоделировать взаимодействия мембраны и цитоскелета , которые имеют место в биомембранах. В-третьих, искусственные мембраны лишены естественной асимметрии, и их невозможно изучать в неравновесном состоянии .
Другой интенсивно используемый метод изучения липидных рафтов — флуоресцентная микроскопия. Например, широко используются флуорофоры , связанные с В-субъединицей холерного токсина , который связывается с обязательной составляющей рафтов — ганглиозидом GM1. Также используются липофильные мембранные красители, которые либо встраиваются между рафтами и остальной мембраной, либо изменяют свои флуоресцентные свойства в зависимости от фазы мембраны. Примером таких красителей может служить часто используемый . Рафты также можно пометить с помощью экспрессии флуоресцентно-меченных белков — например, Lck- GFP .
Секвестрация холестерина с помощью филипина , нистатина и амфотерицина В , удаление с помощью метил-В-циклодекстрина, подавление его синтеза с помощью ингибиторов HGM-СоА-редуктазы служат примерами таких методов. Они позволяют пронаблюдать за изменениями передачи сигналов нейромедиаторами при уменьшении уровня холестерина в мембране .
При использовании визуализации с высоким разрешением и математического моделирования было показано, что белки липидных рафтов собраны в нанокластеры высокой плотности радиусом 5—20 нм. Используя измерение ( англ. fluorescence resonance energy transfer, FRET ) между одними и теми же пробами (гомо-FRET или флуоресцентная анизотропия ), Шарма и коллеги заключили, что часть (20—40 %) GPI-заякоренных белков организована в кластеры высокой плотности и радиусом 4—5 нм . В настоящее время для преодоления проблемы малого размера и динамической природы липидных рафтов всё чаще используется наблюдение за движением отдельных частиц и молекул при помощи охлаждённых, чувствительных ПЗС -камер и микроскопии с полным внутренним отражением (TIRF). Эта техника позволяет получить информацию о способности частиц диффундировать в исследуемой мембране, а также выявить на этой мембране зоны с ограниченной диффузией и барьеры для диффузии .
Используются и другие оптические техники. Например, и взаимнокорелляционная спектроскопия ( англ. Fluorescence Correlation and Cross-Correlation Spectroscopy (FCS/FCCS) ) могут применяться для получения информации о подвижности флуорофора в мембране. С помощью техники FRET ( англ. Fluorescence Resonance Energy Transfer ) можно определить, когда флуорофоры находятся в непосредственной близости, а техники с применением оптических пинцетов могут дать информацию о вязкости мембраны .
Для изучения липидных рафтов также используют атомно-силовая микроскопия , ( англ. Scanning Ion Conductance Microscopy (SICM) ), , ядерный магнитный резонанс ; однако флуоресцентная микроскопия по-прежнему выступает доминирующей техникой изучения липидных рафтов. Есть надежды, что в будущем (например, STED-микроскопия ) и различные формы структурированной иллюминационной микроскопии помогут преодолеть проблемы, вызванные дифракционным ограничением.
Кроме того, для работы с рафтами используются иммуноферментный анализ (ELISA), вестерн-блоттинг и флуоресцентно-активированная сортировка клеток (FACS) .
Роль рафтов во внутриклеточной передаче сигналов, метаболизме и поддержании структуры клетки ещё не полностью определена, несмотря на множество проведенных экспериментов, использующих различные методы, и даже само существование липидных рафтов ставится под вопрос .
Против существования липидных рафтов свидетельствуют следующие аргументы:
Первое опровержение последнего пункта — Lo-фаза рафта более плотная из-за межмолекулярных водородных связей между молекулами сфинголипидов и холестерина, причём эти связи не образуются в других местах .
Второй аргумент против существования липидных рафтов обусловлен эффективностью разрушения липидных рафтов при исследованиях. Удаление холестерина из рафтов может иметь негативные последствия для достоверности дальнейших результатов о функциях рафтов . Большинство исследователей использовало жёсткие методы удаления холестерина из мембран, которые разрушали не только рафты, но и другой мембранный фосфолипид — (PI(4,5)P 2 ). Данный фосфолипид играет важную роль в регуляции цитоскелета , и его разрушение может привести к тем результатам, которые обычно объясняют удалением холестерина, в том числе белков в мембране . Так как наиболее часто используемые методы разрушают и рафты, и PI(4,5)P 2 , то влияние удаления холестерина на определённый процесс не может быть отнесено только лишь к разрушению рафтов, поскольку могут быть затронуты и многие процессы, не связанные с рафтами. Наконец, хотя сейчас предполагается, что рафты каким-то образом присоединены к белкам, некоторые исследователи считают, что белки могут привлекаться в рафт только за счёт взаимодействия с ацильными хвостами липидов, которые скрыты внутри мембраны, и никак иначе .