Алифатические соединения
- 1 year ago
- 0
- 0
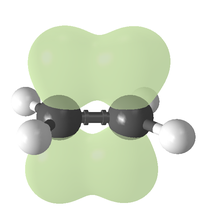

Алке́ны ( этиле́новые углеводоро́ды ) — ациклические непредельные углеводороды , содержащие одну двойную связь между атомами углерода , образующие гомологический ряд с общей формулой C n H 2n .
Атомы углерода при двойной связи находятся в состоянии sp 2 -гибридизации и имеют валентный угол 120°. Простейшим алкеном является этилен (C 2 H 4 ). По номенклатуре IUPAC , названия алкенов образуются от названий соответствующих алканов заменой суффикса « -ан » на « -ен »; положение двойной связи указывается арабской цифрой после соответствующего атома углерода. Например: CH 2 =CH-CH 2 -CH 3 (Бутен-1)
Углеводородные радикалы, образованные от алкенов, имеют суффикс «-ени́л» . Тривиальные названия: CH 2 =CH— «вини́л» , CH 2 =CH—CH 2 — «алли́л» .
Алкены, число атомов углерода в которых больше двух, (то есть кроме этилена) имеют свои изомеры . Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и геометрическая. Например, единственным изомером пропилена является циклопропан (C 3 H 6 ) по межклассовой изомерии. Начиная с бутилена , существуют изомеры по положению двойной связи (бутен-1 и бутен-2), по углеродному скелету (изобутилен или метилпропилен) и геометрические изомеры (цис-бутен-2 и транс-бутен-2). С ростом числа атомов углерода в молекуле количество изомеров возрастает в геометрической прогрессии.

Гомологический ряд алкенов:
| Этен ( этилен ) | C 2 H 4 |
| Пропен ( пропилен ) | C 3 H 6 |
| Бутен ( бутилен ) | C 4 H 8 |
| Пентен | C 5 H 10 |
| Гексен | C 6 H 12 |
| C 7 H 14 | |
| Октен | C 8 H 16 |
| C 9 H 18 | |
| децен | C 10 H 20 |
Алкены могут существовать в виде пространственных или геометрических изомеров.
Различают:
IUPAC рекомендует называть геометрические изомеры по следующей номенклатуре:

В соответствии с теорией гибридизации двойная связь образуется за счёт перекрывания вдоль линии связи С-С sp 2 -гибридных орбиталей атомов углерода ( σ -связь) и бокового перекрывания углеродных p -орбиталей ( π -связь).

В состоянии sp 2 -гибридизации электронное состояние атома углерода можно представить следующим образом:
Все атомы этилена лежат в одной плоскости, а величина валентного угла связи C-H практически равна 120 °. Центры углеродных атомов в этилене находятся на расстоянии 0,134 нм, то есть длина двойной связи несколько короче, чем С-С .
Согласно теории молекулярных орбиталей линейная комбинация двух атомных 2p -орбиталей углерода формирует две молекулярные π -орбитали этилена :
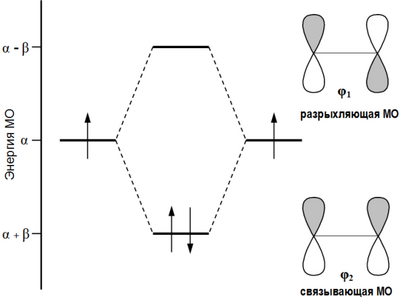
Первый потенциал ионизации этилена составляет 10,51 эВ , что позволяет электрону относительно легко уходить (электрофильное взаимодействие) с высшей занятой молекулярной орбитали (ВЗМО). В то же время, низшая связывающая молекулярная орбиталь (НСМО) этилена имеет достаточно низкую энергию: −1,6—1,8 эВ, что объясняет относительную лёгкость присоединения электрона с образованием аниона (нуклеофильное взаимодействие).
Добавление метильного заместителя снижает потенциал ионизации π -электронов примерно на 0,6—0,8 эВ и повышает энергию НСМО на 0,2 эВ, а ВЗМО на 0,7 эВ .
Впервые этилен был получен в 1669 году немецким химиком и врачом И. И. Бехером действием серной кислоты на этиловый спирт . Учёный установил, что его «воздух» более химически активен, чем метан, однако идентифицировать полученный газ он не смог и названия ему не присвоил .
Вторично и тем же способом «воздух Бехера» был получен и описан голландскими химиками , Потс-ван-Трооствиком, Бондом и Лауверенбургом в 1795 году . Они назвали его «маслородным газом» так как при взаимодействии с хлором , он образовывал маслянистую жидкость — дихлорэтан (об этом стало известно позднее). По-французски «маслородный» — oléfiant . Французский химик Антуан Фуркруа ввёл этот термин в практику, а когда были обнаружены другие углеводороды такого же типа, это название стало общим для всего класса олефинов (или, по современной номенклатуре, алкенов) .
В начале XIX века французский химик Ж. Гей-Люссак обнаружил, что этанол состоит из «маслородного» газа и воды. Этот же газ он обнаружил и в хлористом этиле . В 1828 году Ж. Дюма и П. Буллей предположили, что этилен представляет собой основание, способное давать соли подобно аммиаку . Якоб Берцелиус принял эту идею, назвав соединение «этерином» и обозначив буквой E .
Определив, что этилен состоит из водорода и углерода , долгое время химики не могли выписать его настоящую формулу. В 1848 году Кольбе писал формулу этилена как С 4 Н 4 , этого же мнения придерживался и Либих . Ж. Дюма правильно определил состав вещества, но его структура по-прежнему была описана неверно: С 2 НН 3 .
В 1862 году немецкий химик-органик Э. Эрленмейер предположил наличие в молекуле этилена двойной связи, а в 1870 году известный российский учёный А. М. Бутлеров признал эту точку зрения правильной, подтвердив её природу экспериментально .
В природе ациклические алкены практически не встречаются . Простейший представитель этого класса органических соединений — этилен (C 2 H 4 ) — является гормоном для растений и в незначительном количестве в них синтезируется.
Один из немногих природных алкенов — ( цис - трикозен-9) является половым аттрактантом самки домашней мухи ( Musca domestica ).
Низшие алкены в высоких концентрациях обладают наркотическим эффектом . Высшие члены ряда также вызывают судороги и раздражение слизистых оболочек дыхательных путей .
Отдельные представители алкенов :
| Физические свойства алкенов. | |||||
|---|---|---|---|---|---|
| № | Название | Формула | Т плавления, ° C | Т кипения, ° C |
Плотность, d
20
4 |
| 1 | Этилен | С 2 H 4 | −169,1 | −103,7 | 0,5700* |
| 2 | Пропилен | C 3 H 6 | −187,6 | −47,7 | 0,5193* |
| 3 | Бутен-1 | C 4 H 8 | −185,3 | −6,3 | 0,5951* |
| 4 | цис - Бутен-2 | CH 3 -CH=CH-CH 3 | −138,9 | 3,7 | 0,6213 |
| 5 | транс - Бутен-2 | CH 3 -CH=CH-CH 3 | −105,5 | 0,9 | 0,6042 |
| 6 | 2-Метилпропен-1 | CH 3 -C(CH 3 )=CH 2 | −140,4 | −7,0 | 0,5942* |
| 7 | Пентен-1 | CH 2 =CH-CH 2 -CH 2 -CH 3 | −165,2 | 30,1 | 0,6405 |
| 8 | Гексен-1 | CH 2 =CH-CH 2 -CH 2 -CH 2 -CH 3 | −139,8 | 63,5 | 0,6730 |
| 9 | С 7 H 14 | −119,0 | 93,6 | 0,6970 | |
| 10 | Октен-1 | С 8 H 16 | −101,7 | 121,3 | 0,7140 |
| … | Гептадецен | С 17 H 34 | 4,1 | 284,4 | 0,7811 |
* Значения измерены при температуре кипения.
Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения . Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны.
Особенностью алкенов являются также реакции циклоприсоединения и .
Алкены легко вступают в реакции окисления , гидрируются с сильными восстановителями или водородом под действием катализаторов , а также способны к радикальному замещению .
В данных реакциях атакующей частицей является электрофил.
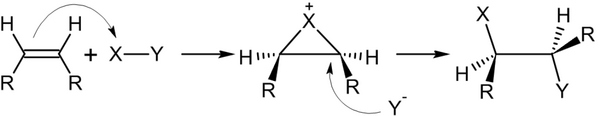
Галогенирование алкенов, проходящее в отсутствие инициаторов радикальных реакций — типичная реакция электрофильного присоединения . Она проводится в среде неполярных инертных растворителей (например: CCl 4 ):
Реакция галогенирования стереоспецифична —- присоединение происходит с противоположных сторон относительно плоскости молекулы алкена
Механизм реакций подобного типа в общем виде:
Электрофильное присоединение галогенводородов к алкенам происходит по правилу Марковникова :

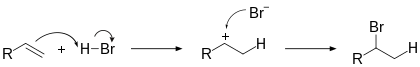
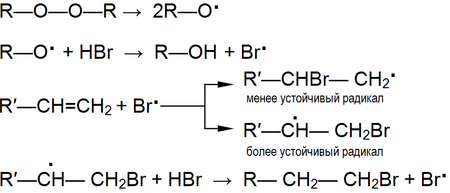
Однако в присутствии перекисей присоединение происходит преимущественно против этого правила ( эффект Хараша ) :
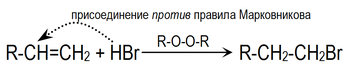
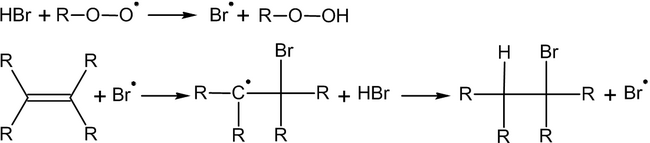
Это объясняется тем, что реакция в данном случае будет протекать по радикальному механизму и присоединение радикала Br . идёт по стерически наиболее доступному концевому атому углерода двойной связи:
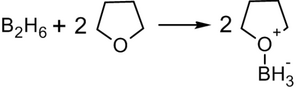
Присоединение гидридов бора к алкенам и последующее их расщепление в щелочной среде, открытое Г. Брауном в 1958 году , является столь важной реакцией, что за её обнаружение и изучение в 1979 году учёный был удостоен Нобелевской премии по химии .
Присоединение происходит многоступенчато с образованием промежуточного циклического активированного комплекса, причём присоединение бора происходит против правила Марковникова — к наиболее гидрогенизированному атому углерода:
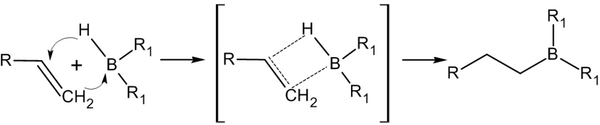
В синтезе обычно используется не сам диборан , а его донорно-акцепторный комплекс с простым эфиром:
Алкилбораны легко расщепляются. Так под действием пероксида водорода в щелочной среде образуются спирты :
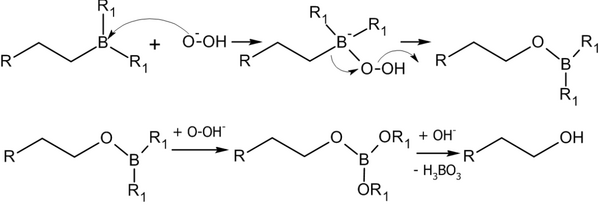
Реакция гидроборирования является реакцией син-присоединения — её результатом становятся цис -аддукты.
Реакция присоединения воды к алкенам протекает в присутствии серной кислоты :
Реакция протекает по правилу Марковникова.
Присоединение алканов к алкенам в присутствии кислотного катализатора ( HF или H 2 SO 4 ) при низких температурах приводит к образованию углеводорода с большей молекулярной массой и часто используется в промышленности :
Данная реакция также может протекать по свободнорадикальному механизму в отсутствие катализатора при высокой температуре (500 °C) и давлении (15-30 МПа) .
Для алкенов также характерны следующие реакции электрофильного присоединения :
В условиях, способствующих гомолитическому разрыву связи, (высокая температура, облучение, наличие свободных радикалов и пр.) присоединение к алкенам происходит по радикальному механизму .
по правилу Марковникова.
и т. п.
Механизм реакции:
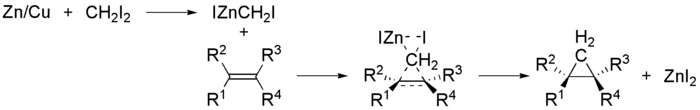
Карбены CR 2 : — высокореакционные короткоживущие частицы, которые способны легко присоединяться к двойной связи алкенов . В результате реакции присоединения карбена образуются производные циклопропана :
![]()
Карбены в более характерном для них синглетном состоянии , вступая в реакцию, дают стереоспецифичные продукты син -присоединения .
Помимо собственно карбена, в подобные реакции могут вступать и его производные :
и пр.
Часто реакции присоединения карбенов происходят без прямых доказательств их свободного присутствия, то есть происходит перенос карбена . Для этого случая, а также если генерация свободного карбена ставится под сомнение, пользуются термином карбеноид .
В лабораторной практике часто пользуются :
Подробнее о методах получения карбенов см. статью Карбены .
Гидрирование алкенов непосредственно водородом происходит только в присутствии катализатора . Гетерогенными катализаторами гидрирования служат платина , палладий , никель .
Гидрирование можно проводить и в жидкой фазе с гомогенными катализаторами (например: катализатор Уилкинсона ((C 6 H 5 ) 3 P) 3 Rh Cl) .
В качестве реагентов гидрирования могут выступать (NH=NH), диборан (B 2 H 6 ) и др .
При высоких температурах (более 400 °C) реакции радикального присоединения, носящие обратимый характер, подавляются. В этом случае становится возможным провести замещение атома водорода, находящегося в аллильном положении при сохранении двойной связи:
Реакция носит радикальный характер и протекает аналогично хлорированию алканов.
Аллильное бромирование обычно проводят N-бромсукцинимидом ( реакция Воля — Циглера ) в присутствии перекиси бензоила в среде тетрахлорметана или в бинарной смеси диметилсульфоксида и воды :
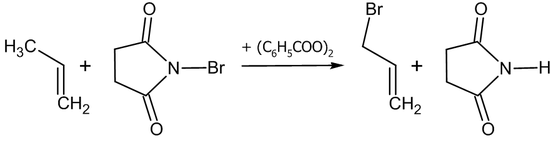
Окисление алкенов может происходить в зависимости от условий и видов окислительных реагентов как с разрывом двойной связи, так и с сохранением углеродного скелета.
На первом этапе происходит присоединение оксида осмия к алкену, затем под действием восстановителя ( Zn или NaHSO 3 ) образовавшийся комплекс переходит к диолу ( Реакция Криге ).
Аналогично реакция идёт в нейтральной или слабощелочной среде под действием KMnO 4 ( Реакция Вагнера ) :
(кетон)
В присутствии солей палладия этилен окисляется до ацетальдегида :
Реакция идёт в кислой среде и является промышленным способом получения ацетальдегида.
Аналогично образуется ацетон из пропена .
При действии на алкены пероксикарбоновых кислот образуются эпоксиды ( реакция Прилежаева ) :
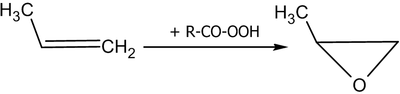
Реакция эпоксидирования используется для промышленного получения этиленоксида . Окислителем выступает кислород воздуха; процесс идёт на серебряном катализаторе при 200—250 °C под давлением.
Озонолиз алкенов обычно проводят при низких температурах (от −80 до −30 °C) в инертном растворителе ( гексан , тетрахлорметан , хлороформ , этилацетат и пр.). Непосредственные продукты озонолиза не выделяют, а подвергают дальнейшему гидролизу, окислению или восстановлению .
На первой стадии происходит присоединение озона с образованием озонида . Далее под действием восстановителя (например: Zn + CH 3 COOH ) озонид разлагается:
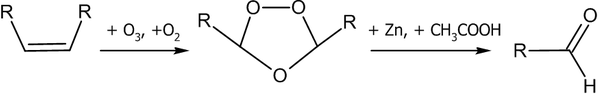
Если взять более сильный восстановитель, скажем — алюмогидрид лития , продуктом реакции будут спирты .
В данном случае разложение озонида происходит под действием окислителей ( пероксид водорода , оксид серебра , пероксикислоты и пр. ).
Алкены в присутствии катализатора, высокой температуры и давления присоединяют CO и H 2 с образованием альдегидов :
Аналогично протекает реакция CO и H 2 O с образованием карбоновых кислот :
Если вместо воды использовать спирт , конечным продуктом реакции будет сложный эфир :
Полимеризация алкенов может протекать как по свободнорадикальному , так и катионно-анионному механизму.
По первому методу получают полиэтилен высокого давления:
Катализатором реакции выступают пероксиды.
Второй метод предполагает использование в качестве катализаторов кислот (катионная полимеризация), металлорганических соединений ( катализаторы Циглера-Натта , анионная полимеризация). Преимуществом метода является возможность получения стереоселективных полимеров.
Реакции свободнорадикального присоединения
Впервые данный тип реакций был обнаружен в середине прошлого века при изучении полимеризации этилена , а в затем был использован в 1966 году для промышленного синтеза бутена-2.
В 1967 году Н. Кальдерон, Х. Ю Чен и К. В. Скотт описали метатезис алкенов (в российской литературе часто употребляется термин реакция дисмутации алкенов , иначе говоря — реакцию обмена атомами при сохранении общей структуры алкена и его двойной связи) в условиях катализа хлоридом вольфрама (VI):
Реакция оказалась настолько важной в области практической препаративной химии, что исследовательская группа Роберта Граббса , разработавшая новый класс катализаторов (алкилиденовые комплексы рутения) метатезиса олефинов, получила в 2005 году Нобелевскую премию в области химии . Эту премию также получили француз Ив Шовен в 1971 году , предложивший карбеновую теорию механизма реакции метатезиса , и американец Ричард Шрок , создавший в 1990 году первый металлорганический катализатор метатезиса алкенов .
В 2008 году польские химики продемонстрировали реакцию метатезиса в водном растворе с использованием коммерчески доступного рутениевого катализатора .
Технологические аспекты метатезиса алкенов рассмотрены в статье: .
Основным промышленным методом получения алкенов является каталитический и высокотемпературный крекинг углеводородов нефти и природного газа . Для производства низших алкенов используют также реакцию дегидратации соответствующих спиртов .
В лабораторной практике обычно применяют метод дегидратации спиртов в присутствии сильных минеральных кислот , дегидрогалогенирование и дегалогенирование соответствующих галогенпроизводных; синтезы Гофмана, Чугаева, Виттига и Коупа .
Подробнее — см. соответствующие разделы ниже.
Это один из промышленных способов получения алкенов . Температура: 350—450 °C, катализатор — Cr 2 O 3 . Также используются алюмомолибденовые и алюмоплатиновые катализаторы . Для получения транс-алкенов используют MOH/EtOH, для цис-производных NaNH 2 /NH 3
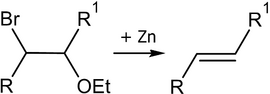
Отщепление галогенов у дигалогеналканов происходит в присутствии цинка :
Дегидрогалогенирование проводят при нагревании действием спиртовыми растворами щелочей :
При отщеплении галогенводорода образуется смесь изомеров , преобладающий из которых определяется правилом Зайцева : отщепление протона происходит от менее гидрогенизированного атома углерода.
Дегидратацию спиртов ведут при повышенной температуре бани в присутствии сильных минеральных кислот :
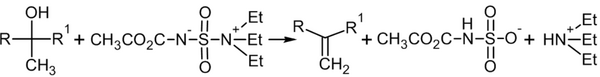
В современной практике алкены из вторичных и третичных спиртов также получают с использованием дегидратирующего реагента — реагента Бёрджесса :
Частичное гидрирование алкинов требует специальных условий и наличие катализатора (например, дезактивированного палладия — катализатора Линдлара ) :
( цис -изомер)
( транс -изомер)
Реакция Виттига — стереоселективный синтез алкенов взаимодействием карбонильных соединений и алкилиденфосфоранов (илидов фосфониевых солей) :
Для превращения солей фосфония в илиды используются бутиллитий , гидрид, амид или алкоголят натрия, а также некоторые другие сильные основания.
В реакцию могут вступать самые различные карбонильные соединения, среди которых ароматические и алифатические альдегиды и кетоны , в том числе содержащие двойные и тройные связи и различные функциональные группы .
В лабораторной практике часто используют более современную модификацию ( 1959 год ) реакции Виттига — реакцию Хорнера-Уодсворта-Эммонса :
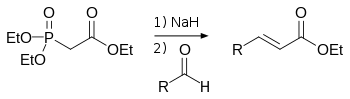
Преимущество использования фосфонатов заключается в том, что образующиеся в ходе реакции фосфаты легко отмываются водой. Кроме того, реакция позволяет избирать оптическое направление элиминирования, получая на выходе транс - (термодинамический контроль) или цис -изомеры (кинетический контроль) .
Реакция Кнёвенагеля — конденсация альдегидов или кетонов с соединениями, содержащими активную CH 2 -группу :
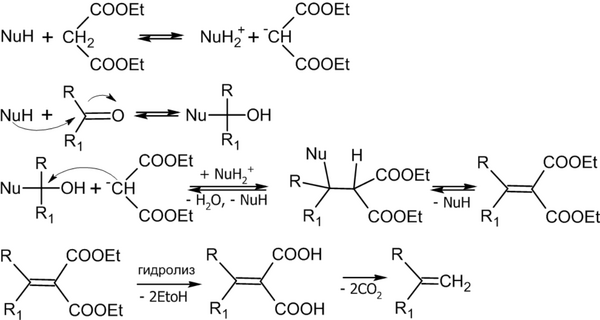
Реакция имеет очень широкий диапазон применения, при этом помимо эфиров малоновой кислоты, в реакцию могут вступать и другие соединения, например: CH 3 CN, CH 3 NO 2 , LiCH 2 COOC 2 H 5 и пр. .
Реакция Чугаева — взаимодействие спиртов с CS 2 и NaOH с последующим метилированием и дальнейшим пиролизом образовавшихся S-метилксантогенатов :
Исчерпывающее метилирование по Гофману — разложение четвертичных аммониевых оснований на алкен, третичный амин и воду :
На первой стадии реакции действием метилиодида амин превращают в четвертичный аммонийиодид, который далее переводят в гидроксид действием оксида серебра, наконец, последний этап — разложение — ведут при 100—200 °C, часто при пониженном давлении .
Элиминирование по Гофману приводит к образованию наименее замещённых алкенов (против правила Зайцева).
Метод используется, в основном, для получения некоторых циклических алкенов и в химии алкалоидов .
— разложение N-окисей третичных аминов :
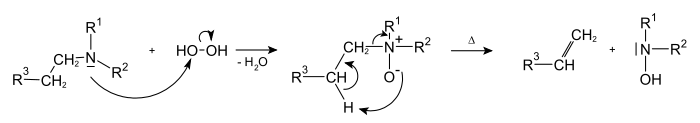
— элиминирование брома и этоксигруппы из бромалкилэтиловых эфиров под действием цинковой пыли :
Алкены можно получить разложением тозилгидразонов под действием оснований ( и ) :
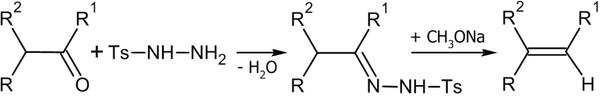
Реакция Бэмфорда — Стивенса и Реакция Шапиро протекают по одинаковому механизму. В первом случае используются натрий , метилат натрия, гидриды лития или натрия, амид натрия и т. п. Во втором: аллкиллитий и реактивы Гриньяра . В реакция Бэмфорда — Стивенса образуются более замещённые, а в реакция Шапиро — наименее замещённые алкены .
Реакция Перкина — взаимодействие ароматических альдегидов с ангидридами карбоновых кислот в присутствии катализаторов основного характера (щелочных солей карбоновых кислот, третичных аминов и т. п.) :
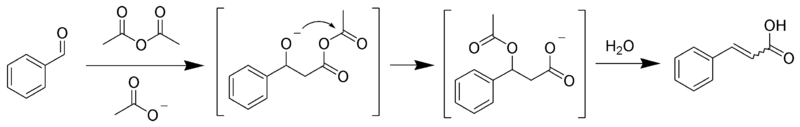
Последующим декарбоксилированием образующейся кислоты можно получить соответствующий алкен.
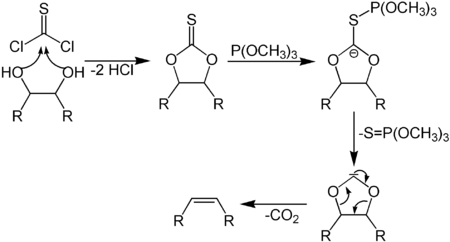
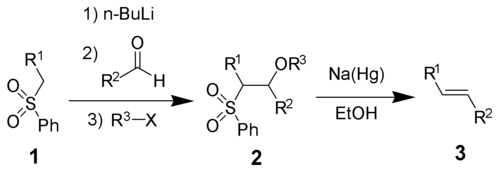
Часто для идентификации алкенов используют реакцию Вагнера : обесцвечивание раствора перманганата калия в слабощелочной среде (окисление алкенов до гликолей). Другой вариант — обесцвечивание раствора брома в четыреххлористом углероде при отсутствии выделения бромоводорода ( реакция присоединения ) .
Эти химические методы является очень общими, не селективными и не могут гарантированно определить алкены. Для подтверждения наличия двойной связи в соединении используют методы спектроскопии.
Масс-спектры алкенов по сравнению с алканами содержат более интенсивные M + пики . Существует эффективный экспресс-метод масс-спектрометрического исследования строения алкенов, заключающийся в изучении масс-спектров соответствующих алканов, образующихся при проведении газофазного гидрирования алкенов в токе водорода (кат. Pt , Pd ) в микрореакторе, расположенном между газовым хроматографом и масс-спектрометром .
Алкены с изолированными двойными связями имеют интенсивную (ε от 6500 до 12000) широкую полосу поглощения, обусловленную переходом π→π, в области 165—200 нм. Наличие алкильных заместителей смещает эту полосу в длинноволновую область .
алкенов имеют представленные в таблице характеристические полосы, вызванные валентными колебаниями связи С=С и C-H :
| Типы колебаний и групп | Диапазон, см −1 | Примечание |
|---|---|---|
|
Валентные колебания связей C−H
|
||
| R 2 C=CH 2 | 3095-3075 | Могут наблюдаться мультиплеты |
| R 2 C=CHR | 3045-3010 | Дифференциация цис- и транс- изомеров невозможна |
|
Деформационные колебания связей C−H
|
||
| RCH=CH 2 | 990, 910 | |
| R,RC=CH 2 | около 890 | |
| R,RC=CHR | 840-790 | |
| транс —RCH=CHR | около 950 | |
| цис −RCH=CHR | 730-665 | |
|
Валентные колебания связей C=С
|
||
| транс −RCH=CHR | около 1675 | Полосы умеренной и высокой интенсивности, пригодные для идентификации ациклических и ненапряжённых систем |
| цис −RCH=CHR | около 1660 | |
| RCH=CR 1 R 2 | около 1670 | |
| R 2 C=CH 2 | около 1650 | |
| RCH=CH 2 | около 1640 | |
| C=C−C=C | 1645-1600 | Положение полосы, более интенсивной чем у алкенов, зависит от геометрии сопряжённой системы |
| C=C−C=O | 1660-1580 | |
| C=C−(C=C)n | 1650-1580 | Полосы имеют мультиплетную структуру, а при больших n сливаются в одну широкую полосу |
| ArC=C | около 1630 | Положение полосы зависит от положения и природы заместителей |
ЯМР-спектроскопические методы анализа алкенов позволяют идентифицировать сигналы атомов водорода алкенов, тем самым получив важную информацию о структуре углеводородов. Эти сигналы лежат в диапазоне 4-8 м.д. Существует эмпирическая зависимость, позволяющая достаточно точно вычислить сдвиги протонов алкенов :
δ C=C-H = 5,25 + Z гем + Z цис + Z транс
где Z-аддитивные параметры экранирования соответствующих заместителей.
Значения Z для отдельных заместителей представлены в таблице :
| Заместитель | Z гем | Z цис | Z транс |
|---|---|---|---|
| H | 0,00 | 0,00 | 0,00 |
| Алкил | 0,45 | -0,22 | -0,28 |
| Алкил (цикл.)* | 0,69 | -0,25 | -0,28 |
| CH 2 Ar | 1,05 | -0,29 | -0,32 |
| CH 2 X (X:F, Cl, Br) | 0,70 | 0,11 | -0,04 |
| CH 2 OH | 0,64 | -0,01 | -0,02 |
| CH 2 NH 2 | 0,58 | -0,10 | -0,08 |
| C=C (изолир.) | 1,00 | -0,09 | -0,23 |
| C=C (сопряж.) | 1,24 | 0,02 | -0,05 |
| Ar | 1,38 | 0,36 | -0,07 |
| Cl | 1,08 | 0,18 | 0,13 |
| Br | 1,07 | 0,45 | 0,55 |
| OR | 1,22 | -1,07 | -1,21 |
| OC(O)R | 2,11 | -0,35 | -0,64 |
| CHO | 1,02 | 0,95 | 1,17 |
| COOH | 0,97 | 1,41 | 0,71 |
| COOR | 0,80 | 1,18 | 0,55 |
* — Двойная связь и алкил входят в цикл
Алкены являются важнейшим химическим сырьём.
Этилен используется для производства целого ряда химических соединений: винилхлорида , стирола , этиленгликоля , этиленоксида , этаноламинов , этанола , диоксана , дихлорэтана , уксусного альдегида и уксусной кислоты . Полимеризацией этилена и его прямых производных получают полиэтилен , поливинилацетат , поливинилхлорид , каучуки и смазочные масла .
Мировое производство этилена составляет порядка 100 млн тонн в год (по данным на 2005 год: 107 млн тонн ).
Пропилен в промышленности применяется, в основном, для синтеза полипропилена (62 % процента всего выпускаемого объёма ). Также из него получают кумол , окись пропилена, акрилонитрил , изопропанол , глицерин , масляный альдегид .
В настоящее время мировые мощности по выпуску пропилена составляют около 70 млн тонн в год . По прогнозам специалистов, потребность в пропилене в ближайшем будущем будет существенно превышать объёмы его производства, причём, ожидается, что к 2010 году объём его мирового выпуска достигнет 90 млн тонн .
Бутилены применяют для производства бутадиена , изопрена , полиизобутилена , бутилкаучука , метилэтилкетона и пр .
Изобутилен — сырьё для получения бутилкаучука, изопрена , трет-бутанола ; используется для алкилирования фенолов при синтезе ПАВ. Его сополимеры с бутенами применяют как присадки к маслам и герметики.
Высшие алкены С 10 −С 18 применяют при синтезе ПАВ , а также для получения высших спиртов.