Бодянский, Вадим Лазаревич
- 1 year ago
- 0
- 0
Иммуноонкология — раздел медицины, изучающий функции иммунной системы при онкологических заболеваниях. Терапевтическим направлением в рамках иммуноонкологии является иммунотерапия опухолей. Иммунотерапию опухолей принято разделять на активную, пассивную или гибридную. Иммунотерапия основана на том, что раковые клетки имеют на своей поверхности молекулы, которые могут быть распознаны рецепторами иммунной системы (антителами и/или клеточными рецепторами).
Активная иммунотерапия предполагает использование собственных иммунных клеток организма для борьбы с раковыми клетками. Пассивная иммунотерапия заключается во введении антител, лимфоцитов и цитокинов.
Антитела — молекулы иммунной системы, способные распознавать антигены на поверхности клеток. Антитела, способные связываться с раковыми антигенами, используются для лечения рака. Типичными мишенями для пассивной иммунотерапии рака являются молекулы CD20 , CD274 и CD279 . При связывании с раковым антигеном антитела вызывают гибель раковых клеток путём индукции антитело-зависимой клеточной цитотоксичности и активации системы комплемента. Кроме того, блокируя рецепторы раковых клеток, антитела препятствуют их взаимодействию с соответствующими лигандами, что также приводит к гибели клетки. Примерами таких антител являются алемтузумаб , ритуксимаб .
Активная иммунотерапия использует возможности иммунных клеток для уничтожения клеток-мишеней. Одним из подходов является выделение иммунных клеток из крови или из опухолевой ткани. Специфичные в отношении опухоли клетки затем культивируют и вводят обратно в организм пациента, после чего они атакуют опухоль. Клетки, которые могут использоваться в подобной терапии — естественные киллеры, цитотоксические Т-лимфоциты и дендритные клетки. Другим способом является воздействие на находящиеся в организме иммунные клетки. С этой целью применяют антитела к CTLA-4 (ипилимумаб) и PD-1 (ниволумаб, пембролизумаб), вследствие воздействия которых лимфоциты активируются и начинают уничтожать опухолевые клетки.
Интерлейкин-2 и интерферон -α — цитокины , которые могут улучшать противоопухолевый иммунный ответ. Интерферон-α используется в лечении волосатоклеточного лейкоза, саркомы Капоши, фолликулярной лимфомы, хронического миелоидного лейкоза и меланомы. Интерлейкин-2 используется для лечения меланомы и почечноклеточной карциномы.
Иммунотерапию для лечения рака стало возможным использовать после внедрения технологии производства моноклональных антител в 1975 году.
Клеточная иммунотерапия была внедрена в практику в конце 1980-х гг.
В 1987 году была обнаружена молекула CTLA-4 , предотвращающая атаку Т-лимфоцитов на опухолевые клетки. В 1996 году на мышиной модели было показано, что блокирование CTLA-4 антителами позволяет иммунным клеткам уничтожать опухоль. В 1999 году биотехнологическая компания приобрела права на производство этого антитела. В 2010 году после покупки Medarex компания Bristol-Myers Squibb сообщила о продлении жизни пациентов с метастатической меланомой в среднем на 10 месяцев при применении антитела.
В начале 1990-х в умирающих Т-лимфоцитах была обнаружена молекула PD-1 («Programmed death 1» — «молекула запрограмиированной смерти 1»). Антитела, направленные на PD-1 способны приостановить гибель Т-лимфоцитов, которые могут атаковать опухоль. Эффективность лечения такими антителами была показана в 2008 году. В 2013 году сообщили, что такая терапия эффективна при лечении меланомы, рака почки и рака лёгкого.
В 1997 году было впервые одобрено применение антитела ритуксимаб для лечения фолликулярной лимфомы. После этого для лечения рака было одобрено более 10 препаратов, среди которых алемтузумаб (2001), офатумумаб (2009), ипилимумаб (2011) и другие антитела.
В 2003 году внедрён способ лечения рака цитокинами. Побочные эффекты, возникающие при внутривенном введении цитокинов заставили предпринять попытки выделения клеток из человеческого организма, обработки их цитокинами и введения обратно .
Клеточная иммунотерапия с применением противораковой вакцины сипулейцел-Т была одобрена для лечения рака простаты в 2010 году.
Также в 2010 году сообщено об успешной попытке лечения рака Т-лимфоцитами с химерным рецептором к раковому антигену ( CAR -терапия). Этот способ лечения является примером персонализированного лечения, основанного на генетической модификации Т-лимфоцитов пациента.
В середине 2016 года было одобрено применение ингибитора PD-L1 — атезолизумаба и двух ингибиторов PD-1 — ниволумаба и пембролизумаба.
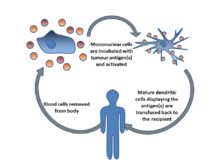
Иммунотерапия дендритными клетками улучшает противоопухолевый иммунный ответ. В данном виде терапии дендритные клетки инкубируют с раковым антигеном, после чего активированные зрелые дендритные клетки возвращают в организм пациента, где они в свою очередь активируют Т-лимфоциты, способные уничтожать опухоль. .
Другим перспективным способом является вакцинация путём введения лизатов опухолевой ткани.
Дендритные клетки также можно активировать in vivo , если заставить опухолевые клетки экспрессировать GM-CSF. Этого можно добиться путём генетической модификации опухолевых клеток. Другим способом активации дендритных клеток является использование антител к рецепторам на их поверхности. В качестве мишеней могут использоваться толл-подобные рецепторы — TLR3, TLR7, TLR8 и молекула CD40s.
В лечении антителами могу использоваться два типа антител:
{{
cite news
}}
:
Проверьте значение даты:
|access-date=
(
справка
)