Сварочное железо
- 1 year ago
- 0
- 0
| 26 |
??????
|
|
|
|
| 3d 6 4s 2 | |
??????? ( ?????????? ?????? — Fe , ?? ???. Fe rrum ) — ?????????? ??????? 8-? ?????? (?? ?????????? ????????????? — ???????? ????????? ??????? ??????, VIIIB) ?????????? ??????? ????????????? ??????? ?????????? ????????? ?. ?. ?????????? ? ??????? ??????? 26.
??????? ???????? ?????? — ??? ?????? ?????????? ?????? ??????????-?????? ????? ? ??????? ?????????? ??????????? ????????????: ?????? ?????? ??????????? ?? ??????? ??? ??????? ???????????? ??? ??? ??????? ????????? . ? ?????? ????????? ?????? ????? , ? ? ??????????????? ????????? ??????????????? ? ?? ???????.
???? ?? ????? ???????????????? ? ?????? ???? ????????: ?????? ????? ????? ???????? .
?????????? ??????? ?????? ???????? ??? ?????? ? ????? ??????????? ???????? (?? 0,8 %), ??????? ????????? ???????? ? ???????????? ??????? ???????. ?? ?? ???????? ???? ??????????? ?????? ?????? ? ????????? : ????? (?? 2,14 ???. % ????????) ? ????? (????? 2,14 ???. % ???????? ), ? ????? ??????????? (????????????) ????? ? ????????? ?????????? ???????? ( ???? , ???????? , ??????? ? ??.). ???????????? ????????????? ??????? ?????? ? ??? ??????? ?????? ??? «???????? ? 1» ?? ???????? ??? ????????.
? ??????? ?????? ????? ??????????? ? ?????? ????, ???? ????? — ? ??????? ??????-????????? ??????????. ?????????????????? ?????? ? ?????? ???? — 4,65 % (4-? ????? ????? O , Si , Al ). ????????? ?????, ??? ?????? ?????????? ???????? ????? ??????? ???? , ??? ??????????? ? ??????? ?????????? ???? ????? .
?????? ??? ???????????????? ???????? ???????? ? ?????????? ??????. ????? ??????? ??????? ?? ??????, ????????? ??? ??????????????? ?????????, ?????????? 4-? ???????????? ?? ?. ?. ? ????????? ? ??????????????? ? ???????????????? ????????????. ??? ????????????? ?? ???????????? ??????, ?? ???? ?????? ?????? ? ?????? (?????????? ?????????? ?????????? ?? 5 ?? 30 %), ????????? ?? ?????????? ??????? (????? 3800 ???? ?? ?. ?.) ? ?????? ?? ?????????? ?????? ??? (????? 3100 ???? ?? ?. ?.).
??????? ??????? ????? ???????? ?????? ????? . ?? ??? ????????? ?????????? (2-? ??????????? ?? ?. ?.) ?????????? ?????? ? ??????? ?????? , ?????????? ???? ??????? ?? ?????????? ?????? (??????????? ???????? ? ??????) .
? ????????? ????????? ???????? ??????? ????????? ?????? .
? ????? ???????? ????????? ?????? ???????? ?????? ??????, ? ?? ???????? ???????? , ? ??????????? ?????? ?? 1 ???? ?????? ?????? 10 ?????? ??????, ? ?? ????????????? ???????? ?. ??????? ????????? ???? , ??????? , ?????? ? ?????? ? ??????? ?????? ???? ? ??????????? 1 : 160 : 1280 : 6400. ? ?? ??????? ?????? ?????????????? ??? ????????? ??????, ?? ???? ?????? ????? ? ?????? ??????? ??????? ??????: ????????, ? ?????????? ????? ???????????? ?????? «??? ????????» ??????????? ???? ??? .
?? ????????? ??????, ???? ?? ????? ????????? ????? (???????? 1250 ??? ?? ?. ?.) ?????? ???? ? ???????? ?? ???? ? ??????, ?? ?????? ??? ???? ?????? ???????? ? ???????????? ??????? ???????, ???? ?????? ??? ??????????? ?????? .
? ?????????? ????? ?????? ?????? 17,16 (??. ????? 14,4) ???????????, ??? ???????????? (?????????? «PILISTIM», ? ??? ???? ?????????????? ???????, ??????????? ?????????? ???????, ? ???????? ??????? ) ????? ????????? ???????? ????????, ?? ???? ? ??? ????? ?????? ??? ????? ?????? ??????????? ? ??????? ???????????.
? ?????????? ???????????? ????????? ?????? ????? ??????????? ???? (? ??????? ????? — ????? , ???????) ??? ???????????? ?????, ? ????????? ???? ??? ?????? ??????? ? ????. ??? ??????? ????? ???????? ??????????? ? ???? ?? ????????? ????? (????? 1400 °C, ? ?????? ?????? ???????? ??? 1535 °C). ??? ???? ?????????? ????? ? ???????????? ????????? 1100—1200 °C, ????? ??????? ? ??????? ????????? (???? ?? ??????????? ?????) ? ?? ?????????? ?????????? ?????. [ ?????????????? ???????? ] ????????????? ??? ??????? [ ???? ] ??????? ???????? ????????? ( ????. pig iron , ??-??????, ???????? ??????, ?????, ??????, ??????????, ? ?????????? ????? ?????), ?? ????? ???????????? [ ???? ] , ??? ??? ????????? ?????????? ? ???? ? ????????? ??????????? ????? ???? ??????? ????? ???????????? ? ????? ???????? ????????, ??? ??? ?????? ??????? ????????. ????? ????????????? ??????? ???????????? ????? ?? ?????? ???????? ????? ??????? ? ????????, ??? ???????, ? ???? ??????? ???????????? ??? ?????? ????????? ?????? ????, ????????? ? ?? ????? ???? ???????? ???????? ???????????? ???????? ?????????? .
????????????? *žel?zo ( ?????. ?????? , ???. ?????? , ??.?????. ?????? , ????. ?????? , ?????????. ?????? , ??????. ?elazo , ???. železo , ??????. železo ) ????? ????? ????????? ? ?????????? ?????? ( ???. geležis , ?????. dzelzs ). ????? ???????? ???????????? ?????? « ?????? » ? « ?????? »; ? ????? ????? «???????? ??????, ??????, ??????» .
??????? ????????? ?????? ?????????? ????????? ? ????? ???????????????? ?????.
???? ?? ??? ????????? ???????. *žel?zo ? ????????? ?????? ?????? , ??? ???????? ?????? ? ????, ???????? ?????? ?????? *žel?zo ?????????? ?????? *žely « ???????? » ? *glaz? «?????», ? ????? ????? « ?????? » . ?????? ?????? ???????????? ??????? ????????????? ?? ???????????? ????? .
????????? ????? ( ????. ferro , ??. fer , ???. hierro , ????. ferro , ???. fier ) ?????????? ???. ferrum . ????????? ferrum (< *ferzom ), ????????, ???????????? ?? ??????-?? ?????????? ?????, ?????? ?????, ?? ????????????. ??. ???. barzel ?, ???????. barzal , ?????????. parzilla . ?????? ??, ????????, ???????? burdina .
?????????? ????? ???????????? ???????? ?????? ( ?????. eisarn , ????. iron , ???. Eisen , ??????. ijzer , ???. jern , ????. järn ) ?? ????????? .
???????????? ????? *isarno- (> ??.-???. iarn, ??.-????. hoiarn), ????????, ???????? ? ???-?.?. *h 1 esh 2 r-no- «????????» ? ????????????? ????????? «????????» > «???????» > «??????». ???????? ?????? ???????? ?????? ????? ???????? ? ???-?.?. *(H)ish 2 ro- «???????, ??????, ?????????? ?????????????????? ?????» .
??????????????? ????? ??????? (sid?ros), ????????, ?????????? ?? ??? ?? ??????, ??? ? ??????????, ?????????? ? ?????????? ?????, ???????????? "???????" .
???????? ?????????? ????????? ?????? (????????) ?????????? ?? ???. sidereus — ????????; ?????????????, ?????? ??????, ???????? ? ???? ?????, ???? ???????????? ?????????????. ????????, ??? ?????????? ?? ????????. ? ?????????, ??????????????? ????? ??????? (???????) ??? ?????? ? ????????? sidus , ?????????? «??????», ????????, ????? ????? ?????????????.
????????? ?????? ??????? ?? ??????? ?????????? ???????? : 54 Fe ( ????????? ?????????????????? 5,845 %), 56 Fe (91,754 %), 57 Fe (2,119 %) ? 58 Fe (0,282 %). ????? ???????? ????? 20 ???????????? ???????? ?????? ? ????????? ??????? ?? 45 ?? 72, ???????? ?????????? ?? ??????? — 60 Fe ( ?????? ??????????? ?? ?????????? ? 2009 ???? ?????? ?????????? 2,6 ???????? ??? ), 55 Fe (2,737 ????), 59 Fe (44,495 ?????) ? 52 Fe (8,275 ????); ????????? ??????? ????? ?????? ??????????? ????? 10 ????? .
?????? ?????? 56 Fe ????????? ? ???????? ?????????? ?????: ??? ????????? ???????? ????? ????????? ??????? ????? ?? ?????? ????? ???????, ? ??? ?????????? ????????, ? ????????, ????? ?? ????????? ??????? ????? ?? ?????? ?? ???? ???????. ????????, ??? ??????? ???????????? ??? ??????? ????????? ? ????? ?????????? ????? (??. ???????? ?????? ), ? ??? ??????????? ???????? ????? ???????????? ?????? ? ?????????? ??????? ?????????? .

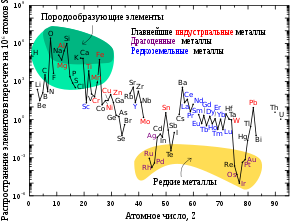
?????? — ???? ?? ????? ???????????????? ????????? ? ????????? ???????, ???????? ?? ???????? ?????? ??????, ? ?????????, ?? ?????. ???????????? ????? ?????? ?????? ?????? ?????? ????????? ? ????? ??????, ??? ??? ??????????, ?? ???????, ????? 90 %. ?????????? ?????? ? ?????? ???? ?????????? 5 %, ? ? ?????? ????? 12 %. ?? ???????? ?????? ???????? ?? ?????????????????? ? ???? ?????? ???????? . ??? ???? ? ???? ????????? ????? 86 % ????? ??????, ? ? ?????? 14 %. ?????????? ?????? ??????????? ?????????? ? ??????????? ??????? ????????? ???????, ??? ??? ??????? ? ?????????? , ????????? , ???????? ? ???????? . ? ???????????? ????????????? ?????? ????????????? ? ??????? ????? ???? ?????????? ? ?????????? ?????????, ???????????? ? ?????? ????. ? ??????? ???? ?????? ?????????? ? ????? ????? ??????????? 0,002—0,02 ??/?. ? ?????? ???? ??? ???????????? ??????????? ???? — 2 ??/?.
????????? ????????????? ??????????? ?????? — ??????? ? ???? ?????????? ???????? ?????????. ?????? ? ??????????? ????? — ????????????? — ??????? ???? ?????, ????????, ???????????? ? ?????? ? ????? ????? ??????????? ? ?????? ????. ???????? ?????? FeO — ???????? ????? ?????????? ?????? ? ?????? ? ?????? ????. ??????? ?????? Fe 2 O 3 ?????????? ??? ????? ???????, ???????? ??????????, ?????? ?????? ????, ? ?????????, ????????? ????? .
?? ??????????????????? ????????? ??? Fe 2+ ?????? ? ????? Mg 2+ ? Ca 2+ — ?????? ??????? ?????????, ???????????? ???????????? ????? ???? ?????? ?????. ? ???? ???????????????????? ???????? ?????? ???????? ?????? ?, ????????, ??????? ?? ?????? ?????????. ??? ???? ?????????? ?????? ? ????????? ??????????? ??????? ?????? ????????????? ? ??????????? ???????????.
? ?????? ???? ?????? ?????????????? ?????????? ?????? — ?? ??? ???? ?????????? ????? 4,1 % ????? ?????? ???? (4-? ????? ????? ???? ?????????, 2-? ????? ????????). ? ?????? ? ?????? ???? ?????? ????????????? ??????? ??????? ? ?????????, ??? ???? ??? ?????????? ??????????? ? ???????? ? ?????????????? ???????, ? ???? — ? ?????? ? ??????? ??????? .
???????? ??????? ????? ??? ? ?????????, ?????????? ??????. ?????????? ???????????? ???????? ????? ??????? ???????? ( ??????? , Fe 2 O 3 ; ???????? ?? 70 % Fe), ????????? ???????? ( ???????? , FeO · Fe 2 O 3 ??? Fe 3 O 4 ; ???????? 72,4 % Fe), ????? ???????? ??? ??????? ( ????? ? ??????????, ?????????????? FeOOH ? FeOOH·nH 2 O). ????? ? ?????????? ???? ????? ??????????? ? ????? ???????????? , ??????? ??? ?????????? «???????? ?????», ???????? ??????? ????????? ????????? ????? ??????. ????? ??? ????? ????? ????????? ?????????????, ??????? ?? ?????????? ????????? ? ?????? ??? ?????????? ????? ?????. ??? ???? ?????????? ????????? , ??? ???????, ???????? ????. ? ??? ????? ??????????? ???????? Fe 3 (PO 4 ) 2 ·8H 2 O, ?????????? ?????? ?????????? ????????? ? ?????????-???????? ???????? .
? ??????? ????? ?????? ?????????????? ???????? ?????? — ????? FeS 2 (?????? ??? ???????? ????????) ? ???????? . ??? ?? ???????? ???????? ????? — ????? ?????????? ??? ????????? ?????? ???????, ? ???????? ????? ???????? ?????? ? ???????.
?? ??????? ???????? ??? ?????? ???????? ?????? ????? ? ???? [ ???????? ?? ?????? 3924 ??? ] .
?????????? ?????? ? ??????? ???? — 1?10 ?5 —1?10 ?8 %.
?????? ????? ????????????? ???????? ?????? :
?????? ????????????? ????????? ??????, ??????????, ????????:
?? ?????? ????????????? ?????? ??? (?????? 2011 ????), ??????? ??????????? ?????? ???????? ???? ?????????? ????? 160 ???? ???? . ???????? ?????? ??????(? ????????? ?? ?????????? ????????????? ??????) ????????? ? ?????? (1 ?????), ????????, ?????????, ???, ??????, ??????, ????????, ?????????, ???????, ???????, ??????, ???, ??????, ?????, ????????, ????????, ???????, ?????. ??? ?????? ?? ????????? ????????? ??????? ? ??????? ??????????? ? ???? ????????????? ???-????? , ?????? ???????? ??????????? ? 40,2 ???? ???? ???? (5 % ??????? ??????? ).
? 2019 ???? ?????? 2,896 ???? ???? ???????? ????, ????? ?????????? ?????????????? 366 ???? ???????? ??? . ???? ???????? ???? ?????????? 126,35 ????????/????? .
?????? — ???????? ?????? , ? ????????? ????????? — ??????????-?????? ????? ? ????????? ????????. ?????? ?????? ????????? , ????????? ??????? (? ????????? — ??????? ) ???????? ??? ????????? ? ????????? . ???????? ???? ??????????? ?????????? ??????????. ????? ???????? ??? ?????????? « » — ?????? ???? ???????? (?????? Fe, ??????? Co, ?????? Ni), ?????????? ??????? ??????????? ?????????? , ???????? ????????? ? ?????????? ?????????????????????? .
??? ?????? ?????????? ??????????? , ??? ????? ?????? ??????????????? ???????????:
?????????????? ?? ???????? ?-Fe ??? ????????? ???? , ? ????????????? ?? ??? ????????????? ?-Fe. ??? ??????? ?????? ??? ????? ???? ????? ???? (769 °C ? 1043 K ) ???????? ???????? ????? ???????????? ?????????? ???????? ????????? ???????? ?????????? , ????????????? ?????????? ?????????????? — ?????????? ??????? ??????? ??????? ????, ?? ???????? ???????? ??????? ???? ? ?????????? ???????? ?????????? ?????????? ?????????? ?? ??????????.
??? ??????? ?????? ??? ?????????? ????????, ? ????? ?????? ?????????????? , ?????????? ????????? ?????????? ???????????:
??????? ? ????? ???????? ? ?????????? ????????? ???????????? ??????? ???????? ??????????? ??????? ????????? (??. ??????? ????????? ??????—??????? ). ??????? ??????? ???????? ? ?- ? ?-?????? ?????????? ???????? . ?????? ????????? ??????????????????? ?-?????? ? ?????????????????? ?-?????? (??? ?????? ??????), ???? ?? ??????? ????????? ?????????. ??????? ??????? ???????? ? ?-?????? ?????????? ?????????? .
??????? ???????????? ??????????? ????? ??? ??????????? ?????. ?????? ????????? ?—? ????????? ??????????????? ??????? ?????????? ?????????????? ????? . ??? ????? ??????? ?????? ??? ?????? ????? ?? ???????? ?? ?????? ???????? ??????????.
?????? ????????? ? ???????? ??????????? ???????? . ? ???? ??????????? ??????????? ??????????? ?????? ????? ?? ???????? ? ????? ????????? ? ????????????? ?????????. ????? ???????, ?????? ????????? ? ???????? ??????? ??????????.
??????????? ????????? ?????? 1539 °C, ??????????? ??????? — 2862 °C.
| ??????? ????????? | ????? | ????????? | ???????? | ?????????? |
|---|---|---|---|---|
| +2 | FeO | Fe(OH) 2 | ????????????? | ?????? ?????????????? |
| +3 | Fe 2 O 3 | Fe(OH) 3 | ????? ?????? ?????????, ?????? — ?????????? | ?????? ?????????? |
| +6 | ?? ??????? | <H 2 FeO 4 > * | ????????? | ??????? ?????????? |
* ??????? ? ????????? ???? ?? ?????????? — ???????? ?????? ?? ????.
?????????? ?????????? ?????? ??????? ?? ??????? ??? ???????, ???????????? , ??????????? ????? ? ?????????.
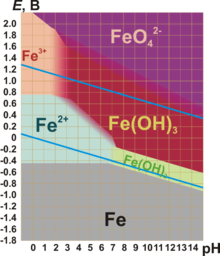
??? ?????? ???????? ?????????? ??????? ????????? — +2 ? +3.
??????? ????????? +2 ????????????? ?????? ????? FeO ? ??????? ????????? Fe(OH) 2 . ??? ????? ???????? ????????. ? ????? Fe(+2) ???????????? ? ???? ???????. Fe(+2) — ?????? ??????????????.
??????? ????????? +3 ????????????? ??????-?????????? ????? Fe 2 O 3 ? ?????????? ????????? Fe(OH) 3 . ??? ????? ?????????? ????????, ???? ? ?????????, ? ???????? ???????? ? ??? ???????? ?????. ???, ???? Fe 3+ ?????? ????????????? ???? ? ?????? ?????. Fe(OH) 3 ???????????? (? ?? ?? ?????????), ?????? ? ????????????????? ???????. Fe 2 O 3 ????????? ?? ???????? ?????? ??? ??????????, ????? ??????? (?????????? ???? ?? ???????????? ? ????????? ???? ??????? HFeO 2 ):
?????? (+3) ???? ????? ????????? ?????? ????????????? ????????.
??????? ????????? +2 ? +3 ????? ????????? ???? ? ????? ??? ????????? ????????????-????????????????? ???????????.
????? ????, ?????????? ????? Fe 3 O 4 , ?????????? ??????? ????????? ?????? ? ??????? +8/3. ?????? ???? ????? ????? ????? ????????????? ??? ?????? ?????? (II) Fe +2 (Fe +3 O 2 ) 2 .
????? ?????????? ??????? ????????? +6. ???????????????? ?????? ? ?????????? ? ????????? ???? ?? ??????????, ?? ???????? ???? — ??????? (????????, K 2 FeO 4 ). ?????? (+6) ????????? ? ??? ? ???? ??????. ??????? ???????? ???????? ????????????.
???????? ????? ??????? ?????????: ?2 ( ??????????????????? ?????? ), ?1, 0 ( ????????????? ?????? ), +1, +4, +5.
??? ???????? ?? ??????? ??? ??????????? ?? 200 °C ?????? ?????????? ??????????? ??????? ??????? ?????? , ?????????????? ??????????? ????????? ???????. ?? ??????? ??????? ?????? ??????????? ?????? ????? ???????? , ??????? ?? ???????????? ??????? ????????? ? ????? ? ??????? ? ??? ??????????. ???????? ?? ????? ??????????? ??????????? ???????, ??????????? ?? ?????????? ??????? ????? ???????? ??? Fe 2 O 3 ·xH 2 O.
??????????????? ? ????????? .
??? ?????????? ???????? ????????????? ?????? ????????? ? ??????? ????????(II) CO , ?????? ?????????? ??????, ??? ??????? ???????? ????? ??????? ????????????? ?????? Fe(CO) 5 . ???????? ????? ????????? ?????? ???????? Fe 2 (CO) 9 ? Fe 3 (CO) 12 . ????????? ?????? ?????? ????????? ?????????? ??? ??????? ?????????????????? ??????????, ? ??? ????? ? ????????? ??????? (? 5 -C 5 H 5 ) 2 Fe.
?????? ????????????? ?????? ????????? ? ???? ? ? ???????????? ????????? ??????? . ?????? ?? ???????????? ? ???????? ????????????????? ?????? ? ??????? ???????? ??-?? ?????????? ??????????? ??????? ??????? ???????? ???????. ??????? ????????????????? ?????? ???????, ??????? ????? ??????? ???????????, ??????????????? ? ???????.
????? ??????(II) FeO ???????? ????????? ??????????, ??? ???????? ????????? Fe(OH) 2 . ???? ?????? (II) ???????? ??????-??????? ??????. ??? ?? ????????, ???????? ?? ??????? ???????, ??? ??????????? ?? ???? ????????? ?? ?????? (III). ????? ?? ??????? ????????? ??? ???????? ?????? ????????? ????? ??????(II):
?? ????? ??????(II) ? ?????? ????????? ????????? ???? ???? — ??????? ??????? ??????? ? ??????(II) (NH 4 ) 2 Fe(SO 4 ) 2 ·6? 2 O.
????????? ?? ???? Fe 2+ ? ???????? ????? ??????? ????????????????(III) ????? K 3 [Fe(CN) 6 ] (??????? ???????? ????). ??? ?????????????? ????? Fe 2+ ? [Fe(CN) 6 ] 3? ???????? ?????? ????????????????? (III) ?????-?????? (II) (?????????? ????):
??????? ????????????????? ???????????????????? ? ???????????????? (II) ?????-?????? (III) ( ?????????? ?????? ):
??? ??????????????? ??????????? ?????? (II) ? ???????? ?????????? ??????????? Phen, ?????????? ? ??????? (II) ??????? ???????? FePhen 3 (???????? ??????????????? — 520 ??) ? ??????? ????????? ?? (4-9) .
????? ??????(III) Fe 2 O 3 ????? ????????? , ??? ???????? ??? ????? ??????, ??? Fe(OH) 2 , ????????? Fe(OH) 3 , ??????? ????????? ? ?????????:
???? Fe 3+ ??????? ? ??????????? ?????????????????. ? ??? ??? Fe 3+ , ??? ???????, ??????? ?????? ?????????? ????. ????? ???? ????? ??????? ??? ?????????? ????.
??? Fe 3+ ????????? ????????????? ???? ? ?????? ?????. ??? pH>4 ???? ??? ??????????? ????????? ?????????? ? ???? Fe(OH) 3 :
??? ????????? ????????? ???? Fe 3+ ?????????? ???????????? ????- ? ???????????????, ??-?? ???? ???????? ??????????? ?????????? ????.
????????? ???????? ?????????? ??????(III) Fe(OH) 3 ???????? ????? ?????. ?? ???????? ??????????? ?????? ? ?????????????????? ?????????? ???????:
???????????? ??? ???? ????????????????? ??????(III) ????????? ?????? ? ?????? ???????? ?????????. ??? ??????????? ????????? ????? ??? ???????????, ?????? ? ?????? ???????? Fe(OH) 3 .
??? ?????????? ?? ???????? ? ???????? ?????? ???????? Fe 2 O 3 ???????? ????????????? ??????? :
?????????? ??????(III) ? ????????? ????????????????? ????????????? ???????:
??????(III) ???????? ???????????? ??????? ???????? ? ????????????? ????????? ???? ??????? , ????????, KFe(SO 4 ) 2 — ?????????????? ??????, (NH 4 )Fe(SO 4 ) 2 — ???????????????? ?????? ? ?. ?.
??? ????????????? ??????????? ? ???????? ?????????? ??????(III) ?????????? ???????????? ??????? ????? Fe 3+ ? ??????????????? ???????????? SCN ? . ??? ???? ?????????? ????? ????-??????? ?????????? ?????????? ?????? [Fe(SCN)] 2+ , [Fe(SCN) 2 ] + , Fe(SCN) 3 , [Fe(SCN) 4 ] ? . ?????? ????? (? ??????, ? ????????????? ?? ???????) ??????? ?? ????????? ????????, ??????? ??? ??????? ????????????? ??????????? ?????? ???? ????? ??????????.
?????? ???????????? ????????? ?? ???? Fe 3+ ?????? ????????????????(II) ????? K 4 [Fe(CN) 6 ] (?????? ???????? ????). ??? ?????????????? ????? Fe 3+ ? [Fe(CN) 6 ] 4? ???????? ????-????? ?????? ????????????????? (II) ?????-?????? (III) (?????????? ??????):
????????????? ???? Fe 3+ ?????????? ?? ??????????? ??????? (? ??????????? ?????) ??? ?????? (? ????????????? ?????) ?????????? ? ????????????????? ???????? . ??? ??????? ??????? ?????????? ??????? ???????, ??? ??? ????????? ?????? (? ?????????, ??????) ???????? ? ??????? ? ????????????????? ???????? ????????? ????????? ?? ?????? ??????????? ????????????????.
??????? — ???? ?? ???????????? ? ????????? ???? ???????? ??????? H 2 FeO 4 . ??? ?????????? ??????????? ?????, ?? ????????????? ????????? ???????????? ????????????, ? ?? ????????????? — ????????. ???????? ??????? ??? ???????? ????????????? ????? ??? ????? ?? ?????? Fe(OH) 3 ? ?????? :
??????? ????? ????? ???????? ???????????? 30%-???? ???????? ?????? ?? ???????? ?????:
??????? — ??????? ??????????. ? ?????? ????? ??????????? ? ?????????? ????????? :
????????????? ???????? ???????? ?????????? ??? .
???????? ??????? ????????? +7 ? ?????? [FeO 4 ] ? .
??????? ????????? ?? ????????????????? ????????? ?????????? ?????? (VIII) , ?????? ??????????? ?????, ?????????????? ??? ??????????, ???.
? ?????????????? ?????? ???????? ?? ???????? ???? , ? ???????? ?? ???????? (Fe 2 O 3 ) ? ????????? (FeO·Fe 2 O 3 ).
?????????? ????????? ??????? ?????????? ?????? ?? ???. ???????? ???????????????? ???????? ???????? ???????.
?????? ???? ???????????? — ?????????????? ?????? ????????? ? ???????? ???? ??? ??????????? 2000 °C . ? ???????? ???? ??????? ? ???? ????? , ???????? ???? ? ???? ?????????? ??? ???????? ? ???? (????????, ????????? ) ???????? ??????, ? ????? ?? ????????? ????? ???????????? ???????? ???????.
? ???? ??????? ? ???? ????? ?????????? ?? ?????????? ???????? . ?????? ????? ?????????? ??? ??????? ? ?????????? ????????? :
? ???? ???????, ????????? ???????? ??????????????? ?????? ?? ????. ????? ?????? ??????? ??? ???????, ???????? ??????? ??? ?????????? ????? ????? ??????(III) :
???? ??????????? ??? ?????????? ?? ????????????? ???????? (? ?????? ??????? ?? ????????? ; ????????, ????? ) ? ?????????? ????. ???????? ???? ???????? ????????? ( ???????? ??????? ) ? ??????? ( ???????? ?????? ). ??? ?????????? ?????? ???????? ?????????? ?????? ?????.
???????? ????? (? ?????? ?????? ???????? ??????? ) ??????????? ? ???, ??? ??? ??? ?????????? ?? ??????????? ?? ??? ?????? :
????? ??????? ??????????? ? ????????? ???????, ??????? ???? — ??????????? ??????? :
????, ? ??????? ?? ???????? ??????? , ???????? ? ????. ????? ??????, ??? ??????, ???? ??????? ?? ??????????? — ??? ???????? ????????? ????????? ???? ?? ???????. ???? ????? ????? ?????????????? ??? ????????????? ? ???????? ?????????. ??????? ??????, ?????????? ? ???????? ???? , ???????? ???????? ????? ???????? ( ????? ). ????? ????? ???????, ????? ????? ???????????? ???????????????, ?? ??????? ?????????? ???????????.
??????? ???????? ? ?????? ??????? ( ???? , ?????? ) ??????? ?? ?????? ?????????? ? ???????????? ????? ??? ? ???????????. ????????????? ???? ???????????? ? ??? ???????? ???????????? ??????.
????? ????????? ????????, ????????????? ??????? ??????? ????????? ??????. ? ???? ?????? ?????????????? ???????????? ???? ????????? ? ?????? ??????, ???????? ???????. ??????? ????????, ? ???????????? ? ??????? ???? ???????? ?????????? ????????? ?????? , ??????? ???????? ??????? . ??????? ????? ??????????????? ??????:
??? ???? ?? ?????????? ??????????? ?????? ?????? ?????????, ??? ???? ? ??????, ??????? ???????? ???????? ????????? ? ???????? ???? . ?????? ?????????? ? ??????? ????, ? ? ?????????? ?????????????? ? ????????????? ?????.
????????? ?????? ?????? ?????????? ???????????? ????????? ??? ????? .

?????? — ???? ?? ????? ???????????? ???????? , ?? ???? ?????????? ?? 95 % ???????? ????????????????? ????????????.
? ????? ?????????? ?????? ???????? ?????? ?????????????? , ?????????????? ???????? ?????? ?????????? (???????). ???????? ??????????????? ???? ?????? ???????? ??????????? ???????? ???????? — ???????? . ?????????? ?????? ??????????? ??? ??????? ?????????: ?????? ? ???????? ? ?????? ? ????????.
?????? ?????? ?????? ? ???????? ? ???? ?????????, ??????????? ????? . ? ?????????, ???? ???????? ???????????? ? ??????????? — ????????? ?????, ?????????????? ????????? ????????? ? ?????? ?? ???? ??????? ???????? ? ????????. ?????? ?? ?????????? ????? ? ??????? ????.
????????? ??????, ???????? ?? ????, ???????????, ????????, ? ???????? ?????-?????????????, ?????????? ????? ? ??????? , ? ?????? ???????? ?????????????-?????????, ??????? ????????? ? ??????? ??? . ?????????????? ?????????? ?????? ??????????? ? ????????? ????????? , ?????? ???????????? ??? ??? ?????????? ????? ???????.
? ????????? ????????? ???????? ?????????? ????? 3—4 ??????? ?????? (????? 0,005 %), ?? ??????? ?????? ????? 3,5 ?? ????????? ? ?????? ?????. ?????????? ???????? ???????? 68 % ????? ?????? ?????????, ???????? — 27 %, ????????? — 4 %, ??????????? — 0,1 %. ??????????? ?????? ??? ?????????? ???????????????? ?????? ?????? ??????, ??????????? ?? ????, ? ??????, ??????????????? ??? ?????????? ??????? ??????????? ? ??????????? (??????? ??????) ? ??????? ????????? .
???????? ??????????? ???????? ? ??????, ?? ?????????? ??????, ????????? : ???? — ?? 4 ?? 18 ??, ???????? ??????? — 10 ??, ???????? ??????? — 18 ??, ?????????? ??????? ?? ?????? ???????? ???????????? — 33 ??.
? ?????? ??????????? ???????? ??????????? ? ?????? ???? ????? ?????????? ??????????? ?? ????? ??????????? .
«???????????? ???????? ???????? ???» (National Academy of Medicine) ????????? ??????? ??????????? ? ?????? ? ??????????????? ??????????? ??????, ????????? ????? ??????????? ? ???, ???? ???????????? ??????? ??????????? ??? ?? ????? 97 % ? ?????? ?????? ?????????. ?????? ??????? ??????????? ? ?????? ??????? ?? ????????????? ??????, ??????????????? ??????? ???????? ?? ????????????? ? ??????????? 10 % ?????? ?? ???????? ????????? (??????? ????????????? 25 %) ? 90 % ?????? ?? ???????????? ????????? (??????? ????????????? 16,8 %), ? ????? ?????????????? 18 %. ????????? ?????? ????? ?? ???? ?????? ?????????? ?? ?????????, ????? ??? ??? ???????? ?? ?????????????? ????????????? 10 % .
| ??? | ??????? |
????????????? ???????? ????? ???????????
??????
( ?? ?????? « » (National Academy of Medicine) ) , ?? / ????? |
|---|---|---|
| ???????? | ?? 6 ??????? | 0,27 |
| ???????? | 7—12 ??????? | 11 |
| ???? | 1—3 ???? | 7 |
| ???? | 4—8 ??? | 10 |
| ????????? | 9—13 ??? | 8 |
| ????? | 14—18 ??? | 11 |
| ??????? | 14—18 ??? | 15 |
| ??????? | 19 ??? ? ?????? | 8 |
| ??????? | 19—50 ??? | 18 |
| ??????? | 50 ??? ? ?????? | 8 |
? ???????? ???????? ? ???????? ?????? ????????? ? ?????. ???????? ?????? ?? ?????? ? ???? , ? ??????? ??????? ???? , ??????? ( ???????? , ?????? ), ?????? ????? ? ??????? , ?????????????? ????? ( ????? ????????? ), ? ????? ????????? ???? ?????? — ?????? , ???????? , ??????? ????? . ?????? ????? ?????? ???????????????? ????????? ?????????? ?????? , ???????? ????????? ??-?? ???????? ? ??????????? ??????? (??? ??????? ???? ????? ???????).
?????? ? ??????? ???????????? ?? ??????? , ??? ?????? (?? ???? ? ?????? ???????? ??????????) ? ????????? (?? ???????????? ????). ? ????????????? ?????? ?????? ????????? ? ??????? ???? . ? ????????? ???????????????? ?????? ?????? ??????????????? ??????????? ? ??????. ? ????? ?????? ??????? ??????????? , ???????? , ????????????? ???????? ?????????????????????? ? ??????????????? , NADH-????????????? ? ????????????????????? . ????????? ?????, ?????????? ????????? ??????, ????????? ? ?????? ????????????? , ???????? ????????? ?? ??????? ?????????? ? ???????????? ??????? ???????? ? ?????????? ??? ???????? ????????? ? ???????? ???????????, ? ????? ????????????? ???????????? (???????? ?????????? ???????? Clostridium pasteurianum ), ??????????? ? ???????? ??? ?????????? ???????? ?????????. ???????????? ???????????-1 ????????? ? ????????????????? ? ??????????? ?????????? ???????? ? ??????????? ? ??????? ?????????????? (??????????????????? ?????????? ???????????) ????????? ????????? ?450 , ? ????? ? ??????? ???????? ?????????? ??????. ?????????? ???????????? ??????? ?? ??????? ????- ??? ???????-????????? ???? ? ????????????????? ?????? ? ????? ????? ??????? ???? (???????? ), ??? ????????? ? ????????? ???????? ????? ???????????? ??????? .??????? ?????? ??????????? ???????? ?????????? (?? 15 ?? 35 %). ?? ???????? ?????????? ?????? (???? ? ???????? ???? ??? ??????? 60 % ) ?????? ?????????????? ??????? . ??????? ???????? ???????? ?????? ???????????? ?????? ? ????? ???????????? ??????? ??? ?????? ????? . ???????????? ???????? ?????? ???? , ??????? , ?? ??????? ??????? — ????????? ??????? , ???????? , ?????? ? ?????? .
? ???????, ??-?? ???????? ?????? ????????? ?????????? ???????? ?????? ?? ??????? ????????? ? ?????? 0,84-0,91 % . ???????? ?????? ?? ???????????? ????????????, ??????????? ? ???????????????? ????? ???????? ???????? ??? ??????? ???????? ????????????? ?? 62 %, ???? — ?? 35 %, ? ??????????? ????????????? ???? (? ??????? ??????????? ???????????? ???????) ??????????? ??? ?? 85 % . ? ?? ?? ????? ?????? ?? ????? ????????? ?? ??, ??? ???? ????? ??????? ??????????? ??? ? ????? ?? ??????????? ?? ?????????? ?????? ? ????? .
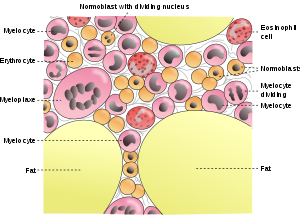
??? ???????????????? ????? ??????, ???????????? ? ?????, ??? ???????, ?????? ??????????. ? ????????? ????? ????????????????? ?????????? ????? ???????????? ? ?????????? ??????, ? ????????? ??????? ??? ????? ???????????? ?? ???? ????????? ???????. ?, ??? ?? ?????, ??????? ?????? — ??????? ??????? ? ????????????? ??????? ? ???????????? ???????????? ?????? ?????????. ??? ????? ???????????????? ?? ????? ????????? ??????? , ???????? ?????????? ?? 2 ???? ??????? ?? ???? ???? .
? ????????? ??????????? ??????? ( ?????? , ? ????? ??? ????????? ????? ) ?????????? ????????? ???????????????? ????????? ? ??????? ??????? ( ????????? , ?????????? ). ??????????? ? ?????? ??????????? ?????????? ??? ??????, ?????????, ????????, ?????? ????????????? ????????? , ??? ??????? ? ???????????? , ??????? ????? ?????? ?????????????? ? ??????????? ???????.
????????????? ???????? ????????? ???????? ? 1,8 ???? ?????? ??????, ??? ?? ????????????? . ? ???????? ??????? ????????, ??????????????? ?? ???????, ????? ????????? ???????, ???? ????????????? ????? ?????? (???????????????? ??????????) ???????? ????????????? ? ?????? ?? ?????? ????? ??????? ????????? ?????? ?? ???????? . ????????, ??? ???????? ????????????? ????????????????? ? ????? ? ????? ?????????? ?????????? ????????? ?????? ?????? .
?? ??????????? ???? ????????????, ?? ????? ????????????? ? ???????? ? ???????? ?????? ?????????? ?????? ? ???? ?????????? ? ?? 1,2 ?? 21 ???? . ??? ???? ?????????? ?????? ??????? ?????????? ? ?????? ??? ???, ?????????????? ? ????? (????????, ????). ???????????? ?????????? ? ?????? ???? ?????????? ?????? ? ??????, ??? ????????? ???, .
? ?? ?????, ??? ????????? ????????????? ???????, ??? ????????? ?????? ???????? ? ???????? ??????, ???? ????????? ????????????, ????????????, ??? ??? ?? ???, ? ????, ??????? ?????? ??????, ????????? ?????? ??????? ?????.
?????????? ?????? ????? ???????? ? ???????? ?????????? ?????? ?????? ? ?????? ????? ??-??? ????? (?? ???????? ??????). ????? ????????????? ???????? ? ???????? ?????? ? ????????????? ???? ???????? ?????????? ? ??? ?????? .
?????????? ?????? ? ???? ??????????? 1—2 ??/? ??????????? ???????? ?? ????????????????? ????????, ???????? ?? ?????????? ??????? ????, ? ?????? ???? ????????????? ??? ?????????????, ???????? ? ???????? ????????????? ??????? [ ???????? ?? ?????? 1648 ???? ] , ????? ????? ???????? ??????? ????? ? ?????? — ????????????? . ??? ?????? ? ???? 0,3 ??/?.
?????????? ?????????? ?????? ? ????????? ????????? ??????????? ????????. ????????????? ?????? ??????????? ????????? ????????? ????????? , ???????? ??????????????? ??????? ????????? ?, ????????, ???????????? ???????? ????????????? , ??????? ??????????? ????????? ?????? ???????? ????? ?? ?????????????.