Interested Article - Изотопы лития

- 2020-06-28
- 3
Изото́пы лития — разновидности атомов (и ядер ) химического элемента лития , имеющие разное содержание нейтронов в ядре. На данный момент известны 9 изотопов лития и ещё 2 возбуждённых изомерных состояний некоторых его нуклидов , 10m1 Li − 10m2 Li.
В природе встречаются два стабильных изотопа лития: 6 Li (7,5 %) и 7 Li (92,5 %).
Наиболее устойчивый искусственный изотоп, 8 Li, имеет период полураспада 0,8403 с.
Экзотический изотоп 3 Li ( ), по-видимому, не существует как связанная система.
Происхождение
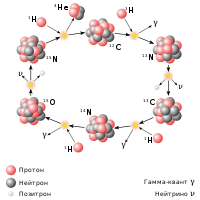
7 Li является одним из немногих изотопов, возникших при первичном нуклеосинтезе (то есть в период от 1 секунды до 3 минут после Большого Взрыва ) в количестве не более 10 −9 от всех элементов. Некоторое количество изотопа 6 Li, как минимум в десять тысяч раз меньшее, чем 7 Li, также образовано в первичном нуклеосинтезе .
Примерно в десять раз больше 7 Li образовались в звёздном нуклеосинтезе. Литий является промежуточным продуктом реакции ppII , но при высоких температурах активно преобразуется в гелий .
Наблюдаемые соотношения 7 Li и 6 Li не сходятся с предсказанием стандартной модели первичного нуклеосинтеза ( standard BBN ). Данное расхождение известно как « primordial lithium problem ».
Разделение
Литий-6 имеет большее сродство с ртутью, чем литий-7. На этом основан процесс обогащения COLEX . Альтернативный процесс — вакуумная дистилляция, происходящая при температурах около 550 °C.
Обычно разделение изотопов лития требовалось для военных ядерных программ ( СССР , США , Китая ). В настоящее время функционирующими мощностями по разделению обладают лишь Россия и Китай .
Так, в США в 1954 году (по другим данным, в 1955 году) на военном заводе Y-12 был построен цех для разделения изотопов лития. Обогащённый по изотопу 6Li направлялся для производства термоядерного оружия , а обогащённый по 7Li — на нужды гражданской атомной программы США .
Применение
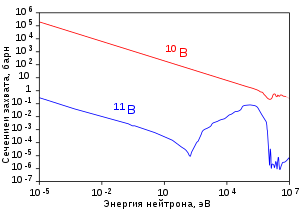
Изотопы 6 Li и 7 Li обладают разными ядерными свойствами (сечение поглощения тепловых нейтронов, продукты реакций) и сфера их применения различна. входит в состав специальной эмали, предназначенной для захоронения высокоактивных ядерных отходов, содержащих плутоний .
Литий-6
Применяется в термоядерной энергетике.
При облучении нуклида 6 Li тепловыми нейтронами получается радиоактивный тритий 3 H:
Благодаря этому литий-6 может применяться как замена радиоактивного, нестабильного и неудобного в обращении трития как в военных ( термоядерное оружие ), так и в мирных ( управляемый термоядерный синтез ) целях. В термоядерном оружии обычно применяется дейтерид лития-6 6 LiD.
Перспективно также использование лития-6 для получения гелия-3 (через тритий) с целью дальнейшего использования в дейтерий-гелиевых термоядерных реакторах.
Литий-7
Применяется в ядерных реакторах . Благодаря очень высокой удельной теплоёмкости и низкому сечению захвата тепловых нейтронов (45 миллибарн ) жидкий литий-7 (часто в виде сплава с натрием или цезием ) служит эффективным теплоносителем . Фторид лития-7 в сплаве с фторидом бериллия (66 % LiF + 34 % BeF 2 ) носит название « флайб » (FLiBe) и применяется как высокоэффективный теплоноситель и растворитель фторидов урана и тория в высокотемпературных жидкосолевых реакторах , и для производства трития .
Соединения лития, обогащённые по изотопу лития-7, применяются на реакторах PWR для поддержания водно-химического режима, а также в деминерализаторе первого контура. Ежегодная потребность США оценивается в 200—300 кг , производством обладают лишь Россия и Китай .
Таблица изотопов лития
|
Символ
нуклида |
Z ( p ) | N( n ) |
Масса изотопа
( а. е. м. ) |
Период
полураспада (T 1/2 ) |
Канал распада | Продукт распада |
Спин
и
чётность
ядра |
Распространённость
изотопа в природе |
Диапазон изменения изотопной распространённости в природе |
|---|---|---|---|---|---|---|---|---|---|
| Энергия возбуждения | |||||||||
| 3 Li | 3 | 0 | 3,03078(215)# | p | 2 He | 3/2−# | |||
| 4 Li | 3 | 1 | 4,02719(23) |
9,1(9)⋅10
-23
с
[5,06(52) МэВ] |
p | 3 He | 2− | ||
| 5 Li | 3 | 2 | 5,012540(50) |
3,7(3)⋅10
-22
с
[1,24(10) МэВ] |
p | 4 He | 3/2− | ||
| 6 Li | 3 | 3 | 6,0151228874(15) | стабилен | 1+ | [0,019, 0,078] | |||
| 6m Li | 3562,88(10) кэВ | 5,6(14)⋅10 -17 с | ИП | 6 Li | 0+ | ||||
| 7 Li | 3 | 4 | 7,016003434(4) | стабилен | 3/2− | [0,922, 0,981] | |||
| 8 Li | 3 | 5 | 8,02248624(5) | 838,7(3) мс | β − | 8 Be | 2+ | ||
| 9 Li | 3 | 6 | 9,02679019(20) | 178,2(4) мс | β − , n (50,5(1,0)%) | 8 Be | 3/2− | ||
| β − (49,5(1,0)%) | 9 Be | ||||||||
| 10 Li | 3 | 7 | 10,035483(14) |
2,0(5)⋅10
-21
с
[0,2(1,2) МэВ] |
n | 9 Li | (1−, 2−) | ||
| 10m1 Li | 200(40) кэВ | 3,7(1,5)⋅10 -21 с | ИП | 1+ | |||||
| 10m2 Li | 480(40) кэВ |
1,35⋅10
-21
с
[0,350(70) МэВ] |
ИП | 2+ | |||||
| 11 Li | 3 | 8 | 11,0437236(7) | 8,75(6) мс | β − , n (86,3(9)%) | 10 Be | 3/2− | ||
| β − (6,0(1,0)%) | 11 Be | ||||||||
| β − , 2n (4,1(4)%) | 9 Be | ||||||||
| β − , 3n (1,9(2)%) | 8 Be | ||||||||
| β − , α (1,7(3)%) | 7 He | ||||||||
| β − , деление (0,0130(13)%) | 9 Li, 2 H | ||||||||
| β − , деление (0,0093(8)%) | 8 Li, 3 H | ||||||||
| 12 Li | 3 | 9 | 12,052610(30) | n | 11 Li | (1−,2−) | |||
| 13 Li | 3 | 10 | 13,061170(80) |
3,3⋅10
-21
с
[0,2(9,2) МэВ] |
2n | 11 Li | 3/2−# | ||
Пояснения к таблице
- Распространённость изотопов приведена для большинства природных образцов. Для других источников значения могут сильно отличаться.
- Индексами 'm', 'n', 'p' (рядом с символом) обозначены возбужденные изомерные состояния нуклида.
- Символами, выделенными жирным шрифтом , обозначены стабильные продукты распада. Символами, выделенными жирным курсивом , обозначены радиоактивные продукты распада, имеющие периоды полураспада, сравнимые с возрастом Земли или превосходящие его и вследствие этого присутствующие в природной смеси.
- Значения, помеченные решёткой (#), получены не из одних лишь экспериментальных данных, а (хотя бы частично) оценены из систематических трендов у соседних нуклидов (с такими же соотношениями Z и N ). Неуверенно определённые значения спина и/или чётности заключены в скобки.
- Погрешность приводится в виде числа в скобках, выраженного в единицах последней значащей цифры, означает одно стандартное отклонение (за исключением распространённости и стандартной атомной массы изотопа по данным ИЮПАК , для которых используется более сложное определение погрешности). Примеры: 29770,6(5) означает 29770,6 ± 0,5; 21,48(15) означает 21,48 ± 0,15; −2200,2(18) означает −2200,2 ± 1,8.
Примечания
- ↑ BD Fields, от 19 октября 2016 на Wayback Machine , Annual Reviews of Nuclear and Particle Science 2011
- Постнов К.А. . Дата обращения: 30 ноября 2013. 3 февраля 2013 года. ; см Рис. 11.1
- . Дата обращения: 30 ноября 2013. Архивировано из 13 ноября 2013 года.
- от 28 мая 2015 на Wayback Machine // Университет Toledo — «The Destruction of Lithium in Young Convective Stars» slide 28
- Greg Ruchti, от 4 марта 2016 на Wayback Machine — «Lithium is Fragile» slide 10
- Karsten JEDAMZIK, от 3 декабря 2013 на Wayback Machine
- ↑ . ATOMINFO.RU. 2013-10-23. из оригинала 20 июля 2015 . Дата обращения: 29 декабря 2013 .
- . Дата обращения: 1 ноября 2022. 1 ноября 2022 года.
- от 20 января 2017 на Wayback Machine // , 19 September 2013; от 14 октября 2017 на Wayback Machine
- .
- Данные приведены по Huang W. J. , Meng Wang , Kondev F. G. , Audi G. , Naimi S. (англ.) // Chinese Physics C. — 2021. — Vol. 43 , iss. 3 . — P. 030002-1—030002-342 . — doi : .
-
↑
Данные приведены по
Kondev F. G.
,
Wang M.
,
Huang W. J.
,
Naimi S.
,
Audi G.
(англ.)
//
. — 2021. —
Vol. 45
,
iss. 3
. —
P. 030001-1—030001-180
. —
doi
:
.

- ↑ . ciaaw.org . Дата обращения: 21 октября 2021. 19 сентября 2021 года.
- 2020-06-28
- 3