Азот (Кемерово)
- 1 year ago
- 0
- 0
| 7 |
Азот
|
|
|
|
| 2s 2 2p 3 | |
Азо́т ( химический символ — N , от лат. N itrogenium ) — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы, VA), второго периода периодической системы Д. И. Менделеева , с атомным номером 7.
Как простое вещество (при н. у. ) азот — двухатомный газ (химическая формула — N 2 ) без цвета , вкуса и запаха .
Один из самых распространённых элементов на Земле . Основной компонент воздуха : 78 % объёма.
Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов . Применяется как инертная среда для множества технологических процессов; жидкий азот — хладагент .
Азот — один из основных биогенных элементов , входящих в состав белков и нуклеиновых кислот .
В 1772 году Генри Кавендиш провёл опыт: он многократно пропускал воздух над раскалённым углём, затем обрабатывал его щёлочью , в результате получался остаток, который Кавендиш назвал удушливым (или мефитическим) воздухом. С позиций современной химии ясно, что в реакции с раскалённым углём кислород воздуха связывался в углекислый газ , который затем поглощался щёлочью. При этом остаток газа представлял собой по большей части азот. Таким образом, Кавендиш выделил азот, но не сумел понять, что это новое простое вещество (химический элемент), и описал его как мефитический воздух (от англ. mephitic — «вредный» ). В том же году Кавендиш сообщил об этом опыте Джозефу Пристли :41 .
Интересен тот факт, что он сумел связать азот с кислородом при помощи разрядов электрического тока , а после поглощения оксидов азота в остатке получил небольшое количество газа, абсолютно инертного, хотя, как и в случае с азотом, не смог понять, что выделил новый химический элемент — инертный газ аргон . [ источник не указан 1714 дней ]
Джозеф Пристли в это же время проводил серию экспериментов, в которых также связывал кислород воздуха и удалял полученный углекислый газ, то есть также получал азот, однако, будучи сторонником господствующей в те времена теории флогистона , также неверно истолковал полученные результаты — он решил, что выделил флогистированный (то есть насыщенный флогистоном) воздух :41 .
В сентябре 1772 года шотландский химик Даниэль Резерфорд опубликовал магистерскую диссертацию «О так называемом фиксируемом и мефитическом воздухе», в которой описал азот как вредный, ядовитый воздух и предположил, что это новый химический элемент :41 , а также описал основные свойства азота (не реагирует со щелочами, не поддерживает горения, непригоден для дыхания). Резерфорд также был сторонником флогистонной теории, поэтому также не смог понять, что же он выделил. [ источник не указан 1714 дней ]
В том же году азот выделил шведский химик Карл Шееле : летом 1772 года он получил азот по методу Кавендиша и исследовал его в течение пяти лет, затем опубликовал результаты своих исследований. В этой публикации Шееле первым описал атмосферный воздух как смесь отдельных газов: «огненного воздуха» (кислорода) и «грязного воздуха» (азота). Таким образом, точно установить первооткрывателя азота не представляется возможным :41 .
Название азо́т ( фр. , по наиболее распространённой версии, от др.-греч. «безжизненный»), вместо предыдущих названий ( флогистированный , мефитический и «испорченный» воздух) предложил в 1787 году Антуан Лавуазье , который в то время в составе группы других французских учёных разрабатывал принципы химической номенклатуры , в том же году это предложение опубликовано в труде «Метод химической номенклатуры» :41 . Как показано выше, в то время уже было известно, что азот не поддерживает ни горения, ни дыхания. Это свойство и сочли наиболее важным. Хотя впоследствии выяснилось, что азот, наоборот, крайне необходим для всех живых существ, название сохранилось во французском и русском языках. Окончательно в русском языке этот вариант названия закрепился после выхода в свет книги Германа Гесса «Основания чистой химии» в 1831 году .
Само слово азот (без связи с газом) известно с древности и употреблялось философами и алхимиками средневековья для обозначения «первичной материи металлов», так называемого меркурия у философов, двойного меркурия у алхимиков. «Первичную материю металлов» алхимики считали « альфой и омегой » всего сущего. И слово для её обозначения составили из начальных и конечных букв алфавитов трёх языков, считавшихся священными, — латинского , греческого и древнееврейского : а , альфа , алеф и зет , омега , тав — AAAZOT. Инициатор создания новой химической номенклатуры Гитон де Морво отмечал в своей «Методической энциклопедии» (1785 год) алхимическое значение термина .
Многие современники Лавуазье считали название элемента неудачным, в частности, Жан-Антуан Шапталь предложил название nitrogène («рождающий селитру ») и использовал это название в своей книге «Элементы химии» . Поныне соединения азота называют нитраты , нитриты и нитриды :42 .
Во французском языке название нитроген не прижилось, зато в английском , испанском , венгерском и норвежском используется производное от этого слова. В португальском языке в разговорной речи преимущественно используется как название нитрогениу ( порт.-браз. nitrogênio , европ. порт. nitrogénio ), в научных работах, особенно в Португалии и Макао , преобладает название azoto .
В немецком языке используется название Stickstoff , что означает «удушающее вещество», аналогично в нидерландском и шведском ; схожие по значению названия используются в некоторых славянских языках , например, хорв. и словен. dušik [ˈduʃik] :42 , a также в ивр. חַנְקָן [hanˈkan] .
Название «азот», помимо французского и русского, принято в итальянском , турецком и ряде славянских языков, а также во многих языках народов России и бывшего СССР .
До принятия символа в России, Франции и других странах использовался символ , который можно видеть, например, в статье А. М. Бутлерова об аминах 1864 года :42 .
Природный азот состоит из двух стабильных изотопов 14 N — 99,635 % и 15 N — 0,365 %.
Искусственно получены четырнадцать радиоактивных изотопов азота с массовыми числами от 10 до 13 и от 16 до 25. Все они являются очень короткоживущими изотопами. Самый стабильный из них 13 N имеет период полураспада 10 мин.
Спин ядер стабильных изотопов азота: 14 N — 1; 15 N — 1/2.
Азот — один из самых распространённых элементов на Земле . Вне пределов Земли азот обнаружен в газовых туманностях, солнечной атмосфере, на Уране , Нептуне , в межзвёздном пространстве и других космических объектах. Атмосферы таких планет-спутников как Титан , Тритон и карликовой планеты Плутон в основном состоят из азота. Атмосфера Венеры также содержит значительное количество азота (несмотря на то, что он составляет 3,5 % от общего состава атмосферы), вчетверо превышающее по массе атмосферный азот Земли. Азот — четвёртый по распространённости элемент Солнечной системы (после водорода , гелия и кислорода ).
Азот в форме двухатомных молекул N 2 составляет большую часть атмосферы Земли, где его содержание составляет 75,6 % (по массе) или 78,084 % (по объёму), то есть около 3,87⋅10 15 т.
Содержание азота в земной коре, по данным разных авторов, составляет (0,7—1,5)⋅10 15 т (причём в гумусе — порядка 6⋅10 10 т), а в мантии Земли — 1,3⋅10 16 т. Такое соотношение масс заставляет предположить, что главным источником азота служит верхняя часть мантии, откуда он поступает в другие оболочки Земли с извержениями вулканов .
Масса растворённого в гидросфере азота, учитывая, что одновременно происходят процессы растворения азота атмосферы в воде и выделения его в атмосферу, составляет около 2⋅10 13 т, кроме того, примерно 7⋅10 11 т азота содержатся в гидросфере в виде соединений.
Азот является химическим элементом, необходимым для существования животных и растений, он входит в состав белков (16—18 % по массе), аминокислот , нуклеиновых кислот , нуклеопротеидов , хлорофилла , гемоглобина и др. В составе живых клеток по числу атомов азота около 2 %, по массовой доле — около 2,5 % (четвёртое место после водорода, углерода и кислорода). В связи с этим значительное количество связанного азота содержится в живых организмах, биогенных отложениях литосферы и дисперсном веществе морей и океанов. Это количество оценивается примерно в 1,9⋅10 11 т. В результате процессов гниения и разложения азотсодержащей органики, при условии благоприятных факторов окружающей среды, могут образоваться природные залежи полезных ископаемых, содержащие азот, например, «чилийская селитра » ( нитрат натрия с примесями других соединений), норвежская, индийская селитры.
Химия гидридов азота при давлениях порядка 800 ГПа (около 8 миллионов атмосфер) более разнообразна, чем химия углеводородов при нормальных условиях. Отсюда появилась гипотеза, что азот может быть основой пока неоткрытой жизни на таких планетах, как Уран и Нептун :43 .
Фиксация атмосферного азота в природе происходит по двум основным направлениям: абиогенному и биогенному. Первый путь включает главным образом реакции азота с кислородом. Так как азот химически весьма инертен, для окисления требуются большие количества энергии (высокие температуры). Эти условия достигаются при разрядах молний , когда температура достигает 25 000 °C и более. При этом происходит образование различных оксидов азота . Существует также вероятность, что абиотическая фиксация происходит в результате фотокаталитических реакций на поверхности полупроводников или широкополосных диэлектриков (песок пустынь).
Однако основная часть молекулярного азота (около 1,4⋅10 8 т/год) фиксируется биотическим путём . Долгое время считалось, что связывать молекулярный азот могут только небольшое количество видов микроорганизмов (хотя и широко распространённых на поверхности Земли): бактерии Azotobacter и Clostridium , клубеньковые бактерии бобовых растений Rhizobium , цианобактерии Anabaena , Nostoc и др. Сейчас известно, что этой способностью обладают многие другие организмы в воде и почве, например, актиномицеты в клубеньках ольхи и других деревьев (всего 160 видов). Все они превращают молекулярный азот в соединения аммония (NH 4 + ). Этот процесс требует значительных затрат энергии (для фиксации 1 г атмосферного азота бактерии в клубеньках бобовых расходуют порядка 167,5 кДж, то есть окисляют примерно 10 г глюкозы ). Таким образом, видна взаимная польза от симбиоза растений и азотфиксирующих бактерий — первые предоставляют вторым «место для проживания» и снабжают полученным в результате фотосинтеза «топливом» — глюкозой, вторые обеспечивают необходимый растениям азот в усваиваемой ими форме.
Азот в форме аммиака и соединений аммония, получающийся в процессах биогенной азотфиксации, быстро окисляется до нитратов и нитритов (этот процесс носит название нитрификации ). Последние, не связанные тканями растений (и далее по пищевой цепи травоядными и хищниками), недолго остаются в почве. Большинство нитратов и нитритов хорошо растворимы, поэтому они вымываются водой и в результате попадают в мировой океан (этот поток оценивается в 2,5—8⋅10 7 т/год).
Азот, включённый в ткани растений и животных, после их гибели подвергается аммонификации (разложению содержащих азот сложных соединений с выделением аммиака и ионов аммония) и денитрификации , то есть выделению атомарного азота, а также его оксидов. Эти процессы целиком происходят благодаря деятельности микроорганизмов в аэробных и анаэробных условиях.
В отсутствие деятельности человека процессы связывания азота и нитрификации практически полностью уравновешены противоположными реакциями денитрификации. Часть азота поступает в атмосферу из мантии с извержениями вулканов, часть прочно фиксируется в почвах и глинистых минералах, кроме того, постоянно идёт утечка азота из верхних слоёв атмосферы в межпланетное пространство.
Сам по себе атмосферный азот слишком инертен, чтобы оказывать непосредственное влияние на организм человека и млекопитающих. Тем не менее, при повышенном давлении он вызывает наркоз , опьянение или удушье (при недостатке кислорода); при быстром снижении давления азот вызывает кессонную болезнь .
В лаборатории азот можно получать по реакции разложения нитрита аммония :
Реакция экзотермическая, идёт с выделением 80 ккал (335 кДж) тепла на 1 моль вступившего в неё нитрита, поэтому требуется охлаждение сосуда при её протекании (хотя для начала реакции требуется нагревание нитрита аммония).
Практически эту реакцию выполняют, добавляя по каплям насыщенный раствор нитрита натрия в нагретый насыщенный раствор сульфата аммония, при этом образующийся в результате обменной реакции нитрит аммония мгновенно разлагается.
Выделяющийся при этом газ загрязнён аммиаком , оксидом азота (I) и кислородом , от которых его очищают, последовательно пропуская через растворы серной кислоты , сульфата железа(II) и над раскалённой медью . Затем азот осушают.
Ещё один лабораторный способ получения азота — нагревание смеси дихромата калия и сульфата аммония (в соотношении 2:1 по массе). Реакция описывается уравнениями:
Наиболее чистый азот можно получить разложением азидов металлов:
Так называемый «воздушный», или «атмосферный» азот, то есть смесь азота с благородными газами , получают при помощи реакции воздуха с раскалённым коксом, при этом образуется так называемый « генераторный », или «воздушный», газ — сырьё для химических синтезов и топливо. При необходимости из него можно выделить азот, поглотив монооксид углерода .
Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха. Этим методом можно получить и «атмосферный азот». Также широко применяются азотные установки и станции , в которых используется метод адсорбционного и мембранного газоразделения.
Один из лабораторных способов — пропускание аммиака над оксидом меди(II) при температуре ~700 °C:
Аммиак берут из его насыщенного раствора при нагревании. Количество CuO в 2 раза больше расчётного. Непосредственно перед применением азот очищают от примеси кислорода и аммиака пропусканием над медью и её оксидом (II) (~700 °C), затем сушат концентрированной серной кислотой и сухой щёлочью. Реакция протекает достаточно медленно, но обеспечвает получение азота высокой чистоты.

При нормальных условиях азот — это бесцветный газ, не имеет запаха, малорастворим в воде (2,3 мл/100 г при 0 °C, 1,5 мл/100 г при 20 °C, 1,1 мл/100 г при 40 °C, 0,5 мл/100 г при 80 °C ), плотность 1,2506 кг/м³ (при н. у.).
В жидком состоянии (темп. кипения −195,8 °C) — бесцветная, подвижная, как вода, жидкость. Плотность жидкого азота 808 кг/м³. При контакте с воздухом поглощает из него кислород.
При −209,86 °C азот переходит в твёрдое состояние в виде снегоподобной массы или больших белоснежных кристаллов. При контакте с воздухом поглощает из него кислород, при этом плавится, образуя раствор кислорода в азоте.
Известны три кристаллические модификации твёрдого азота. В интервале 36,61—63,29 К существует фаза β-N 2 с гексагональной плотной упаковкой, пространственная группа P6 3 /mmc , параметры решётки a=3,93 Å и c=6,50 Å. При температуре ниже 36,61 К устойчива фаза α-N 2 с кубической решёткой, имеющая пространственную группу Pa3 или P2 1 3 и период a=5,660 Å. Под давлением более 3500 атмосфер и температуре ниже 83 K образуется гексагональная фаза γ-N 2 .
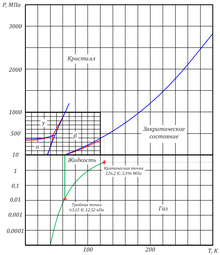
Фазовая диаграмма азота показана на рисунке.
Азот в свободном состоянии существует в форме двухатомных молекул N 2 , электронная конфигурация которых описывается формулой σ s ²σ s *2 π x, y 4 σ z ², что соответствует тройной связи между атомами азота N≡N (длина связи d N≡N = 0,1095 нм). Связь обладает исключительно высокой прочностью: для реакции диссоциации N 2 ↔ 2 N изменение энтальпии составляет Δ H ° 298 = 945 кДж/моль , константа скорости реакции К 298 = 10 −120 , то есть диссоциация молекул азота при нормальных условиях практически не происходит (равновесие практически полностью сдвинуто влево). Молекула азота неполярна и слабо поляризуется, силы взаимодействия между молекулами очень слабые, поэтому в обычных условиях азот газообразен.
Даже при 3000 °C степень термической диссоциации N 2 составляет всего 0,1 %, и лишь при температуре около 5000 °C достигает нескольких процентов (при нормальном давлении). В высоких слоях атмосферы происходит фотохимическая диссоциация молекул N 2 . В лабораторных условиях можно получить атомарный азот, пропуская газообразный N 2 при сильном разрежении через поле высокочастотного электрического разряда. Атомарный азот намного активнее молекулярного: в частности, при обычной температуре он реагирует с серой , фосфором , мышьяком и с рядом металлов , например, со ртутью .
Вследствие большой прочности молекулы азота некоторые его соединения эндотермичны (многие галогениды, азиды, оксиды), то есть энтальпия их образования положительна, а соединения азота термически малоустойчивы и довольно легко разлагаются при нагревании. Именно поэтому азот на Земле находится по большей части в свободном состоянии.
Ввиду своей значительной инертности азот при обычных условиях реагирует только с литием :
при нагревании он реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды :
Наибольшее практическое значение имеет нитрид водорода (аммиак) NH 3 , получаемый взаимодействием водорода с азотом (см. ниже).
Под действием электрического разряда реагирует с кислородом, образуя оксид азота(II) NO :
Описано несколько десятков комплексов с молекулярным азотом.
Соединения азота чрезвычайно широко используются в различных областях химии: производства индустрия удобрений , взрывчатых веществ , красителей , лекарств и многих других продуктов химической промышленности . Хотя колоссальным природным источником азота является атмосферный воздух, инертность азота долгое время служила причиной отсутствия эффективных методов превращения N 2 в другие азотсодержащие соединения; большая часть соединений азота ранее производилась из его минералов, в частности, чилийской селитры. Прогресс в этой области стал возможен после создания технологии получения водорода путем переработки природного газа в синтез-газ . Именно реакция азота и водорода, приводящая к образованию аммиака , обеспечивает большую часть потребностей населения в азотсодержащих соединениях:
Синтез аммиака является экзотермической (тепловой эффект 92 кДж/моль) и обратимой реакцией, протекающей с уменьшением объёма, поэтому для смещения равновесия в сторону образования аммиака в соответствии с принципом Ле Шателье — Брауна необходимо охлаждение смеси и высокие давления. Однако с кинетической точки зрения снижение температуры невыгодно, так как при этом сильно снижается скорость реакции — уже при 700 °C скорость реакции слишком мала для её практического использования.
В таких случаях используется катализ , так как подходящий катализатор позволяет увеличить скорость реакции без смещения равновесия. Наибольшую эффективность по совокупности факторов (каталитическая активность, стойкость к отравлению, стоимость) проявил катализатор на основе металлического железа с добавками оксидов алюминия и калия . Процесс ведут при температуре 400—600 °C и давлениях 10—1000 атмосфер.
При давлениях выше 2000 атмосфер синтез аммиака из смеси водорода и азота идёт с высокой скоростью и без катализатора. Например, при 850 °C и 4500 атмосфер выход продукта составляет 97 %.
Другой метод промышленного связывания атмосферного азота — цианамидный метод — основан на реакции карбида кальция с азотом при 1000 °C:
Реакция экзотермична, её тепловой эффект соствляет 293 кДж/моль.
Ежегодно из атмосферы Земли промышленным путём отбирается примерно 1⋅10 6 т азота.
Степени окисления азота в соединениях −3, −2, −1, 0, +1, +2, +3, +4, +5.
Промышленное применение газообразного азота обусловлено его инертными свойствами. Газообразный азот пожаро- и взрывобезопасен, препятствует окислению, гниению. В нефтедобывающей промышленности газообразный азот применяется для обеспечения безопасного бурения, используется в процессе капитального и текущего ремонта скважин. Кроме того, газообразный азот высокого давления используют в газовых методах повышения нефтеотдачи пласта. В нефтехимии азот применяется для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений. В горнодобывающей промышленности азот используется для создания в шахтах взрывобезопасной среды, для распирания пластов породы, тушения эндогенных пожаров. В производстве электроники и ряде других производств азот применяется для создания бескислородной инертной атмосферы.
Газообразным азотом заполняют камеры шин шасси летательных аппаратов . Кроме того, в последнее время заполнение шин азотом стало популярно и среди автолюбителей, хотя однозначных доказательств эффективности использования азота вместо воздуха для наполнения автомобильных шин нет.
В пищевой промышленности азот зарегистрирован в качестве пищевой добавки E941 , как газовая среда для упаковки и хранения,

Жидкий азот применяется как хладагент и в качестве средства для криотерапии .
Большие количества азота используются в коксовом производстве («сухое тушение кокса») при выгрузке кокса из коксовых батарей, а также для «передавливания» топлива в ракетах из баков в насосы или двигатели.
При комнатной температуре жидкий азот активно испаряется. По этой причине его хранят в специальных сосудах Дьюара с вакуумной изоляцией открытого типа или криогенных ёмкостях под давлением.
Жидкий азот используется в качестве средства пожаротушения: при испарении азот вытесняет из очага возгорания кислород, необходимый для горения, и пожар прекращается. Ввиду инертности азота и простоте его удаления, азотное пожаротушение , наряду с использованием фторированных углеводородов, является самым эффективным способом тушения пожаров с точки зрения сохранения ценностей (таких как элетроника, серверы для хранения данных), подверженных повреждениям при использовании других средств пожаротушения (вода, углекислота и др).
Жидкий азот нередко демонстрируется в кинофильмах в качестве вещества, способного мгновенно заморозить достаточно крупные объекты. При этом заморозка жидким азотом живых существ с возможностью последующей их разморозки — широко распространённое заблуждение. Проблема заключается в невозможности заморозить (и разморозить) существо достаточно быстро, чтобы неоднородность заморозки не сказалась на его жизненных функциях. Это связано в том числе с довольно низкой теплоёмкостью азота.
Станислав Лем в своем научно-фантастическом романе « Фиаско », описал способ экстренной заморозки астронавта жидким азотом.
Выпущенные в России баллоны с азотом, согласно требованиям ПБ 03-576-03, должны быть окрашены в чёрный цвет с коричневой полосой и надписью жёлтого цвета . ГОСТ 26460-85 не требует полосы, но надпись должна содержать сведения о чистоте азота (особой чистоты, высокой чистоты, повышенной чистоты) .
|
|
В разделе
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
В обычных условиях азот не токсичен, однако при повышенном атмосферном давлении способен вызывать азотное отравление . Большинство соединений азота представляют сильную опасность для здоровья. Азот относится ко 3-му классу опасности.