Interested Article - Хлорофилл
- 2020-04-27
- 1
Хлорофи́лл (от греч. χλωρός , «зелёный» и φύλλον , «лист») — зелёный пигмент , окрашивающий хлоропласты растений в зелёный цвет . При его участии происходит фотосинтез . По химическому строению хлорофиллы — магниевые комплексы различных тетрапирролов . Хлорофиллы имеют порфириновое строение и близки гему . Хлорофилл зарегистрирован в качестве пищевой добавки Е140 .
История открытия
В 1817 году Жозеф Бьенеме Каванту и Пьер Жозеф Пеллетье выделили из листьев растений зелёный пигмент, который они назвали хлорофиллом . В 1900-х годах Михаил Цвет и Рихард Вильштеттер независимо друг от друга обнаружили, что хлорофилл состоит из нескольких компонентов. Вильтштеттер очистил и кристаллизовал два компонента хлорофилла, названные им хлорофиллами а и b и установил брутто-формулу хлорофилла а . В 1915 году за исследования хлорофилла ему была вручена Нобелевская премия . В 1940 Ханс Фишер , получивший в 1930 Нобелевскую премию за открытие структуры гема , установил химическую структуру хлорофилла a . Его синтез был впервые осуществлён в 1960 Робертом Вудвордом , а в 1967 была окончательно установлена его стереохимическая структура .
В природе


Хлорофилл присутствует во всех фотосинтезирующих организмах — высших растениях , водорослях , синезелёных водорослях ( цианобактериях ), фотоавтотрофных простейших (протистах) и бактериях .
Некоторые растения, в том числе ряд высших растений, утратили хлорофилл (как, например, петров крест ).
Синтез
Синтезирован Робертом Вудвордом в 1960 году.
Синтез включает в себя 15 реакций, которые можно разделить на 3 этапа. Исходными веществами для синтеза хлорофилла являются глицин и ацетат . На первом этапе образуется аминолевулиновая кислота . На втором этапе происходит синтез одной молекулы протопорфирина из четырёх пиррольных колец. Третий этап представляет собой образование и превращение магнийпорфиринов .
Свойства и функция при фотосинтезе
В процессе фотосинтеза молекула хлорофилла претерпевает изменения, поглощая световую энергию, которая затем используется в фотохимической реакции взаимодействия углекислого газа и воды с образованием органических веществ (как правило, углеводов):
После передачи поглощённой энергии молекула хлорофилла возвращается в исходное состояние.
Хотя максимум непрерывного спектра солнечного излучения расположен в «зелёной» области 550 нм (где находится и максимум чувствительности глаза), поглощается хлорофиллом преимущественно синий , частично — красный свет из солнечного спектра (чем и обуславливается зелёный цвет отражённого света).
Растения могут использовать и свет с теми длинами волн, которые слабо поглощаются хлорофиллом. Энергию фотонов при этом улавливают другие фотосинтетические пигменты, которые затем передают энергию хлорофиллу. Этим объясняется разнообразие окраски растений (и других фотосинтезирующих организмов) и её зависимость от спектрального состава падающего света.
Химическая структура
Хлорофиллы можно рассматривать как производные протопорфирина — порфирина с двумя карбоксильными заместителями (свободными или этерифицированными ). Так, хлорофилл a имеет при С 10 , фитоловый эфир пропионовой кислоты — при С 7 . Удаление магния , легко достигаемое , даёт продукт, известный как феофитин . Гидролиз фитоловой хлорофилла приводит к образованию (хлорофиллид, лишённый атома металла , известен как феофорбид a ).
Все эти соединения интенсивно окрашены и сильно флуоресцируют , исключая те случаи, когда они растворены в органических растворителях в строго безводных условиях. Они имеют характерные спектры поглощения , пригодные для качественного и количественного определения состава пигментов. Для этой же цели часто используются также данные о растворимости этих соединений в соляной кислоте , в частности для определения наличия или отсутствия этерифицированных спиртов. определяется как концентрация HCl (%, масс./об.), при которой из равного объёма эфирного раствора пигмента экстрагируется 2 / 3 общего количества пигмента. «Фазовый тест» — окрашивание зоны раздела фаз — проводят, подслаивая под эфирный раствор хлорофилла равный объём 30%-го раствора гидроксида калия в метаноле . В интерфазе должно образовываться окрашенное кольцо. С помощью тонкослойной хроматографии можно быстро определять хлорофиллы в сырых экстрактах.
Хлорофиллы неустойчивы на свету; они могут окисляться до алломерных хлорофиллов на воздухе в метанольном или этанольном растворе.
Хлорофиллы образуют комплексы с белками in vivo и могут быть выделены в таком виде. В составе комплексов их спектры поглощения значительно отличаются от спектров свободных хлорофиллов в органических растворителях.
Хлорофиллы можно получить в виде кристаллов . Добавление H 2 O или Ca 2+ к органическому растворителю способствует кристаллизации .
| Хлорофилл a | Хлорофилл b | Хлорофилл c1 | Хлорофилл c2 | Хлорофилл d | Хлорофилл f | |
|---|---|---|---|---|---|---|
| Формула | C 55 H 72 O 5 N 4 Mg | C 55 H 70 O 6 N 4 Mg | C 35 H 30 O 5 N 4 Mg | C 35 H 28 O 5 N 4 Mg | C 54 H 70 O 6 N 4 Mg | C 55 H 70 O 6 N 4 Mg |
| группа C2 | -CH 3 | -CH 3 | -CH 3 | -CH 3 | -CH 3 | -CHO |
| группа C3 | -CH=CH 2 | -CH=CH 2 | -CH=CH 2 | -CH=CH 2 | -CHO | -CH=CH 2 |
| группа C7 | -CH 3 | -CHO | -CH 3 | -CH 3 | -CH 3 | -CH 3 |
| группа C8 | -CH 2 CH 3 | -CH 2 CH 3 | -CH 2 CH 3 | -CH=CH 2 | -CH 2 CH 3 | -CH 2 CH 3 |
| группа C17 | -CH 2 CH 2 COO-Phytyl | -CH 2 CH 2 COO-Phytyl | -CH=CHCOOH | -CH=CHCOOH | -CH 2 CH 2 COO-Phytyl | -CH 2 CH 2 COO-Phytyl |
| связь C17-C18 | Одинарная | Одинарная | Двойная | Двойная | Одинарная | Одинарная |
| Распространение | Везде | Большинство наземных растений | Некоторые водоросли | Некоторые водоросли | Цианобактерии | Цианобактерии |
-
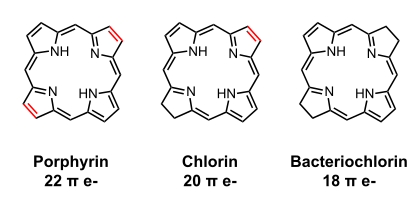
 Общая структура хлорофилла a , b и d
Общая структура хлорофилла a , b и d -
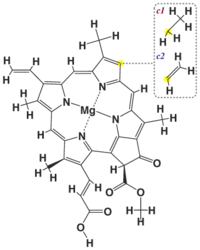
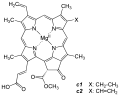 Структура хлорофилла c1, c2
Структура хлорофилла c1, c2 -
 Структура хлорофилла f
Структура хлорофилла f -
 Оптический спектр поглощения хлорофиллов a ( голубой ) и b ( красный )
Оптический спектр поглощения хлорофиллов a ( голубой ) и b ( красный ) -
 Хроматограмма зелёного пигмента растений
Хроматограмма зелёного пигмента растений
Применение
Хлорофилл находит применение в пищевой промышленности как пищевая добавка (регистрационный номер в европейском реестре E140 ), однако при хранении в этанольном растворе, особенно в кислой среде, неустойчив, приобретает грязно-коричнево-зеленый оттенок, и не может использоваться как натуральный краситель. Нерастворимость нативного хлорофилла в воде также ограничивает его применение в качестве натурального пищевого красителя. Но хлорофилл вполне успешно используется в качестве натуральной замены синтетических красителей при изготовлении кондитерских изделий [ источник не указан 4337 дней ] .
Производное хлорофилла — хлофиллин медный комплекс (тринатриевая соль) получил распространение в качестве пищевого красителя (Регистрационный номер в европейском реестре E141). В отличие от нативного хлорофилла, медный комплекс устойчив в кислой среде, сохраняет изумрудно-зелёный цвет при длительном хранении и растворим в воде и водно-спиртовых растворах. Американская (USP) и Европейская (EP) фармакопеи относят хлорофиллид меди к пищевым красителям , однако вводят лимит на концентрацию свободной и связанной меди (тяжёлый металл).
-
 Хлорофилл придаёт листьям зелёный цвет и поглощает свет при фотосинтезе
Хлорофилл придаёт листьям зелёный цвет и поглощает свет при фотосинтезе -
 В клетках эукариотов хлорофилл обычно находится в хлоропластах
В клетках эукариотов хлорофилл обычно находится в хлоропластах -
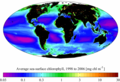 Карта распределения хлорофилла по поверхности мирового океана в период с 1998 по 2006 по данным спутникового прибора SeaWiFS
Карта распределения хлорофилла по поверхности мирового океана в период с 1998 по 2006 по данным спутникового прибора SeaWiFS
Безопасность
Объединённый экспертный комитет ФАО/ВОЗ по пищевым добавкам (JECFA) в 1969, 1975 и 1985 годах исследовал токсичность хлорофилла для его использования в качестве пищевой добавки . По итогам проведённых исследований, не удалось установить допустимое суточное потребление (ДСП), поскольку вещество не проявляло негативные эффекты даже в высоких дозировках . В 2015 году Европейское агентство по безопасности продуктов питания (EFSA) провело переоценку хлорофилла и пришло к выводу, что нет никаких оснований полагать, что хлорофилл представляет какую-либо опасность .
Примечания
- Pelletier and Caventou (1817) «Notice sur la matière verte des feuilles» («Замечания о зелёном материале листьев»), Journal de Pharmacie , 3 : 486—491.
- M. Tswett (1906) Physikalisch-chemische Studien über das Chlorophyll. Die Adsorptionen. (Физико-химические исследования хлорофилла. Адсорбция.) Ber. Dtsch. Botan. Ges. 24 , 316—323 .
- R. B. Woodward, W. A. Ayer, J. M. Beaton, F. Bickelhaupt, R. Bonnett. (англ.) // Journal of the American Chemical Society. — 1960. — Vol. 82 , iss. 14 . — P. 3800–3802 . — doi : .
- Ian Fleming. (англ.) // Nature. — 1967-10-14. — Vol. 216 , iss. 5111 . — P. 151–152 . — doi : .
- ↑ World Health Organization. // Joint FAO/WHO Expert Committee on Food Additives. 28 декабря 2022 года.
- (англ.) . European Food Safety Authority (7 мая 2015). Дата обращения: 13 октября 2022. 13 октября 2022 года.
Ссылки
- Монтеверде Н. А., Любименко В. Н. // Известия Императорской Академии наук. VII серия. — СПб. , 1913. — Т. VII , № 17 . — С. 1007–1028 .
- Speer, Brian R. (1997). на сайте . University of California, Berkeley Museum of Paleontology. Verified availability August 4, 2005. (англ.)
- (англ.)
- Билич Г. Л., Крыжановский В. А. Биология. Полный курс: В 4 т. — издание 5-е, дополненное и переработанное. — М.: Издательство Оникс, 2009. — Т. 1. — 864 с. — ISBN 978-5-488-02311-6
- 2020-04-27
- 1
![{\displaystyle {\ce {xCO2 + xH2O ->[{\ce {h\nu}}] (CH2O)_x + xO2}}}](/images/004/933/4933336/6.jpg?rand=527091)