Ольдекоп, Евстафий Иванович
- 1 year ago
- 0
- 0
|
Глутаминсинтетаза,
каталитический домен |
|
|---|---|
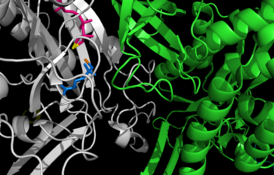
![12-субъединичный фермент глутаминсинтетаза из Salmonella typhimurium.[2]](/images/004/960/4960970/2.jpg?rand=286773)
12-субъединичный фермент глутаминсинтетаза из Salmonella typhimurium . |
|
| Идентификаторы | |
| Символ | Gln-synt_C |
| Pfam | |
| Pfam clan | |
| Доступные структуры белков | |
| Pfam | |
| PDB | ; ; |
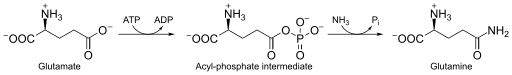
Глутаминсинтетаза , также L-глутамат-аммиак лигаза (сокр. ГС ) — фермент (КФ ) из класса синтетаз (лигаз), принимает участие в обезвреживании свободного аммиака в тканях. Данный фермент катализирует в присутствии двухвалентных ионов (Mg 2+ или Mn 2+ ) реакцию образования аминокислоты L-глутамина , посредством присоединения к L-глутамату молекул аммиака NH 3 ( in vivo свободный аммиак ионизирован и представляет собой катион аммония — NH 4 + ), с использованием энергии гидролиза макроэргических связей АТФ . Реакция имеет следующий вид:
L-глутамат + ATФ + NH 3 → L-глутамин + АДФ + Ф i .
Глутаминсинтетаза использует в качестве субстрата аммиак (точнее ионы аммония), образующийся в результате восстановления нитратов , расщепления аминокислот и фотодыхания (у растений). Амидная группа глутамата является источником азота для синтеза метаболитов глутаминового пути (например, для синтеза пиримидиновых азотистых оснований).
Конкуренция между ионом аммония и водой, их сродство к связыванию и концентрация иона аммония влияют на синтез глутамина и его гидролиз. Глутамин образуется, если ион аммония атакует ацилфосфатный промежуточный продукт, в то же время, если вода атакует молекулы интермедиата, то происходит образование глутамата . Ион аммония связывается с ГС сильнее, чем вода, из-за электростатических сил между катионом и отрицательно заряженным карманом . Другая возможная реакция заключается в том, что при связывании гидроксиламина NH 2 OH с ГС, а не с ионом NH 4 + , образуется γ-глутамилгидроксамат .
Глутаминсинтетаза широко распространена в живых организмах и встречается как у прокариот , так и у эукариот . Прокариотические типы глутаминсинтетазы локализованы в цитозоле клеток, в то же время эукариотические типы фермента могут располагаться как в цитозоле, так и в органеллах (в митохондриях или хлоропластах). Несмотря на то, что данный фермент обнаружен в матриксе митохондрий , ГС — не является митохондриальным белком, он транслоцируется в матрикс обычно из цитозоля .
У человека ГС кодируется геном — , который локализован на q-плече 1-ой хромосомы . Длина полипептидной цепи белка составляет 373 аминокислотных остатков, его молекулярная масса — 42064 Да . Белок имеет 2 домена : первый домен — некаталитический (β-grasp), включает аминокислоты 24-106, второй — каталитический, включает в себя аминокислоты 113-373.
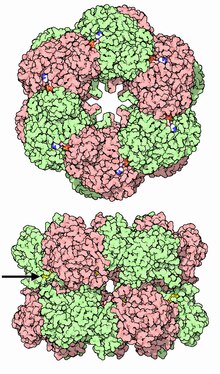
Глутаминсинтетаза представляет собой олигомерный белок и может состоять из 8, 10 или 12 идентичных субъединиц, разделённых на два обращённых друг к другу кольца . Бактериальные ГС представляют собой додекамеры (12-меры) с 12 активными центрами между каждым мономером . Каждый активный сайт создаёт «туннель», который является местом расположения трёх различных сайтов связывания субстрата: нуклеотида, иона аммония (NH 4 + ) и аминокислоты . Молекулы АТФ связываются с верхушкой двойной воронки, которая открывается на внешнюю поверхность ГС. Глутамат связывается в нижней части активного сайта . В середине двойной воронки имеются два места связывания двухвалентных катионов (Mn +2 или Mg +2 ). Один сайт связывания катионов участвует в фосфорильном переносе АТФ на глутамат, а второй стабилизирует активность ГС и помогает связыванию глутамата .
Два кольца ГС удерживаются вместе за счёт водородных связей и гидрофобных взаимодействий . В своей последовательности каждая субъединица имеет С-конец и N-конец. С-конец (спиральный ремешок) стабилизирует структуру глутаминсинтетазы, встраиваясь в гидрофобную область субъединицы поперёк другого кольца. N-конец подвергается воздействию растворителя. Кроме того, центральный канал формируется за счёт шести четырёхцепочечных β-листов , состоящих из антипараллельных петель двенадцати субъединиц .
Фермент катализирует АТФ-зависимую конденсацию глутамата с аммиаком с образованием глутамина . Гидролиз молекул АТФ запускает первый этап двухступенчатого согласованного механизма . АТФ фосфорилирует глутамат с образованием АДФ и промежуточного ацилфосфата — γ-глутамилфосфата, который реагирует с аммиаком, образуя глутамин и неорганический фосфат . АДФ и Ф i не диссоциируют до тех пор, пока происходит связывания аммиака и не высвобождается глутамин .
АТФ сначала связывается с верхней частью активного сайта, расположенного рядом с сайтом связывания катионов, тогда как глутамат связывается со вторым сайтом связывания катионов в нижней части активного сайта . Присутствие молекул АДФ вызывает конформационный сдвиг в молекуле фермента, который стабилизирует фрагмент γ-глутамилфосфата. Аммоний прочно связывается с ГС только в том случае, если присутствует промежуточный ацилфосфат. Аммоний, а не аммиак, связывается с ГС, поскольку сайт связывания полярен и подвергается воздействию растворителя . На втором этапе депротонирование аммония позволяет аммиаку атаковать интермедиат из близлежащего участка с образованием глутамина . Фосфат (Ф i ) уходит через верхнюю часть активного центра, а глутамин — через нижнюю часть (между двумя кольцами) .
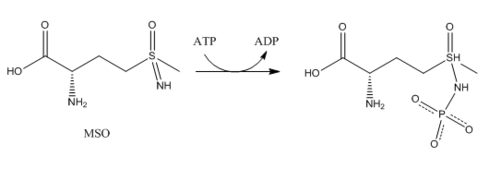
ГС локализована преимущественно в головном мозге , почках и печени . Глутаминсинтетаза в головном мозге участвует в метаболической регуляции глутамата, детоксикации аммиака (который очень токсичен для ЦНС), ассимиляции аммиака, рециклизации нейротрансмиттеров и прекращении сигналов нейромедиаторов . ГС в головном мозге обнаруживается преимущественно в астроцитах . Астроциты защищают нейроны от эксайтотоксичности , поглощая избыток аммиака и глутамата. В гипераммониемической среде (высокие концентрации аммиака) возникает отёк астроглии . К проблеме набухания астроглии подошли с разных точек зрения. Одно исследование показывает, что происходят морфологические изменения, которые увеличивают экспрессию ГС в глутаматергических областях или другие адаптации, которые снижают высокие уровни глутамата и аммиака . Другая точка зрения заключается в том, что набухание астроцитов происходит из-за накопления глутамина. Чтобы предотвратить повышение уровня коркового глутамата и содержания кортикальной воды, было проведено исследование по предотвращению активности ГС у крыс с помощью ингибитора — (MSO) .
По-видимому, существует три различных класса ГС:
Растения имеют два или более изофермента GSII, один из изоферментов транслоцируется в хлоропласт . Другая форма — цитозольная. Цитозольная трансляция гена GS регулируется его 5'-нетранслируемой областью (5'-UTR), в то время как его 3'-UTR играет роль в смене транскриптов .
Хотя три класса глутаминсинтетаз явно структурно связаны, их сходство последовательностей не столь велико.
ГС подвержена обратимой ковалентной модификации. Аминокислотный остаток тирозина Tyr-397 из всех 12 субъединиц может подвергаться аденилированию или деаденилированию аденилаттрансферазой (AT), бифункциональным регуляторным ферментом . Аденилирование — это посттрансляционная модификация белка, включающая ковалентное присоединение молекул АМФ к боковой цепи белка. Для каждого аденилирования требуется молекула АТФ, а для полного ингибирования ГС требуется 12 АТФ. Деаденилирование с помощью АТ включает фосфоролитическое удаление Tyr-связанных аденилильных групп в виде молекул АДФ. На активность АТ влияет связанный с ней регуляторный белок: P II , тример с молекулярной массой 44 кДа . P II также подвергается посттрансляционной модификации уридилилтрансферазой, поэтому P II имеет две формы. Состояние белка P II влияет на активность аденилаттрансферазы. Если P II не уридилирован, то он примет форму P IIA . Комплекс AT:P IIA деактивирует ГС путём аденилирования. Если молекулы P II уридилированы, то они примут форму P IID . Комплекс AT:P IID активирует ГС путём деаденилирования . Комплексы AT:P IIA и AT:P IID реципрокно (взаимно) аллостерически регулируются α-кетоглутаратом (α-KG) и глутамином (Gln). Gln активирует активность AT:P IIA и ингибирует AT:P IID , что приводит к аденилированию и последующей дезактивации ГС. Более того, Gln выступает за преобразование P IID в P IIA . Эффекты α-KG на комплексы противоположны . У большинства грамотрицательных бактерий глутаминсинтетаза может модифицироваться путём аденилирования (некоторые цианобактерии и зелёные водоросли или исключения) .
Ингибирование ГС в основном сосредоточено на связывании сайтов амино лигандов . Другие ингибиторы являются результатом метаболизма глутамина: триптофан , гистидин , карбамоилфосфат , глюкозамин-6-фосфат, цитидинтрифосфат (ЦТФ) и аденозинмонофосфат (АМФ) . Другими ингибиторами/регуляторами являются аминокислоты глицин и аланин. Аланин, глицин и серин связываются с участком глутаматного субстрата. ГДФ, АМФ, АДФ связываются с сайтом АТФ . L-серин , L-аланин и глицин связываются с сайтом L-глутамата в неаденилированной глутаминсинтетазе. Четыре аминокислоты связываются с этим участком своими общими атомами, “главной цепью” аминокислот . Глутамат — ещё один продукт метаболизма глутамина; однако глутамат является субстратом для ингибирования ГС, который действует как регулятор ГС. Каждый ингибитор может снижать активность фермента; как только все конечные метаболиты глутамина связываются с ферментом, его активность почти полностью ингибируется . Множество ингибирующих входных сигналов позволяет осуществлять тонкую регуляцию ГС, отражая уровень азота в организме.
Регуляция обратной связи определяет разницу между двумя эукариотическими типами ГС: мозговым типом (ткани мозга) и немозговым (все остальные ткани). Немозговой тип ГС реагирует на подавление обратной связи конечным продуктом, в то время как мозговой тип ГС этого не делает . Высокие концентрации глутамин-зависимых метаболитов должны подавлять активность ГС, в то время как низкие концентрации должны активировать активность ГС.
Ингибиторы:
Исследования на E. coli показали, что глутаминсинтетаза регулируется посредством экспрессии генов. Ген, кодирующий субъединицу ГС, обозначается glnA . Транскрипция glnA зависит от NR I ( специфического усилителя транскрипции ). Активная транскрипция происходит, если NR I находится в своей фосфорилированной форме, обозначаемой NR I -P. Фосфорилирование NR I катализируется NR II , протеинкиназой. Если NR II образует комплекс с P IIA , то он будет функционировать как фосфатаза, и NR I -P преобразуется обратно в NR I . В этом случае транскрипция glnA прекращается .
ГС подчиняется совершенно иным регуляторным механизмам у цианобактерий . Вместо обычной двухкомпонентной системы NtrC-NtrB , цианобактерии содержат регулятор транскрипции NtcA, который ограничен этой кладой и контролирует экспрессию ГС и множества генов, участвующих в метаболизме азота . Более того, глутаминсинтетазы у цианобактерий ковалентно не модифицируется чтобы повысить чувствительность к ингибированию по принципу обратной связи . Вместо этого, ГС у цианобактерий ингибируются небольшими белками, которые называются ГС-инактивирующими факторами (IFs), транскрипция которых отрицательно регулируется NtcA . Кроме того, эти инактивирующие факторы регулируются различными некодирующими РНК : sRNA NsiR4 взаимодействует с 5'-UTR мРНК фактора инактивации ГС IF7 (мРНК gifA ) и снижает его экспрессию. Экспрессия NsiR4 находится под положительным контролем транскрипционного фактора, отвечающего за регуляцию азота, NtcA . Кроме того, экспрессия фактора, инактивирующего ГС, IF17 контролируется глутамин-связывающим рибопереключателем .
{{
cite journal
}}
: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (
ссылка
)