Хафтор Бьёрнссон
- 1 year ago
- 0
- 0
| 9 |
Фтор
|
|
|
|
| 2s 2 2p 5 | |
Фто́р ( химический символ — F , устар. «флюор»; от лат. F luorum ) — химический элемент 17-й группы (по устаревшей классификации — главной подгруппы седьмой группы, VIIA) второго периода периодической системы химических элементов Д. И. Менделеева , с атомным номером 9.
Является самым химически активным неметаллом и сильнейшим окислителем. Фтор относится к группе галогенов и является самым лёгким элементом из этой группы.
Как простое вещество (при нормальных условиях ) фтор — это двухатомный газ (формула — F 2 ) бледно-жёлтого цвета с резким запахом , напоминающим озон или хлор . При криогенных температурах представляет собой жёлтую жидкость, бесцветный газ (в толстых слоях — зеленовато-жёлтый, н. у. ).
Чрезвычайно токсичен . Обладает исключительно высокой коррозионной активностью.
Первое соединение фтора — флюорит (плавиковый шпат) Ca F 2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту . При обработке минерала флюорита CaF 2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 году Андре Ампер , его поддержал Гемфри Дэви . Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году , а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода , содержащего примесь кислого фторида калия KHF 2 .
Название «фтор» (от др.-греч. φθόριος 'разрушительный'), предложенное Андре Ампером в 1816 году , употребляется в русском, греческом и некоторых других языках. Во многих же других странах приняты названия, производные от старинных названий минерала флюорита CaF 2 , которые в свою очередь происходят от его способности понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть ( лат. fluere 'течь'): например, тот же Ампер в письме Дэви от 6 августа 1812 предложил слово fluorine, благодаря адресату письма прочно вошедшее в английский язык .
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание, % |
|---|---|
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значительные скопления фтора содержатся, в основном, в минерале флюорите (CaF 2 ), содержащем по массе 51,3% Ca и 48,7 % F. Кларк в земной коре 650 г/т.
Из растений относительно богаты фтором чечевица и лук .
В почве фтор накапливается в результате вулканической деятельности, в составе вулканических газов обычно содержится большое количество фтороводорода .
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и сильно ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C) . Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать , в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1) .
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета .
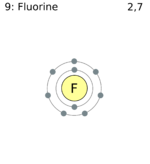
Электронная конфигурация атома фтора: 1s 2 2s 2 2p 5 .
Атомы фтора в соединениях могут проявлять степень окисления , равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2 P 3/2 .

С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.

Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
Фазовый переход между этими кристаллическими фазами фтора более экзотермичен, чем затвердевание жидкого фтора. Фаза ромбической сингонии у твёрдого фтора не обнаружена, в отличие от всех прочих галогенов. Молекулы α -фтора разупорядочены по направлению. Длина связи F—F в молекулах составляет 0,1404(12) нм .
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву .
Фтор является моноизотопным элементом: в природе существует только один стабильный изотоп фтора 19 F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31 и один ядерный изомер — 18m F. Самым долгоживущим из радиоактивных изотопов фтора является 18 F с периодом полураспада 109,771 минуты, важный источник позитронов , использующийся в позитрон-эмиссионной томографии .
| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17 F | 17,0020952 | 64,5 c | β + -распад в | 5/2 | 4,722 |
| 18 F | 18,000938 | 1,83 часа | β + -распад в 18 O | 1 | |
| 19 F | 18,99840322 | Стабилен | — | 1/2 | 2,629 |
| 20 F | 19,9999813 | 11 c | β − -распад в 20 Ne | 2 | 2,094 |
| 21 F | 20,999949 | 4,2 c | β − -распад в 21 Ne | 5/2 | |
| 22 F | 22,00300 | 4,23 c | β − -распад в 22 Ne | 4 | |
| 23 F | 23,00357 | 2,2 c | β − -распад в 23 Ne | 5/2 |
Ядра изотопа 19 F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР -исследований молекул. Спектры ЯМР- 19 F являются достаточно характеристичными для фторорганических соединений.
Самый активный неметалл , бурно взаимодействует почти со всеми веществами (кроме фторидов в высших степенях окисления и редких исключений — фторопластов ) и с большинством из них — с горением и взрывом.
Образует соединения со всеми химическими элементами, кроме гелия и неона . Известно лишь два соединения с аргоном , существующих только при температуре ниже температуры кипения водорода, и только одно из них содержит фтор — гидрофторид аргона HArF .
К воздействию фтора при комнатной температуре устойчивы некоторые металлы (в компактном виде) за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Fe, Ni; однако эти же металлы в виде мелкого порошка бурно реагируют даже с жидким фтором . Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 °C ), в магниевых сосудах для начала реакции нужен небольшой нагрев.
Не реагирует с гелием, неоном, аргоном, азотом , кислородом , тетрафторметаном . При комнатной температуре не реагирует с сухим сульфатом калия , углекислым газом и закисью азота . Без примеси фтороводорода при комнатной температуре не действует на стекло.
В атмосфере фтора горит даже вода и платина .
Фтор способен вытеснять другие галогены из своей группы из их солей:
Реакция между щелочами и фтором:
Продукты реакции фтора с водой, в зависимости от условий её протекания, могут различаться:
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
Фтор также способен окислять в электрическом разряде кислород , образуя дифторид кислорода OF 2 и диоксидифторид O 2 F 2 . Под давлением или при облучении ультрафиолетом реагирует с криптоном и ксеноном с образованием фторидов благородных газов.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора .
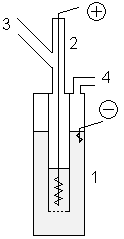
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития ), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом .
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе ( монель-металл ), из меди , алюминия и его сплавов, латуни , нержавеющей стали (это возможно, потому что эти металлы и сплавы покрываются плёнкой фторидов, которая защищает от дальнейшей реакции со фтором ).
Фтор используется для получения:
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах . Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих видов ракетного топлива. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Фторированные углеводороды (например перфтордекалин ) применяются в медицине как кровезаменители. Существует множество медицинских препаратов, содержащих фтор в структуре ( фторотан , фторурацил , флуоксетин , галоперидол и др.). Фториды натрия, калия и др. в строго дозированных микроколичествах применяются для профилактики кариеса (см. ниже).
Фтор является жизненно необходимым для организма элементом . Основным источником поступления фтора в организм человека является питьевая вода . В организме человека преобладающая концентрация фтора содержится в эмали зубов в составе — Ca 5 F(PO 4 ) 3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г . Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг . При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес, пародонтоз , флюороз (крапчатость эмали) и остеосаркома . Также избыточное потребление фтора может приводить к поражениям костной системы .
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова), употреблять фторированную воду (до концентрации 1 мг/л) или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 % .
Предельно допустимая концентрация связанного фтора (в виде фторидов и фторорганических соединений) в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.



Фтор представляет собой чрезвычайно агрессивное химическое вещество. Сильно ядовит, является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у фтороводорода . Фтор — «судорожный яд», как и значительное число его соединений. Обладает кумулятивным действием. В организм проникает главным образом ингаляционным и пероральным путями. Характерные проявления интоксикации при ингаляционном воздействии сводятся к болезненности и жжению в области носа, глотки, за грудиной, кровотечению из носа, сухому кашлю. Возможен спазм гортани и бронхиальной мускулатуры. При осмотре обнаруживаются гиперемия, отёчность и некрозы слизистых оболочек носоглотки, изъязвления и даже прободения носовой перегородки. Слизистые дыхательных путей также некротизируются и покрываются жёлтыми корочками.
При лёгких ингаляционных отравлениях фтором и его соединениями, как правило, ограничиваются развитием ринофаринголарингита и трахеобронхита на фоне общей слабости, утомляемости, лабильности пульса и АД. — отравление «маскируется» под «простуду», что затрудняет своевременную диагностику и лечение.
При поражениях фтором и его соединениями средней тяжести диагностируются глубокие бронхиты, и, с задержкой, пневмонии; а также судороги и гепатиты.
В случае тяжёлых отравлений развиваются поражение тканей и токсический отёк лёгких, коматозное состояние, судороги.
Резорбтивное действие объясняется возможностью фтора вступать в свободно-радикальные реакции с тканями организма — осаждение кальция из сыворотки крови и тканевой жидкости в форме фторида, приводящие к глубоким нарушениям в обмене веществ, замедлению свёртываемости крови, нарушению кислотно-основного соотношения крови, нарушению нервно-мышечной проводимости, увеличению проницаемости сосудистых стенок. Кроме того, фтор нарушает функционирование ряда ферментных систем, взаимодействуя с магнием, марганцем, железом, цинком, входящих, как и кальция, в состав энзимов, являясь их активаторами или ингибиторами. Отравления фтором нарушает активность ферментов, использующих микроэлементы в качестве кофакторов, например снижается активность Энолазы (нарушение гликолиза и синтеза макроэргов), аденозинтрифосфатазы, глутаминсинтетазы.
Ожоги глаз и кожных покровов наблюдаются при непосредственном контакте с фтором. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15-0,30 мг/л приводит к раздражению открытых участков кожи. При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены конъюнктивиты или .
Фтор депонируется в костях и медленно, в течение нескольких лет, выводится из организма почками и кишечником.