Interested Article - Кумасси
- 2020-04-05
- 1
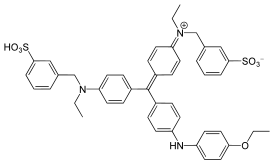
Coomassie Brilliant Blue (кумасси бриллиантовый синий) — название двух близких трифенилметановых красителей, разработанных для текстильной индустрии, но в настоящее время широко используемых в аналитической биохимии для окраски белков. Coomassie Brilliant Blue G-250 отличается от R-250 наличием двух метильных групп. Название «Coomassie» — зарегистрированный товарный знак Imperial Chemical Industries .
Название и история открытия
Название Кумасси было зарегистрировано в конце 19 века в качестве торговой марки компанией Blackley, для красителей шерсти. В 1896 году в ходе Четвертой Англо-ашантийской войны , войска Великобритании заняли город Coomassie (в настоящее время Кумаси в Гане ). В 1918 году компания Levinstein Ltd, владелец торговой марки Кумасси, стала частью компании British Dyestuffs, которая в 1926 году была поглощена компанией Imperial Chemical Industries. В настоящее время компания Imperial Chemical Industries не производит красителей, но остается владельцем торговой марки Coomassie .
Синие красители на основе сернистных производных трифенилметана были впервые получены в 1913 году Максом Вейлером, который работал в городе Вупперталь (Германия).
Статьи в биохимических журналах часто не расшифровывают, какой именно краситель «Coomassie» был использован. Перечень цветов содержит более 40 красителей, содержащих термин «Coomassie» в названии. Синий краситель кумасси из перечня (10th edition) — Coomassie Blue RL (Acid Blue 92, C.I. 13390) имеет совершенно иную структуру.
Цвет красителя

Суффикс «R» в названии красителя Coomassie Brilliant Blue R-250 является аббревиатурой от слова Red (красный), так как синий цвет красителя имеет слабый красноватый оттенок. Вариант красителя с суффиксом «G» имеет слабый зеленоватый оттенок. Цифры «250» обозначали чистоту красителя.
Цвет красителей зависит от кислотности среды. Краситель «G» подробно изучен. При pH ниже 0 краситель имеет красную окраску и максимум поглощения на длине 470 нм. При pH около 1 краситель зеленый и максимум поглощения составляет 620 нм. При рН выше 2 краситель ярко-синий, максимум поглощения на 595. При pH 7 краситель имеет коэффициент 43,000 M −1 см −1 .
Изменение окраски раствора соответствует изменению заряда молекулы красителя. В красной форме три атома азота заряжены положительно. Два остатка серной кислоты имеют очень низкий p K a и потому обычно заряжены отрицательно, поэтому при pH близких к нулю, краситель представляет собой катион с суммарным зарядом +1. Зеленый цвет соответствует незаряженной молекуле. При pH 7 лишь атом азота в составе дифениламина имеет положительный заряд, поэтому молекула в целом является анионом с суммарным зарядом −1. Значения p K a , необходимые для потери двух протонов составляют 1,15 и 1,82. Последний протон отрывается в щелочной среде, при этом молекула приобретает розовую окраску (p K a 12,4).
Красители образуют комплекс с анионными детергентами, например, с лаурилсульфатом натрия . Образование такого комплекса стабилизирует зеленый цвет нейтральной формы красителя. Этот эффект может оказывать влияние на определение концентрации при помощи метода Бредфорда . Вероятно, анионные детергенты конкурируют с красителем за связывание с белком.
Использование в биохимии

Coomassie Brilliant Blue R-250 был использован для окрашивания белков в 1964 году . Образцы белков были разделены электрофорезом на листе ацетата целлюлозы . Лист помещали в сульфосалициловую кислоту для фиксации белков и затем переносили в раствор красителя.
В 1965 году Coomassie Brilliant Blue R-250 был использован для окрашивания белков после электрофоретического разделения в полиакриламидном геле . Гель помещали в раствор красителя, содержащий метанол, уксусную кислоту и воду. После окрашивания белков полиакриамидный гель (ПААГ) должен был быть отмыт электрофоретически. Далее было показано, что гель может быть отмыт раствором уксусной кислоты.
Краситель «G» был впервые использован для визуализации белков в полиакриламидном геле в 1967 году , при этом краситель растворяли в растворе уксусной кислоты с метанолом .
Позднее было показано, что белковые полосы могут быть окрашены без коллоидного красителя «G», в растворе трихлоруксусной кислоты без метанола. Использование этого протокола не требует отмывания геля .
Современные протоколы используют коллоидную форму красителя «G» в растворе, содержащем фосфорную кислоту, этанол (или метанол) и сульфат аммония .
Метод Бредфорда использует спектральные свойства Coomassie Brilliant Blue G-250 для определения количества белка в растворе . Для этого к образцу белка добавляют раствор красителя в фосфорной кислоте и этаноле. В кислых условиях краска имеет коричневый цвет, но при связывании с белком становится синей. Оптическое поглощение раствора измеряют на длине волны 595 нм.
Связывание белка с отрицательно заряженным Coomassie Brilliant Blue G-250 придаёт белку отрицательный заряд, что может быть использовано при разделении смесей белков в ПААГ в неденатурирующих условиях при помощи метода .
Подвижность комплекса в полиакриламидном геле зависит от размера белка, белкового комплекса, а также количества красителя, связываемого белком.
См. также
Примечания
- Fox, M. R. Dye-makers of Great Britain 1856-1976 : A History of Chemists, Companies, Products and Changes (англ.) . — Manchester: Imperial Chemical Industries, 1987. — P. 38.
- Fox, M. R. Dye-makers of Great Britain 1856-1976 : A History of Chemists, Companies, Products and Changes (англ.) . — Manchester: Imperial Chemical Industries, 1987. — P. 259.
- (неопр.) . — 3rd. — Bradford: Society of Dyers and Colourists, 1971. — Т. 4. — С. 4397—4398. 19 июля 2011 года. . Дата обращения: 27 мая 2013. Архивировано 19 июля 2011 года.
- , "Procédé de production de colorants de la série du triarylméthane", , issued 1915-02-16
- Weiler, Max, "Blue Triphenylmethane Dye", , issued 1917-03-06
- , "Manufacture of Triarylmethane-dyestuffs", , issued 1927-11-03
- ↑ Chial, H. J.; Thompson, H. B.; Splittgerber, A. G. A spectral study of the charge forms of Coomassie Blue G (англ.) // : journal. — 1993. — Vol. 209 , no. 2 . — P. 258—266 . — doi : . — .
- Compton, S. J.; Jones, C. G. Mechanism of dye response and interference in the Bradford protein assay (англ.) // : journal. — 1985. — Vol. 151 , no. 2 . — P. 369—374 . — doi : . — .
- Fazekas de St. Groth, S.; Webster, R. G.; Datyner, A. Two new staining procedures for quantitative estimation of proteins on electrophoretic strips (англ.) // : journal. — 1963. — Vol. 71 . — P. 377—391 . — doi : . — .
- Meyer, T. S.; Lambert, B. L. Use of Coomassie brilliant blue R250 for the electrophoresis of microgram quantities of parotid saliva proteins on acrylamide-gel strips (англ.) // : journal. — 1965. — Vol. 107 , no. 1 . — P. 144—145 . — doi : . — .
- Altschul, A. M.; Evans, W. J. Zone electrophoresis with polyacrylamide gel (англ.) // Methods in Enzymology : journal. — 1967. — Vol. 11 . — P. 179—186 . — doi : . . Page 184 personal communication from W. J. Saphonov.
- Diezel, W.; Kopperschläger, G.; Hofmann, E. An improved procedure for protein staining in polyacrylamide gels with a new type of Coomassie Brilliant Blue (англ.) // : journal. — 1972. — Vol. 48 , no. 2 . — P. 617—620 . — doi : . — .
- Neuhoff, V.; Stamm, R.; Eibl, H. Clear background and highly sensitive protein staining with Coomassie Blue dyes in polyacrylamide gels: a systematic analysis (англ.) // Electrophoresis : journal. — 1985. — Vol. 6 , no. 9 . — P. 427—448 . — doi : .
- Candiano, G.; Bruschi, M.; Musante, L.; Santucci, L.; Ghiggeri, G. M.; Carnemolla, B.; Orecchia, P.; Zardi, L.; Righetti, P. G. Blue silver: a very sensitive colloidal Coomassie G-250 staining for proteome analysis (англ.) // Electrophoresis : journal. — 2004. — Vol. 25 , no. 9 . — P. 1327—1333 . — doi : . — .
- Steinberg, T. H. Protein gel staining methods: an introduction and overview (англ.) // Methods in Enzymology : journal. — 2009. — Vol. 463 . — P. 541—563 . — doi : . — .
- Pink, M.; Verma, N.; Rettenmeier, A. W.; Schmitz-Spanke, S. CBB staining protocol with higher sensitivity and mass spectrometric compatibility (англ.) // Electrophoresis : journal. — 2010. — Vol. 31 , no. 4 . — P. 593—598 . — doi : . — .
- Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding (англ.) // : journal. — 1976. — Vol. 72 . — P. 248—254 . — doi : . — .
- Schägger, H.; Jagow, G. Blue native electrophoresis for isolation of membrane protein complexes in enzymatically active form (англ.) // : journal. — 1991. — Vol. 199 , no. 2 . — P. 223—231 . — doi : . — .
- Wittig, I.; Braun, H. P.; Schägger, H. Blue native PAGE (англ.) // : journal. — 2006. — Vol. 1 , no. 1 . — P. 418—428 . — doi : . — .
Литература
- Gessner, T.; Mayer, U. (2002), "Triarylmethane and Diarylmethane Dyes", Ullmann's Encyclopedia of Industrial Chemistry 6th Edition , Weinheim: Wiley-VCH, doi :
Протоколы
- 2020-04-05
- 1