Interested Article - Обходные пути биосинтеза андрогенов у человека

- 2020-02-20
- 1
Обходные пути биосинтеза андрогенов ( англ. backdoor pathway of androgen biosynthesis ) — название метаболических путей, в которых синтезируются мужские половые гормоны ( андрогены ) из стероидов , содержащих 21 атом углерода (C 21 ), путём их 5α-восстановления без участия тестостерона и андростендиона в качестве промежуточных метаболических продуктов . Первый из обходных путей был описан в 2003 году у животных как цепочка реакций, начинавшаяся с 17α-гидроксипрогестерона и завершавшаяся 5α-дигидротестостероном . В 2004 году эта цепочка реакций была подтверждена и у людей. Кроме этого, у людей было обнаружено несколько других путей, которые также в обход стадий синтеза тестостерона и андростендиона приводят к синтезу 11-оксоандрогенов – агонистов рецепторов андрогенов , равных по силе воздействия тестостерону или 5α-дигидротестостерону . Эти метаболические пути присутствуют не только у человека, но и у других млекопитающих , и были изучены у мышей, крыс и кенгуру .
Обходной путь является альтернативой обычному пути, включающему тестостерон и андростендион в качестве конечных или промежуточных элементов . Обходной путь также важен для здоровья человека, как и обычный путь. Нарушения в обходном пути могут приводить к неоднозначности пола ( вирилизаци наружных половых органов) у новорожденных девочек и недостаточному развитие половых органов у новорожденных мальчиков . У взрослых людей обходной путь может приводить к избытку андрогенов и к таким болезням как поликистоз яичников или рак предстательной железы .
Обходной путь биосинтеза андрогенов регулируется рядом ферментов , таких как SRD5A1 / SRD5A2 , / и CYP17A1 . Мутации в генах, кодирующих эти ферменты, могут привести к нарушению функционирования обходного пути, что влечёт различные клинические последствия . Обходной путь биосинтеза андрогенов является активной областью исследований, и его понимание может иметь практическое значение для разработки методов лечения и контроля состояний, связанных с недостаточной или избыточной выработкой андрогенов .
Функция

Механизм воздействия андрогенов на организм основан на связывании молекул этих гормонов с андрогеновыми рецепторами , расположенными в цитозоле клеток. После связывания, рецепторы перемещаются в ядро клетки и контролируют процесс транскрипции генов путём взаимодействия с андроген-чувствительными элементами . Этот механизм играет ключевую роль в формировании половой дифференциации эмбриона и достижении половой зрелости, а также регулирует многие функции организма, не обязательно связанные с полом, например минерализацию костей или рост волос .
Различные андрогены оказывают различное влияние на андрогеновые рецепторы, так как они имеют разную степень связывания и активации рецепторов. Под клинически значимыми андрогенами понимаются те андрогены, которые оказывают сильное влияние на развитие и функционирование мужских половых признаков, в отличие от клинически незначимых андрогенов, которые имеют низкую биологическую активность или быстро метаболизируются в другие стероиды . Клинически незначимые андрогены не оказывают существенного влияния на развитие и функционирование мужских или женских половых признаков, но они могут быть продуктами метаболизма более активных андрогенов, таких как тестостерон, или их прекурсорами (предшественниками в метаболическом пути).
Обходные пути биосинтеза андрогенов — важные метаболические процессы , которые участвуют в формировании клинически значимых андрогенов из C 21 стероидов ( прегнанов , таких как прогестерон и 17α-гидроксипрогестерон (17OHP)) посредством их 5α-восстановления, то есть посредством восстановительной химической реакции , приводящей к изменению функциональной группы , находящейся в позиции 5α стероидного ( стеранового ) ядра молекулы. Эти пути идут в обход стадий синтеза тестостерона и андростендиона — стадий, которые присутствуют в обычном пути биосинтеза андрогенов . C 21 -стероиды обозначаются так потому, что их молекула имеет 21 атом углерода , то есть химическая формула начинается с «C 21 », например C 21 H 30 O 2 — формула прогестерона .
В 2004 году 5α-восстановление 17OHP было описано в медицинской литературе как длинный метаболический путь, который в итоге приводит к выработке 5α-дигидротестостерона (DHT) в конечных тканях. За два первых десятилетия XXI века было обнаружено ещё несколько путей, которые также в обход стадий синтеза тестостерона и андростендиона приводили к выработке 11-оксоандрогенов , которые также являются полноценными андрогенами, и так же воздействуют на андрогеновые рецепторы, как и тестостерон или DHT.
Эти метаболические пути присутствуют не только у человека, но и у других млекопитающих , и были изучены у мышей, крыс и кенгуру . Вид кенгуру Евгении ( лат. Notamacropus eugenii , англ. Tammar wallaby ) является предметом изучения процессов половой дифференциации и полового развития в контексте биосинтеза андрогенов благодаря тому, что половая дифференциация у этого вида происходит только после рождения: яички начинают формироваться через два дня, а яичники только на восьмой день после рождения. Это позволяет изучать не только влияние гормонов на организм с начала процесса половой дифференциации, но и пути биосинтеза этих гормонов, когда кенгуру уже родился, а не находится в плаценте как у других млекопитающих, что затрудняет наблюдение и воздействие .
Открытие обходного пути биосинтеза DHT у кенгуру Евгении в 2003 году расширило понимание процессов выработки андрогенов у людей и внесло вклад в разработку методов лечения и контроля состояний, связанных с недостаточной или избыточной выработкой андрогенов. Примерами таких состояний являются вирилизация наружных половых органов у новорождённых девочек или, напротив, недостаточное развитие половых органов у мальчиков. Также отмечаются такие проявления как акне , аменорея , проблемы с вынашиванием беременности, облысение по мужскому типу и (избыточный рост волос по мужскому типу на лице женщин), поликистоз яичников и рак предстательной железы . Все перечисленные состояния связаны с нарушениями биосинтеза и метаболизма андрогенных соединений в организме .
Биохимия
Обходной путь биосинтеза дигидротестостерона
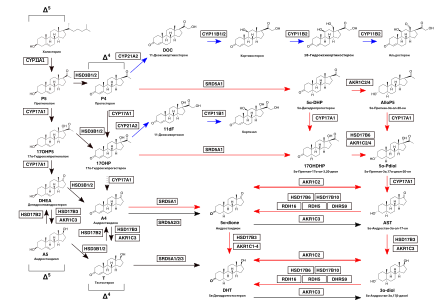
Первым и основным этапом обходного пути биосинтеза андрогенов является 5α-восстановленние прогестерона или 17α-гидроксипрогестерона (17OHP), а затем следует цепочка преобразований, приводящая к 5α-дигидротестостерону (DHT) альтернативным путём, минуя типичные промежуточные соединения андростендион и тестостерон .
Этот путь активируется во время нормального внутриутробного развития и приводит к ранней мужской половой дифференциации . Впервые он был описан у сумчатых , а затем подтверждён у людей . Как обычный, так и обходной пути биосинтеза DHT необходимы для нормального развития мужских половых органов у человека, поэтому дефекты обходного пути от 17OHP или прогестерона к DHT приводят к недостаточному развитию половых органов у эмбрионов мужского пола , поскольку плацентарный прогестерон является предшественником для биосинтеза DHT через обходной путь .
При дефиците 21-гидроксилазы или дефиците оксидоредуктазы цитохрома Р450 , этот путь может быть активирован независимо от возраста и пола даже при незначительном повышении уровня циркулирующего 17OHP .
В то время как реакция 5α-восстановления (восстановительная химическая реакция в позиции 5α ядра молекулы стероида) является последней трансформацией в обычном пути биосинтеза андрогенов, эта реакция в обходных путях к DHT является первой. Эти обходные пути начинаются с 5α-восстановления либо 17OHP, либо прогестерона , которые в конечном итоге превращаются в DHT .
Путь, начинающийся от 17α-гидроксипрогестерона
Первым этапом этого пути является 5α-восстановление 17OHP до (17OHDHP), который также известен как 17α-гидроксидигидропрогестерон. Эту реакцию катализирует фермент SRD5A1 .
17OHDHP затем преобразуется в (5α-Pdiol) посредством 3α-восстановления изоферментом 3α-гидроксистероид дегидрогеназы (AKR1C2 и AKR1C4) или ферментом HSD17B6, который также обладает 3α-восстановительной активностью . 5α-Pdiol также известен как 17α-гидроксиаллопрегнанолон или 17OH-аллопрегнанолон .
5α-Pdiol затем преобразуется в 5α-андростан-3α-ол-17-он, также известный как андростерон (AST), за счёт 17,20-лиазной активности фермента CYP17A1, который отщепляет боковую цепь (связь C17-C20) от стероидного (стеранового) ядра молекулы, превращая стероид С 21 ( прегнан ) в стероид С 19 ( андростан или андроген ) .
На следующем этапе, AST 17β-восстанавливается до 5α-андростан-3α,17β-диола (3α-diol) с помощью фермента HSD17B3 или AKR1C3 .
Последним этапом является 3α-окисление 3α-diol в конечных тканях до DHT, ферментом, обладающим активностью 3α-гидроксистероидоксидазы, таким как AKR1C2 , HSD17B6, HSD17B10, RDH16, RDH5 и DHRS9 . Это окисление не требуется в обычном пути биосинтеза DHT .
Всю цепочку стероидов на этом пути можно изобразить следующим образом: 17OHP → 17OHDHP → 5α-Pdiol → AST → 3α-diol → DHT .
Путь, начинающийся от прогестерона
Путь от прогестерона к DHT подобен описанному выше пути от 17OHP к DHT, но исходным субстратом для 5α-редуктазы здесь является прогестерон, а не 17OHP. Плацентарный прогестерон у плода мужского пола является исходным материалом для обходного пути, который действует во многих негонадных тканях .
Первым шагом на этом пути является 5α-восстановление прогестерона до 5α-дигидропрогестерона (5α-DHP) с помощью фермента SRD5A1 .
Затем 5α-DHP превращается в аллопрегнанолон (AlloP5) посредством 3α-восстановления с помощью AKR1C2 или AKR1C4 .
Затем AlloP5 превращается в 5α-Pdiol под действием 17α-гидроксилазной активности CYP17A1 .
Затем этот путь протекает так же, как и путь, который начинается с 17OHP, и его можно изобразить следующим образом: прогестерон → 5α-DHP → AlloP5 → 5α-Pdiol → AST → 3α-diol → DHT .
11-оксоандрогены
Номенклатура
Префикс «11-оксо» применительно к стероиду означает присутствие атома кислорода в качестве оксо (=O) функциональной группы, присоединённой к атому углерода в позиции 11 ядра стероида .
В некоторых источниках, описывающих классы и группы стероидов, можно встретить префикс «11-кето», например, «11-кетостероид» . В химии префикс «кето» широко используется для обозначения органических соединений. Однако рекомендации Объединённой комиссии по биохимической номенклатуре 1989 года не рекомендуют использовать префикс «кето» при наименовании стероидов, особенно для классификации и группировки стероидных соединений. Рекомендуется предпочитать использование префикса «оксо», например, 11-оксостероиды вместо 11-кетостероиды. Кетоны — это вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами (R 1 -CO-R 2 ). Иными словами, у кетонов углерод включён в карбонильную группу, а у стероидов атомы углерода являются частью скелетного ядра и нумеруются отдельно. Поскольку карбонильная группа уже включает углерод, который является также частью стероидного ядра, то один и тот же атом углерода, согласно указанным рекомендациям, не должен указываться дважды .
Обходные пути биосинтеза 11-оксоандрогенов
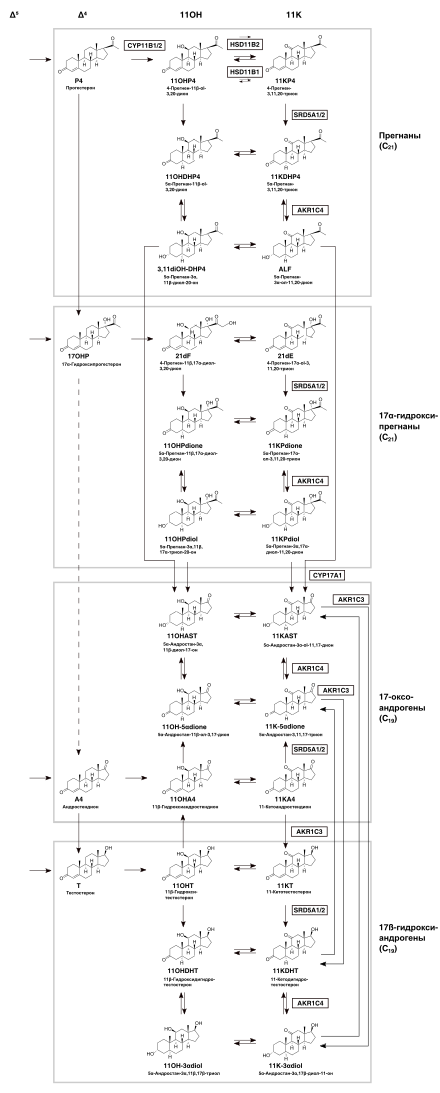
Есть два известных 11-оксоандрогена — 11-кетотестостерон (11KT) и 11-кетодигидротестостерон (11KDHT) — которые связывают и активируют рецепторы андрогенов по силе воздействия такой же, как у тестостерона и DHT соответственно . В некоторых работах предполагается, что, хотя 11-гидроксиандрогены, такие как 11-гидрокситестостерон (11OHT) и 11-гидроксидигидротестостерон (11OHDT) могут не обладать значительной андрогенной активностью, они все же могут быть важными предшественниками андрогенных молекул 11KT и 11KDHT . Относительная важность андрогенов в их влиянии на организм зависит от их активности, от их концентрации в крови и в тканях, и от их стабильности. Было установлено, что стероиды 11-гидроксиандростендион (11OHA4) и 11-кетоандростендион (11KA4) обладают минимальной андрогенной активностью , но остаются важными молекулами в этом контексте, поскольку они действуют как предшественники биологически-активных андрогенов .
Обходные пути к 11-оксоандрогенам и 11-гидроксиандрогенам могут быть в целом представлены двумя точками входа Δ 4 стероидов (17OHP и прогестерон), которые могут претерпевать общую последовательность из трёх преобразований:
- 11β-гидроксилирование с помощью CYP11B1 в коре надпочечников,
- 5α-восстановление с помощью SRD5A1 / SRD5A2 ,
- обратимое 3α-восстановление/окисление функциональной группы кетона / спирта в молекуле стеродиа с помощью или .
Роль в здоровье человека
Врождённая гиперплазия коры надпочечников
При врождённой гиперплазии коры надпочечников (ВГКН) из-за дефицита 21-гидроксилазы или дефиците цитохром P450 оксидоредуктазы (POR) , связанный с этим повышенный уровень 17OHP приводит к усилению биосинтеза DHT через обходной путь, который начинается с 5α-восстановления 17OHP. Этот путь может быть активирован независимо от возраста и пола , и у эмбриона женского пола с ВКНГД может приводить к вирилизации наружных половых органов , то есть к неоднозначному виду гениталий у новорожденных девочек, что приводит к затруднению определения пола при рождении таких девочек . Кроме повышенных уровней 17OHP, могут быть повышены и уровни прогестерона, что приводит к тем же последствиям. Кроме того, и 17OHP, и прогестерон, также могут служить субстратами для 11-оксоандрогенов и 11-гидроксиандрогенов при ВКГНД , усугубляя указанные симптомы.
Маскулинизация женских наружных половых органов у плода из-за приёма матерью экзогенных гормонов с андрогенным эффектом , как правило, менее заметна, чем при ВГКН и, в отличие от ВГКН, не вызывает прогрессирующую вирилизацию .
11-оксоандрогены и 11-гидроксиандрогены
Ещё с 1990-х годов известно, что уровни в крови C 21 11-гидроксистероидов (11-гидроксипрогестерон (11OHP4) и 21-деоксикортизол (21dF)) повышены как при классической, так и при неклассической ВГКН , а профили ЖХ-МС/МС , включающие эти стероиды, были предложены для клинического применения . У пациентов с классической ВГКН, получавших терапию глюкокортикоидами , уровни C 19 11-оксостероидов и 11-гидроксистероидов в сыворотке крови были повышены в 3-4 раза по сравнению с контрольной группой, состоявшей из здоровых людей . В том же исследовании уровни C 19 11-оксоандрогенов положительно коррелировали с обычными андрогенами (такими, как тестостерон) у женщин, но отрицательно у мужчин. Уровни 11KT были в 4 раза выше по сравнению с тестостероном у женщин с этим заболеванием. У взрослых женщин с ВГКН соотношение количества DHT, биосинтезированного обходным путём, к количеству, биосинтезированному обычным путём, увеличивается по мере того, как ухудшается контроль избытка андрогенов с помощью терапии глюкокортикоидами . У женщин с синдромом поликистозных яичников уровень 11KT также повышен . У пациентов с ВГКН с плохим контролем заболевания, 11-оксоандрогены остаются повышенными дольше, чем 17OHP, что служит лучшим биомаркером эффективности контроля заболевания . У мужчин с ВГКН уровень 11-оксоандрогенов может указывать на наличие опухолей яичек .
Как обычный, так и обходной путь биосинтеза DHT, необходимы для нормального развития мужских половых органов человека на этапе эмибрионального развития . Дефицит каталитической активности ферментов в обходном пути к DHT от 17OHP или от прогестерона приводит к недостаточному развитию мужских половых органов у плода мужского пола , поскольку плацентарный прогестерон является предшественником DHT в обходном пути .
Роль некоторых ферментов
AKR1C2/AKR1C4
Что касается роли ферментов AKR1C2 и AKR1C4, то их роль в обходном пути биосинтеза андгогенов удалось установить по результатам исследования пяти пациентов с кариотипом 46,XY (мужчины) из двух семей. Это исследование показало, что атипичный внешний вид гениталий у этих мужчин был связан с мутациями в генах, кодирующих ферменты AKR1C2 и/или AKR1C4. Эти ферменты действуют исключительно в обходном пути к DHT, но не в обычном пути биосинтеза DHT через тестостерон. Мутации в AKR1C3 и генах, вовлечённых в обычный путь биосинтеза DHT, были исключены как причины атипичного внешнего вида. При этом участницы с кариотипом 46,XX (женщины), родственники больных пациентов-мужчин, имеющие те же мутации, были фенотипически нормальными и фертильными. Хотя и AKR1C2, и AKR1C4 необходимы для синтеза DHT в обходном пути, исследование показало, что мутаций только в AKR1C2 достаточно для нарушения функционирования этого пути . Мутации в генах AKR1C2/AKR1C4, ведущие к нарушениям полового развития (НПР), редки, и до сих пор были отмечены только в этих двух семьях. Тем не менее, в данном исследовании удалось установить роль AKR1C2/AKR1C4 как критически важных ферментов в альтернативных путях биосинтеза андрогенов .
CYP17A1
Изолированный синдром дефицита 17,20-лиазы (ILD), обусловленный мутациями в CYP17A1, цитохрома b 5 и POR, также может нарушать обходной путь биосинтеза DHT, поскольку активность 17,20-лиазы CYP17A1 необходима как для обычного, так и для обходного пути биосинтеза DHT . Мальчики (46,XY) с ILD обычно распознаются при рождении из-за выраженной недостаточной маскулинизации, в то время как девочки (46,XX) обычно остаются без распознания данного синдрома вплоть до полового созревания , когда у них проявляется первичная аменорея , связанная с недостаточностью половых желез .
11-оксоандрогены и нарушения полового развития
11-оксоандрогены могут играть важную роль в НПР . Биосинтез 11-оксоандрогенов у плода может совпадать с ключевыми этапами продукции кортизола — на 8-9-й, 13-24-й неделях беременности, а также с 31-й недели и далее. На этих стадиях, нарушение активности CYP17A1 и CYP21A2 приводит к увеличению АКТГ из-за дефицита кортизола и накоплению субстратов для CYP11B1 в путях образования 11-оксоандрогенов, и может вызывать аномальное развитие плода женского пола .
Рак предстательной железы
Обходной путь биосинтеза андрогенов также играет роль при раке предстательной железы . Андрогенная депривация — это терапевтический подход к раку предстательной железы, который может быть реализован путём кастрации для устранения тестостерона, который синтезируют яички , но затем метастатические опухоли могут развиться в кастрационно-резистентный рак предстательной железы (КРРПЖ). Хотя кастрация приводит к снижению уровня тестостерона в сыворотке крови на 90-95 %, уровень дигидротестостерона в предстательной железе снижается только на 50 %, что подтверждает предположение о том, что простата вырабатывает необходимые ферменты для выработки DHT без участия тестостерона из яичек .
История
В 1987 году Б.Экштейн и соавторы инкубировали тестикулярные микросомы крысы в присутствии радиоактивно меченных стероидов и продемонстрировали, что 5α-андростан-3α,17β-диол преимущественно продуцируется из 17α-гидроксипрогестерона (17OHP) .
В 2000 году Г. Шоу и соавторы продемонстрировали, что циркулирующий 3α-diol определяет развитие предстательной железы у молодых кенгуру путём превращения в DHT в конечных тканях. Молодняк кенгуру не демонстрирует полового диморфизма в циркулирующих уровнях Т и DHT во время развития простаты, что позволяет предположить, что за это ответственен другой механизм андрогенизации. Хотя аффинность связывания 3α-диола с андрогенными рецепторами на пять порядков ниже, чем у DHT, было известно, что 3α-diol может окисляться обратно до DHT под действием ряда дегидрогеназ .
В 2003 году Дж. Уилсон и соавторы инкубировали семенники молодых сумчатых ( кенгуру ) с радиоактивно меченым прогестероном, чтобы показать, что экспрессия 5α-редуктазы в этой ткани обеспечивает новый путь от 17OHP до 3α-диола без тестостерона в качестве промежуточного продукта: 17OHP → 17OHDHP → 5α -Pdiol → AST → 3α-diol .
В 2004 году М. Махендру и соавторы продемонстрировали, что в семенниках мышей действует новый путь, и обобщили то, что было продемонстрировано у кенгуру : прогестерон → 5α-DHP → AlloP5 → 5α-Pdiol → AST → 3α-diol .
Позже в том же году Р. Охус ввёл термин обходной путь (backdoor pathway ) и определил его как путь к DHT, который: 1) обходит обычные промежуточные соединения андростендион (А4) и Т; 2) включает 5α-восстановление С 21 -стероидов (прегнанов) с последующей их конверсией в С 19 -стероиды (андростаны); и 3) включает 3α-окисление 3α-диола до DHT. Обходной путь объяснил, как андрогены синтезируются при определённых нормальных и патологических состояниях у людей, когда обычный путь биосинтеза DHT не может полностью объяснить наблюдаемые последствия. Путь, который определил Р. Охус, добавляет DHT к концу пути, который определил Дж. Уилсон, а именно: 17OHP → 17OHDHP → 5α-Pdiol → AST → 3α-diol → DHT .
Клиническая значимость этих результатов была впервые продемонстрирована в 2012 году, когда К. Камрат и соавторы показали, что метаболиты, выводимые с мочой , возникают в связи с активностью обходного пути биосинтеза андрогенов от 17OHP к DHT у пациентов с дефицитом 21-гидроксилазы .
Л. Барнард и соавторы в 2017 году продемонстрировали метаболические пути от стероидов C 21 до 11KDHT, которые обходят A4 и тестостерон. Обходной путь 11KDHT аналогичен обходному пути к DHT. Эти пути к 11-оксоандрогенам также были описаны как обходные пути из-за указанного сходства, и были дополнительно охарактеризованы в последующих исследованиях .
См. также
Примечания
- ↑ Auchus, Richard J. (November 2004). "The backdoor pathway to dihydrotestosterone". Trends in Endocrinology and Metabolism . 15 (9): 432—8. doi : . PMID . S2CID .
- ↑ Barnard, Lise (2017). . The Journal of Steroid Biochemistry and Molecular Biology . 174 : 86—95. doi : . PMID . S2CID . из оригинала 15 апреля 2023 . Дата обращения: 29 июня 2023 .
- ↑ van Rooyen, Desmaré (2018). "The in vitro metabolism of 11β-hydroxyprogesterone and 11-ketoprogesterone to 11-ketodihydrotestosterone in the backdoor pathway". The Journal of Steroid Biochemistry and Molecular Biology . 178 : 203—212. doi : . PMID . S2CID .
-
↑
Van Rooyen, Desmaré (2020). "CYP17A1 exhibits 17αhydroxylase/17,20-lyase activity towards 11β-hydroxyprogesterone and 11-ketoprogesterone metabolites in the C11-oxy backdoor pathway".
The Journal of Steroid Biochemistry and Molecular Biology
.
199
: 105614.
doi
:
.
PMID
.
S2CID
.
[...] steroidogenic research has focused on the metabolism of the C11-oxy C21 steroids in backdoor pathway yielding potent androgens (Fig. 1). Increased activation of the pathway and elevated enzyme expression levels are more frequently reported in the human fetus and ovaries and in clinical conditions which include 21OHD and adrenocortical tumours. [...] The detection of C11-oxy steroids in clinical conditions associated with increased backdoor pathway activity led us to investigate the catalytic activity of CYP17A1 towards the C11-oxy C21 steroids potentially contributing to the androgen pool.
- ↑ Snaterse G, Hofland J, Lapauw B (January 2023). . Endocr Oncol . 3 (1): e220072. doi : . PMC . PMID .
- ↑ Renfree MB, Shaw G (September 2023). "The alternate pathway of androgen metabolism and window of sensitivity". J Endocrinol . 258 (3). doi : . PMID .
-
↑
Draskau MK, Svingen T (2022).
.
Front Toxicol
.
4
: 883254.
doi
:
.
PMC
.
PMID
.
{{ cite journal }}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) ( ссылка ) - ↑ Fukami, Maki (2013). "Backdoor pathway for dihydrotestosterone biosynthesis: implications for normal and abnormal human sex development". Developmental Dynamics . 242 (4): 320—9. doi : . PMID . S2CID .
- ↑ Акрамов Наиль Рамилович, Закиров Айдар Камилевич. // Казанский медицинский журнал. — 2014. — № 3 .
- ↑ Kempegowda P, Melson E, Manolopoulos KN, Arlt W, O'Reilly MW (2020). . Ther Adv Endocrinol Metab . 11 : 2042018820934319. doi : . PMC . PMID .
- ↑ O'Shaughnessy, Peter J. (2019). . PLOS Biology . 17 (2): e3000002. doi : . PMC . PMID .
- ↑ Naamneh Elzenaty R, du Toit T, Flück CE (July 2022). "Basics of androgen synthesis and action". Best Pract Res Clin Endocrinol Metab . 36 (4): 101665. doi : . PMID .
- Van-Duyne G, Blair IA, Sprenger C, Moiseenkova-Bell V, Plymate S, Penning TM (2023). "The androgen receptor". Vitamins and Hormones . 1p23 : 439—481. doi : . ISBN 9780443134555 . PMID .
- Alemany M (October 2022). . International Journal of Molecular Sciences . 23 (19): 11952. doi : . PMC . PMID .
- Ceruti JM, Leirós GJ, Balañá ME (April 2018). "Androgens and androgen receptor action in skin and hair follicles". Molecular and Cellular Endocrinology . 465 : 122—133. doi : . : . PMID . S2CID .
- Cussen L, McDonnell T, Bennett G, Thompson CJ, Sherlock M, O'Reilly MW (August 2022). . Clin Endocrinol (Oxf) . 97 (2): 174—186. doi : . PMC . PMID .
- ↑ Kinter, K. J. / K. J. Kinter, A. A. Anekar. — StatPearls, 2021. от 21 апреля 2023 на Wayback Machine
- Гончаров Николай Петрович, Кация Г.В. // Андрология и генитальная хирургия. — 2015. — № 1 . — doi : .
- "IUPAC-IUB Joint Commission on Biochemical Nomenclature (JCBN). The nomenclature of steroids. Recommendations 1989". Eur J Biochem . 186 (3): 429—58. 1989. doi : . PMID .
- . National Library of Medicine.
-
Andrew ER, Jurga K, Radomski JM, Reynhardt EC (July 1992). "Proton relaxation NMR study of polycrystalline progesterone".
Solid State Nucl Magn Reson
.
1
(3): 121—5.
doi
:
.
PMID
.
progesterone (4-pregnene-3,20-dione, C21H30O2)
-
Barnard, L. (2017). "Adrenal C11-oxy C(21) steroids contribute to the C11-oxy C(19) steroid pool via the backdoor pathway in the biosynthesis and metabolism of 21-deoxycortisol and 21-deoxycortisone".
The Journal of Steroid Biochemistry and Molecular Biology
.
174
: 86—95.
doi
:
.
PMID
.
S2CID
.
The downstream metabolism of 21dF and 21dE by the enzymes in the backdoor pathway, SRD5A and AKR1C2, was investigated and the resulting novel C11‐oxy C21 steroids, 5α‐pregnan-3α, 11β, 17-triol-20-one (11OHPdiol) and 5α-pregnan-3α, 17-diol-11, 20-dione (11KPdiol), were shown to be suitable substrates for the lyase activity of CYP17A1, resulting in the production of C11-oxy C19 steroid metabolites 11β‐hydroxyandrosterone (11OHAST) and 11‐ketoandrosterone (11KAST) [...]
- Biason-Lauber A, Miller WL, Pandey AV, Flück CE (May 2013). "Of marsupials and men: "Backdoor" dihydrotestosterone synthesis in male sexual differentiation". Mol Cell Endocrinol . 371 (1—2): 124—32. doi : . PMID .
- Leihy MW, Shaw G, Wilson JD, Renfree MB (July 2004). "Penile development is initiated in the tammar wallaby pouch young during the period when 5alpha-androstane-3alpha,17beta-diol is secreted by the testes". Endocrinology . 145 (7): 3346—52. doi : . PMID .
- Glickman SE, Short RV, Renfree MB (November 2005). "Sexual differentiation in three unconventional mammals: spotted hyenas, elephants and tammar wallabies". Horm Behav . 48 (4): 403—17. doi : . PMID .
-
Chen Y, Renfree MB (January 2020).
.
Genes (Basel)
.
11
(1).
doi
:
.
PMC
.
PMID
.
{{ cite journal }}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) ( ссылка ) - ↑ Wilson, Jean D. (2003). "5alpha-androstane-3alpha,17beta-diol is formed in tammar wallaby pouch young testes by a pathway involving 5alpha-pregnane-3alpha,17alpha-diol-20-one as a key intermediate". Endocrinology . 144 (2): 575—80. doi : . PMID . S2CID .
- Saito K, Matsuzaki T, Iwasa T, Miyado M, Saito H, Hasegawa T, Homma K, Inoue E, Miyashiro Y, Kubota T, Irahara M, Ogata T, Fukami M (April 2016). "Steroidogenic pathways involved in androgen biosynthesis in eumenorrheic women and patients with polycystic ovary syndrome". J Steroid Biochem Mol Biol . 158 : 31—37. doi : . PMID .
- Preeti Dabadghao. (англ.) // Best Practice & Research Clinical Endocrinology & Metabolism. — 2019-06. — Vol. 33 , iss. 3 . — P. 101272 . — doi : .
- Miller, WL (April 2019). . PLOS Biology . 17 (4): e3000198. doi : . PMC . PMID .
- ↑ Kamrath, Clemens (2012). . The Journal of Clinical Endocrinology and Metabolism . 97 (3): E367—375. doi : . ISSN . PMID . S2CID . из оригинала 30 июня 2023 . Дата обращения: 29 июня 2023 .
- ↑ Miller, Walter L. (2019). . PLOS Biology . 17 (4): e3000198. doi : . PMC . PMID .
- ↑ Shaw, G. (2000). . Proceedings of the National Academy of Sciences of the United States of America . 97 (22): 12256—12259. Bibcode : . doi : . ISSN . PMC . PMID .
- ↑ Mahendroo, Mala (2004). . Molecular and Cellular Endocrinology . 222 (1—2): 113—120. doi : . ISSN . PMID . S2CID . из оригинала 15 апреля 2023 . Дата обращения: 29 июня 2023 .
- ↑ Flück, Christa E.; Meyer-Böni, Monika; Pandey, Amit V.; Kempná, Petra; Miller, Walter L.; Schoenle, Eugen J.; Biason-Lauber, Anna (August 2011). . American Journal of Human Genetics . 89 (2): 201—18. doi : . PMC . PMID .
- ↑ Reisch, Nicole (2019). . Proceedings of the National Academy of Sciences of the United States of America . 116 (44): 22294—22299. Bibcode : . doi : . ISSN . PMC . PMID .
- Sumińska, Marta (2020). . Int J Mol Sci . 21 (13): 4622. doi : . PMC . PMID .
- Biswas, Michael G. (1997). . J Biol Chem . 272 (25): 15959—66. doi : . PMID .
- Muthusamy, Selvaraj (2011). . Proc Natl Acad Sci U S A . 108 (50): 20090—4. Bibcode : . doi : . PMC . PMID .
- Storbeck, Karl-Heinz. Canonical and Noncanonical Androgen Metabolism and Activity // Prostate Cancer. — 2019. — Vol. 1210. — P. 239–277. — ISBN 978-3-030-32655-5 . — doi : .
- Rižner, Tea Lanišnik (2003). "Role of human type 3 3alpha-hydroxysteroid dehydrogenase (AKR1C2) in androgen metabolism of prostate cancer cells". Chem Biol Interact . 143—144: 401—9. doi : . PMID .
- Rebuffat AG, Tam S, Nawrocki AR, Baker ME, Frey BM, Frey FJ, Odermatt A (February 2004). "The 11-ketosteroid 11-ketodexamethasone is a glucocorticoid receptor agonist". Mol Cell Endocrinol . 214 (1—2): 27—37. doi : . PMID .
- Funder JW, Krozowski Z, Myles K, Sato A, Sheppard KE, Young M (1997). "Mineralocorticoid receptors, salt, and hypertension". Recent Prog Horm Res . 52 : 247—60, discussion 261–2. PMID .
-
"IUPAC-IUB Joint Commission on Biochemical Nomenclature (JCBN). The nomenclature of steroids. Recommendations 1989".
Eur J Biochem
.
186
(3): 429—58. 1989.
doi
:
.
PMID
.
The prefix oxo- should also be used in connection with generic terms, e.g., 17-oxo steroids. The term '17-keto steroids', often used in the medical literature, is incorrect because C-17 is specified twice, as the term keto denotes C=O
- ↑ Masiutin, Maxim (2023). "Alternative androgen pathways". WikiJournal of Medicine . 10 : X. doi : . S2CID .
- Snaterse, Gido (2022-01-19). . Prostate Cancer and Prostatic Diseases . 26 (2): 293—301. doi : . ISSN . PMID . S2CID . из оригинала 15 апреля 2023 . Дата обращения: 29 июня 2023 .
- Handelsman, David J. (April 2022). . The Journal of Steroid Biochemistry and Molecular Biology . 218 : 106049. doi : . ISSN . PMID . S2CID . из оригинала 15 апреля 2023 . Дата обращения: 29 июня 2023 .
- Masiutin, Maxim (21 October 2022). . [Wikijournal of Medicine|Wikijournal of Medicine] . 10 (1). doi : . S2CID . из оригинала 15 апреля 2023 . Дата обращения: 29 июня 2023 .
- Snaterse, Gido; Mies, Rosinda; van Weerden, Wytske M.; French, Pim J.; Jonker, Johan W.; Houtsmuller, Adriaan B.; van Royen, Martin E.; Visser, Jenny A.; Hofland, Johannes (2022-01-19). "Androgen receptor mutations modulate activation by 11-oxygenated androgens and glucocorticoids". Prostate Cancer and Prostatic Diseases . doi : . ISSN . PMID . S2CID .
- Handelsman, David J.; Cooper, Elliot R.; Heather, Alison K. (April 2022). "Bioactivity of 11 keto and hydroxy androgens in yeast and mammalian host cells". The Journal of Steroid Biochemistry and Molecular Biology . 218 : 106049. doi : . ISSN . PMID . S2CID .
- Rege, Juilee (2013). . J Clin Endocrinol Metab . 98 (3): 1182—8. doi : . PMC . PMID .
- Campana, Carmela (2016). . J Steroid Biochem Mol Biol . 156 : 17—22. doi : . PMC . PMID .
- Шифман Борис Михайлович, Платонова Надежда Михайловна, Молашенко Наталья Валерьевна, Трошина Екатерина Анатольевна, Романова Наталья Юрьевна, Колесникова Галина Сергеевна. // Проблемы эндокринологии. — 2019. — № 2 . 29 июня 2023 года.
- Turcu AF, Rege J, Auchus RJ, Rainey WE (May 2020). . Nat Rev Endocrinol . 16 (5): 284—296. doi : . PMC . PMID .
- ↑ Lee, Hyun Gyung (2022). . Ann Pediatr Endocrinol Metab . 27 (2): 83—89. doi : . PMC . PMID .
- Turcu, Adina F. (2015). . Endocrinology and Metabolism Clinics of North America . Elsevier BV. 44 (2): 275—296. doi : . ISSN . PMC . PMID .
- Turcu, A. F. (2015). . The Journal of Clinical Endocrinology and Metabolism . 100 (6): 2283—2290. doi : . PMC . PMID .
- Nguyen, Lee S. (2019). "Influence of hormones on the immunotolerogenic molecule HLA-G: a cross-sectional study in patients with congenital adrenal hyperplasia". Eur J Endocrinol . 181 (5): 481—488. doi : . PMID . S2CID .
- Комкова Галина Николаевна, Басова Алла Викторовна. Проблемы определения пола у новорожденных: социальный, медицинский и юридический аспекты // Российский вестник перинатологии и педиатрии. — 2019. — № 3 .
- Schardein JL (1980). «Congenital abnormalities and hormones during pregnancy: a clinical review». Teratology . 22 (3): 251-70. doi:10.1002/tera.1420220302. PMID 7015547
- Fiet, J. (March 1989). . The Journal of Clinical Endocrinology and Metabolism . 68 (3): 542—547. doi : . ISSN . PMID . из оригинала 15 апреля 2023 . Дата обращения: 29 июня 2023 .
- Fiet, J. (1989-12-02). . Presse Medicale (Paris, France: 1983) . 18 (40): 1965—1969. ISSN . PMID . из оригинала 15 апреля 2023 . Дата обращения: 29 июня 2023 .
- Fiet, Jean (2017-03-01). . Journal of the Endocrine Society . 1 (3): 186—201. doi : . ISSN . PMC . PMID .
- Turcu, Adina F. (2016). . Eur J Endocrinol . 174 (5): 601—9. doi : . PMC . PMID .
- Auchus, Richard J. (2014). . J Clin Endocrinol Metab . 99 (8): 2763—70. doi : . PMC . PMID .
- Никитина И.Л., Скородок Ю.Л. // Лечащий врач. — 2019. — № 3 .
- Turcu, Adina F. (2021). . Front Endocrinol (Lausanne) . 12 : 751191. doi : . PMC . PMID .
- ↑ Turcu, Adina F (2017). . The Journal of Clinical Endocrinology and Metabolism . 102 (8): 2701—2710. doi : . PMC . PMID .
- Schröder, Mariska A M. (2022). . J Clin Endocrinol Metab . 107 (1): e272—e280. doi : . PMC . PMID .
- Flück, Christa E. (2014). "Steroidogenesis of the testis -- new genes and pathways". Ann Endocrinol (Paris) . 75 (2): 40—7. doi : . PMID .
- Zachmann, M. (1996). "Prismatic cases: 17,20-desmolase (17,20-lyase) deficiency". J Clin Endocrinol Metab . 81 (2): 457—9. doi : . PMID .
- Boettcher, Claudia (2022). "Rare forms of genetic steroidogenic defects affecting the gonads and adrenals". Best Pract Res Clin Endocrinol Metab . 36 (1): 101593. doi : . PMID . S2CID .
- ↑ Комаров Евгений Константинович, Михнина Елена Андреевна, Осиновская Наталья Сергеевна. // Журнал акушерства и женских болезней. — 2020. — № 1 . — doi : .
- Claudia Boettcher, Christa E. Flück. (англ.) // Best Practice & Research Clinical Endocrinology & Metabolism. — 2022-01. — Vol. 36 , iss. 1 . — P. 101593 . — doi : .
- ↑ Du Toit, Therina (2021). "Turning the spotlight on the C11-oxy androgens in human fetal development". J Steroid Biochem Mol Biol . 212 : 105946. doi : . PMID . S2CID .
- Finkielstain, Gabriela P. (2021). . Front Endocrinol (Lausanne) . 12 : 770782. doi : . PMC . PMID .
- Краснов Г.С., Дмитриев А.А., Волченко Н.Н., Данилова Т.В., Садритдинова А.Ф., Снежкина А.В., Мельникова Н.В., Федорова М.С., Лакунина В.А., Белова А.А., Алексеев Б.Я., Каприн А.Д., Кудрявцева А.В. // Сибирский онкологический журнал. — 2014. — № 6 . 25 июля 2023 года.
- Luu-The, Van; Bélanger, Alain; Labrie, Fernand (2008). "Androgen biosynthetic pathways in the human prostate". Best Practice & Research. Clinical Endocrinology & Metabolism . Elsevier BV. 22 (2): 207—221. doi : . ISSN . PMID .
- Eckstein, B. (1987). . Biochimica et Biophysica Acta (BBA) - General Subjects . 924 (1): 1—6. doi : . ISSN . PMID . из оригинала 15 апреля 2023 . Дата обращения: 29 июня 2023 .
- Penning, Trevor M. (1997). . Endocrine Reviews (англ.) . 18 (3): 281—305. doi : . ISSN . PMID . S2CID . из оригинала 15 апреля 2023 . Дата обращения: 29 июня 2023 .
Литература
- Гончаров Николай Петрович. // Проблемы эндокринологии. — 1996-08-15. — Т. 42 , вып. 4 . — С. 28–31 . — ISSN . — doi : .
- Гончаров Николай Петрович, Кация Г.В. // Андрология и генитальная хирургия. — 2015. — № 1 . — doi : .
- Маевская Ю.Н., Красикова В.А. // Вестник Российского государственного медицинского университета. — 2014. — № 2 . — doi : .
- Яроцкий Н.Е., Семенюк Л.Н. // Клінічна ендокринологія та ендокринна хірургія. — 2016. — № 4 (56) .
- Барашева Ольга Васильевна, Плотникова Елена Валерьевна, Шабалов Николай Павлович. // Педиатр. — 2012. — № 3 .
- Калинченко Светлана Юрьевна, Тюзиков Игорь Адамович, Тишова Юлия Александровна, Ворслов Леонид Олегович. // Доктор.Ру. — 2015. — № 14 (115) .
|
|
На эту статью
не ссылаются другие статьи Википедии
.
|
- 2020-02-20
- 1

