Сложные проценты
- 1 year ago
- 0
- 0
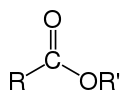
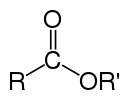
Сло́жные эфи́ры , или эсте́ры (от др.-греч. αἰθήρ — « эфир »), — производные кислородных кислот (как карбоновых , так и неорганических ), имеющих общую формулу R k E(=O) l (OH) m , где l ≠ 0 , формально являющиеся продуктами замещения атомов водорода в гидроксилах —OH кислотной функции на углеводородный остаток (алифатический, алкенильный, ароматический или гетероароматический); рассматриваются также как ацилпроизводные спиртов . В номенклатуре IUPAC к сложным эфирам относят также ацилпроизводные халькогенидных аналогов спиртов ( тиолов , селенолов и теллуролов) .
Отличаются от простых эфиров (этеров), у которых два углеводородных радикала соединены атомом кислорода (R 1 —O—R 2 ).
В случае эфиров карбоновых кислот выделяются два класса сложных эфиров:
Циклические сложные эфиры оксикислот называются лактонами и выделяются в отдельную группу соединений.
Основные методы получения сложных эфиров:
Сложные эфиры низших карбоновых кислот и простейших одноатомных спиртов — летучие бесцветные жидкости с характерным, зачастую фруктовым запахом. Сложные эфиры высших карбоновых кислот — бесцветные твердые вещества, температура плавления которых зависит как от длин углеродных цепей ацильного и спиртового остатков, так и от их структуры.
В ИК-спектрах сложных эфиров присутствуют характеристические полосы карбоксильной группы — валентных колебаний связей C=O на 1750—1700 см −1 и С—О на 1275—1050 см −1 .
Атом углерода карбонильной группы сложных эфиров электрофилен, вследствие этого для них характерны реакции замещения спиртового остатка с разрывом связи ацил-кислород:
Такие реакции с кислородными нуклеофилами (водой и спиртами) зачастую катализируются кислотами за счёт протонирования атома кислорода карбонила с образованием высокоэлектрофильного карбокатиона:
который далее реагирует с водой ( гидролиз ) или спиртом (переэтерификация). Гидролиз сложных эфиров в условиях кислотного катализа является обратимым, гидролиз же в щелочной среде необратим из-за образования карбоксилат-ионов RCOO − , не проявляющих электрофильных свойств.
Низшие сложные эфиры реагируют с аммиаком, образуя амиды , уже при комнатной температуре: так, например, этилхлорацетат реагирует с водным аммиаком, образуя хлорацетамид уже при 0 °C , в случае высших сложных эфиров аммонолиз идет при более высоких температурах.
Сложные эфиры широко используются в качестве растворителей , пластификаторов , ароматизаторов .
Эфиры муравьиной кислоты :
Эфиры уксусной кислоты :
Эфиры масляной кислоты :
Эфиры изовалериановой кислоты :
В конце XIX — начале XX века, когда органический синтез делал свои первые шаги, множество сложных эфиров было синтезировано и испытано фармакологами. Они стали основой таких лекарственных средств, как , валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат , в настоящее время практически вытесненный более эффективными средствами.
В сложных эфирах неорганических (минеральных) кислот углеводородный радикал (например, алкил ) замещает один или несколько атомов водорода неорганической оксокислоты, таким образом эфиры неорганических кислот могут быть как средними, так и кислыми.
По строению эфиры напоминают соли кислот. Так, эфирами фосфорной , азотной , серной и др. кислот являются органические фосфаты , нитраты , и др. соответственно.
Ниже приведены примеры эфиров неорганических кислот:
| Кислота | Сложные эфиры | ||||
| Название | Формула | Название | Общая формула | Примеры | |
| Молекулярная | Структурная | ||||
| Фосфорная кислота | H 3 PO 4 |
Фосфорные эфиры
(фосфаты) |
(RO)
n
P(=O)(OH)
3-n
,
где n = 1-3 |

(случай n = 3 ) |
|
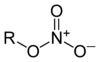
| Азотная кислота | HNO 3 |
Нитратные эфиры
(нитраты) |
(RО)N(=O)O |
|
|
| Азотистая кислота | HNO 2 |
Нитритные эфиры
(нитриты) |
(RO)N(=O) |
|
|
| Серная кислота | H 2 SO 4 | (R 1 O)S(=O) 2 (OR 2 ) |

|
|
|
| Сернистая кислота | H 2 SO 3 |
Сульфитные эфиры
(сульфиты) |
(R 1 O)S(=O)(OR 2 ) | ||
| Угольная кислота | H 2 CO 3 |
Угольные эфиры
(карбонаты) |
(R 1 O)C(=O)(OR 2 ) |

|
|
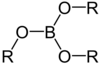
| Борная кислота | H 3 BO 3 |
Борные эфиры
(бораты) |
(RO) 3 B |
|
|
В таблице, в эфиров символом =О обозначена оксогруппа.