Амиды металлов
- 1 year ago
- 0
- 0
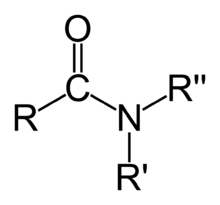

Ами́ды — производные кислородсодержащих кислот ( карбоновых либо минеральных ), в которых гидроксильная группа кислотного остатка заменена аминогруппой (незамещённой или замещённой). Амиды также можно рассматривать как ацилпроизводные аминов . Соединения с одним, двумя или тремя заместителями у атома азота называются первичными, вторичными и третичными амидами соответственно. Вторичные амиды также называют имидами .
Амиды карбоновых кислот — карбоксамиды RCO−NR 1 R 2 (где R 1 и R 2 — водород или другой остаток) — обычно называют просто амидами. В случае же других кислот, в соответствии с рекомендациями IUPAC , при именовании амида в качестве префикса указывается название класса кислоты, например амиды сульфокислот RSO 2 NH 2 называются сульфамидами . Аналоги амидов, формально являющиеся продуктами замещения кислорода на халькоген , называются тиоамидами , селеноамидами и теллуроамидами .
Название класса амидов происходит от названия аммиака . Золотая книга ИЮПАК делит амиды на первичные, вторичные и третичные в зависимости от числа остатков при атоме азота (ацильная группа — фрагмент, содержащий карбонильную (>C=O) и алкильную (R) группы, то есть фрагмент вида R—C=O). Однако ту же классификацию применяют и в тех случаях, если остатки не ацильные, а любые органические:
Если атом азота содержит две или три ацильные группы, такие соединения называют также имидами и триациламинами соответственно. Циклические амиды называют лактамами .
Названия первичных амидов образуют от названий соответствующих карбоновых кислот , добавляя к ним «-амид»:
Если атом азота дополнительно замещён, его заместители перечисляют в начале названия с приставкой «N» вместо локанта ( N,N-диметилформамид ) . Моноамиды дикарбоновых кислот называют с помощью окончания «-амовая кислота», например моноамид фталевой кислоты можно назвать .
Первичные и вторичные амиды представляют собой кристаллические вещества (за исключением жидких формамида и ); третичные амиды — жидкости. В воде хорошо растворяются лишь низшие алифатические амиды .

Строение амидной группы изучалось методом рентгеноструктурного анализа . Было показано, что в кристаллических амидах оно примерно одинаково. Амидная группа является плоской, атомы С', C, O, N лежат в одной плоскости, но атомы водорода при атоме азота не лежат в этой плоскости. Углы вокруг карбонильного атома углерода имеют следующие значения: α(С'-C=O) = 124°, α(С'-C-N) = 115°, α(N-C=O) = 121°. Длины связей равны: l (C'-C) = 1,52 Å, l (C=O) = 1,24 Å, l (C-N) = 1,34 Å. Определён также угол α(H-N-R) у вторичных амидов: он составляет 115°. Длины связей при атоме азота равны: l (N-H) = 0,95 Å, l (N-R) = 1,44 Å. В газовой фазе у амидов чуть укорочена связь C=O (с 1,24 до 1,19-1,21 Å) и удлинена связь C-N (с 1,34 до 1,36-1,37 Å); углы остаются примерно теми же .
Исследование ряда амидов как в твёрдой, так и в газовой фазе показало, что существует обратная связь между длинами связей C=O и С-N: при увеличении одной вторая укорачивается. Связывают это с тем, что атом азота в амидной группе находится в сопряжении с карбонильной группой и в реальную структуру вносят вклад две резонансные структуры А и В. С увеличением вклада полярной структуры В длина связи C=O увеличивается, а длина связи C-N уменьшается .

Из-за наличия системы сопряжения связь C-N имеет частично двоевязный характер, поэтому вращение вокруг неё затруднено и амиды могут существовать в виде цис/транс-изомеров . У вторичных амидов сильно преобладают транс -изомеры: небольшую долю цис -изомеров удалось обнаружить только в том случае, если группа R при карбонильном атоме углерода — это водород. Даже такой объёмный заместитель R' как трет -бутил предпочитал находиться рядом с кислородом, чем с менее объёмным водородом. У третичных амидов преимущественная конфигурация более очевидно связана со пространственными затруднениями .


В спектрах ЯМР протоны амидной группы дают сигнал в области 5—8 м. д. Поскольку вращение вокруг амидной связи затруднено, два атома водорода при атоме азота в амидах типа RCONH 2 дают два отдельных сигнала, не усредняясь даже при температурах выше комнатной. Например, в формамиде HCONH 2 протон, находящийся в цис -положении к атому кислорода группы С=О, является более экранированным. В N,N-диалкиламиды две алкильные группы также имеют различное магнитное окружение и дают отдельные сигналы. Например, в диметилформамиде HCONMe 2 более экранированной является также метильная группа, более близкая к атому кислорода. Химический сдвиг этих заместителей сильно зависит от растворителя; в ароматических растворителях их положение может меняться .
В ИК-спектрах амиды характеризуются двумя типами колебаний: колебаниями связи N-H выше 3000 см –1 и колебаниями связи C=O в области 1700—1600 см –1 .
| Соединение | Колебание N-H | Колебание C=O |
|---|---|---|
| первичные амиды | две полосы при 3500—3400 см –1 | две полосы: при 1690—1630 см –1 (амидная полоса I) и при 1620—1590 см –1 (амидная полоса II) |
| вторичные амиды | одна полоса при 3460—3420 см –1 | две полосы: при 1690—1630 см –1 (амидная полоса I) и при 1550—1510 см –1 (амидная полоса II) |
| третичные амиды | — | одна полоса при 1670—1630 см –1 (амидная полоса І) |
Амиды образуются при нагревании карбоновых кислот с аммиаком или первичными и вторичными аминами . Этот процесс возможен благодаря тому, что аммиак и амины являются более сильными нуклеофилами, чем вода и спирты. Пространственно затруднённые карбоновые в эту реакцию не вступают, хотя некоторые промышленно важные амиды, например сукцинимид и фталимид , получают именно так .
Наиболее вероятным механизмом этого превращения является механизм присоединения — отщепления, поскольку по такому механизму протекает обратная реакция гидролиза амидов. В случае дикарбоновых кислот промежуточно образуются их . Амиды нельзя проацилировать простым нагреванием с карбоновой кислотой, поскольку при этом происходит реакция переацилирования . Для аминокислот эта реакция осуществляется внутримолекулярно: при этом они превращаются в циклические амиды — лактамы . Например, при нагревании до 180 °С гамма-аминомасляная кислота даёт .
Универсальным методом получения амидов является ацилирование аммиака, первичных и вторичных аминов хлорангидридами и ангидридами карбоновых кислот , кетенами и сложными эфирами .

Большинство таких реакций протекает по механизму присоединения — отщепления. Согласно этому механизму, чем выше частичный положительный заряд на карбонильном атоме углерода, тем выше скорость реакции. Соответственно, ацилирующие реагенты можно расположить в ряд активности: RCOR < RCONR 2 < RCOOR < (RCO) 2 O < RCOHal < RCOBF 4 . Также скорость реакции зависит от нуклеофильности амина, которую условно можно связать с основностью амина: алкиламины > ариламины > амиды. Внутримолекулярное ацилирование происходит легче, чем межмолекулярное .
В реакции с хлорангидридами происходит выделение хлороводорода , поэтому в реакцию необходимо брать двойное количество амина, чтобы второй эквивалент связал этот хлороводород. Образующаяся аммониевая соль выпадает в осадок и фильтруется. Как следствие, максимальный выход амида из амина составляет 50 %. Как вариант, можно использовать другие органические и неорганические основания, чтобы повысить выход. Например, в реакции Шоттена — Баумана используется гидроксид натрия или гидроксид калия . Из органических оснований применяются пиридин , диметиланилин , триэтиламин и др.
Нитрилы можно в контролируемых условиях гидролизовать до амидов. Гидролиз протекает как в кислой, так и в щелочной среде. Например, ароматические амиды и амиды затруднённых карбоновых кислот получают гидролизом серной кислотой , поскольку для них стадия гидролиза до карбоновой кислоты протекает медленно. Для многих же незатрудённых нитрилов этот способ не подходит, потому что амид легко гидролизуется дальше. Также в качестве кислотных катализаторов используют соляную кислоту , фосфорную кислоту и трифторид бора .
Основный катализ для этих реакций использовался реже из-за дальнейшего гидролиза амида. Надёжным способом из этой группы является использование щелочного раствора пероксида водорода .
Также нитрилы можно превратить во вторичные амиды по реакции Риттера . В этом случае нитрилы алкилируются по атому азота карбокатионами , полученными из алкенов и концентрированной серной кислоты, давая вторичный амид . Эту реакцию можно провести, заменив алкены на соответствующие спирты .

Алкены и спирты, дающие в кислой среде вторичные карбокатионы, вступают в реакцию Риттера медленнее, чем те, которые дают третичные карбокатионы. Первичные спирты ввести в эту реакцию можно только в очень жёстких условиях. Также для генерирования карбокатионов использовали разветвлённые алканы и циклоалканы , алкилгалогениды и карбоновые кислоты .
В промышленности используется метод получения амидов через перегруппировку Бекмана . В этой реакции оксимы вводят в реакцию с минеральными кислотами , кислотами Льюиса или . В лабораторных условиях этот метод не применяется, однако на практике он полезен для перегруппировки жирноароматических кетонов, доступных благодаря реакции , а также для получения лактамов .

Существует ряд других перегруппировок, которые также приводят к амидам. Среди них , и др.
При действии горячей воды или водного пара амиды гидролизуются . Реакция протекает медленно, поскольку вода обладает низкой реакционной способностью по отношению к амидам: некоторые амиды даже перекристаллизовывают из неё. Гидролизу способствует щелочная либо кислая среда: в первом случае атаку на амид осуществляет более нуклеофильный гидроксид-ион OH - , а во втором случае амид протонируется по атому кислорода, из-за чего амидная группа становится более восприимчивой к атаке .
Почти все амиды гидролизуются в щелочной среде. Реакция ускоряется, если в амиде присутствуют электроноакцепторные группы , и замедляется при наличии пространственных затруднений. Катализ может осуществляться не обязательно протоном или гидроксид-ионом : возможен и общий кислотно-основный катализ .
Амиды устойчивы к восстановлению, и лишь сильные восстановители ( гидриды , натрий в жидком аммиаке и электролиз ) вступают с ними в реакции. При обработке первичных амидов алюмогидридом лития в диэтиловом эфире или тетрагидрофуране они восстанавливаются до первичных аминов. Аналогично, вторичные амиды дают вторичные амины, а третичные амиды — третичные амины. Лактамы в этих условиях дают циклические амины. Также в этих реакциях можно использовать диборан и электролиз .
N,N-Диалкиламиды можно контролируемо восстановить до альдегидов : в этом случае вместо алюмогидрида лития удобнее использовать более слабый восстановитель LiAlH(OEt) 3 , получаемый из LiAlH 4 и этанола . Также такое восстановление можно провести под действием гидрида диизобутилалюминия и натрия в жидком аммиаке .
Первичные амиды отщепляют воду, давая нитрилы , под действием хлористого тионила , оксалилхлорида и оксихлорида фосфора . Наилучшим вариантом считается использование хлористого тионила в ДМФА . Также с этой целью используют в присутствии пиридина .
Первичные амиды легко разлагаются на холоде раствором азотистой кислоты , при этом выделяется азот и образуется соответствующая карбоновая кислота . В практическом плане преимущество имеют RONO и NO + BF 4 - . Вторичные амиды, по аналогии с аминами, дают N-нитрозоамиды .
Первичные и вторичные амиды реагируют с NaOCl , NaOBr , давая соответствующие N-хлорамиды или N-бромамиды. Сами эти соединения являются селективными галогенирующими реагентами (типичным примером является N-бромсукцинимид ). Также N-галогенамиды в избытке щёлочи вступают в , отщепляя при этом молекулу CO 2 и давая амин, имеющий на один атом углерода меньше, чем исходный амид .
Металлоорганические соединения, такие как реактивы Гриньяра и алкиллитиевые реагенты, могут присоединяться к карбонильной группе амида. Такие реакции с первичными и вторичными амидами бесполезны, поскольку реагент взаимодействует с кислым протоном при атоме азота и превращается в соответствующий алкан . Третичные амиды дают с реактивами Гриньяра прочные продукты присоединения, которые при обработке водным раствором кислоты дают кетоны . Диметилформамид даёт соответствующий альдегид .
При использовании избытка реактива Гриньяра происходит формальное замещение карбонильного атома кислорода двумя алкильными группами .
Амиды обладают очень слабо выраженными кислотными и основными свойствами. Реагируя со щелочными металлами , они дают соли , легко разлагаемые водой. Некоторые соли тем не менее устойчивы (ртутная соль ацетамида используется при протравке зерна ). Амиды способны присоединять протон в присутствии сильной кислоты, образуя соли.
В промышленности амиды используются в качестве пластификаторов бумаги и искусственной кожи , для экстракции радиоактивных металлов, в качестве исходных соединений для синтеза полимеров , как промежуточные продукты в производстве красителей и .