Альтернативная оксидаза
- 1 year ago
- 0
- 0
| копропорфириноген III оксидаза | |
|---|---|
копропорфириноген III оксидаза из leishmania major . |
|
| Идентификаторы | |
| Символ | Coprogen_oxidas |
| Pfam | |
| Доступные структуры белков | |
| Pfam | |
| PDB | ; ; |
Копропорфириноген III оксидаза , сокр. КПГ-III-оксидаза (англ. Coproporphyrinogen-III oxidase , сокр. CPOX ) — фермент (КФ ) семейства оксидаз (класс оксидоредуктазы ), катализирующий реакцию окислительного декарбоксилирования копропорфориногена III в протопорфириноген IX . Схема реакции:
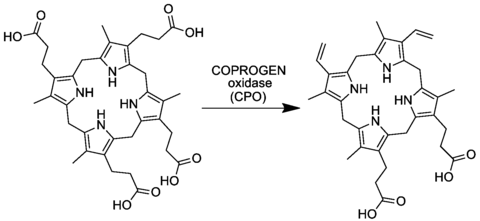
Фермент обнаружен во внутренней митохондриальной мембране клеток, он участвует в шестой по порядку реакции в биосинтезе гема . У человека ген, кодирующий КПГ-III-оксидазу — , локализован на длинном плече (q-плече) 3-й хромосомы . Полипептидная цепь фермента содержит 454 аминокислоты и имеет молекулярную массу — 50152 Да. Заболевание, связанное с дефектами гена CPOX , называется . Активность фермента КПГ-III-оксидазы, локализованного в митохондриальной мембране, измеряется в лимфоцитах .
Копропорфириноген III оксидаза человека представляет собой митохондриальный фермент, кодируемый геном CPOX размером 14 т.п.н., содержащим семь экзонов , расположенных на 3 хромосоме в локусе q11.2 .
CPOX экспрессируется как профермент массой 50 кДа и содержит аминоконцевой сигнал, направляющий белок внутрь митохондрии. После протеолитического процессинга белок присутствует в виде зрелой формы гомодимера с молекулярной массой 37 кДа .
Копропорфириноген III оксидаза — фермент, участвующий в шестой реакции метаболизма порфиринов , катализирующий окислительное декарбоксилирование копропорфириногена III до протопорфириногена IX в биосинтезе гема и хлорофилла . Белок представляет собой гомодимер, содержащий два внутренне связанных атома железа (Fe 2 ) на молекулу нативного белка . Фермент активен в присутствии молекулярного кислорода, который выступает в качестве акцептора электронов. Фермент широко распространён и обнаружен в различных эукариотических и прокариотических организмах.
Наследственная копропорфирия (НКП) и хардеропорфирия — это два фенотипически отдельных заболевания, которые связаны с частичным дефицитом CPOX. При НКП преобладает нейровисцеральная симптоматика. Кроме того, она может быть связана с болями в животе и/или фоточувствительностью кожи. В биохимических анализах регистрируется гиперэкскреция копропорфирина III в моче и кале . НКП — аутосомно-доминантное наследственное заболевание , в то время как хардеропорфирия — редкая эритропоэтическая вариантная форма НКП, наследуемая аутосомно-рецессивно. Клинически заболевание характеризуется неонатальной гемолитической анемией . Иногда у пациентов с хардеропорфирией также описывается наличие поражений кожи с выраженной фекальной экскрецией хардеропорфирина .
На сегодняшний день описано более 50 мутаций CPOX , вызывающих НКП . Большинство этих мутаций приводят к замене аминокислотных остатков в структурном каркасе фермента . По крайней мере 32 из этих мутаций считаются мутациями, вызывающими заболевания . Что касается молекулярной основы НКП и хардеропорфирии, мутации CPOX у пациентов с хардеропорфирией были обнаружены в области экзона 6, где также были выявлены мутации у пациентов с НКП . Поскольку только у пациентов с мутацией в этой области (K404E) развивается хардеропорфирия, данная мутация приводит к снижению второй стадии реакции декарбоксилирования при превращении копропорфириногена III в протопорфириноген IX, подразумевая, что активный сайт фермента, участвующего во второй стадии декарбоксилирования, расположен в экзоне 6 .
Было показано, что CPOX взаимодействует с атипичным кето-изокопропорфирином (KICP) у людей, подвергшихся токсическому воздействию ртути (Hg) .