Гуян
- 1 year ago
- 0
- 0
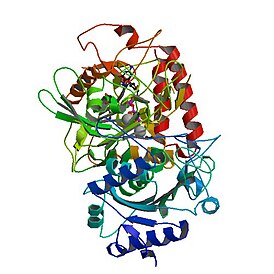
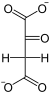
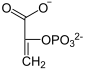
Фосфоенолпируваткарбоксикиназа , также ФЕП-карбоксикиназа (GTP-зависимая)( англ. Phosphoenolpyruvate carboxykinase , сокр. PEPCK ) — фермент (КФ ), из семейства декарбоксилаз (класс лиазы ), катализирующий реакцию декарбоксилирования-фосфорилирования молекул оксалоацетата с образованием фосфоенолпирувата , углекислого газа и GDP . В качестве источника неорганического фосфата фермент использует молекулы GTP , а кофактором могут служить ионы марганца — Mn 2+ . Схема реакции:
 +
GTP
+
GTP
 +
CO
2
+
GDP
+
CO
2
+
GDP
Данная реакция относится к так называемым «обходным реакциям» гликолиза. ФЕП-карбоксикиназа играет ключевую роль в процессе глюконеогенеза . Существует две изоформы фермента, цитозольная и митохондриальная. Ген, кодирующий митохондриальную форму фермента — (также PEPCK-M ) у человека локализован на длинном плече (q-плече) 14-й хромосомы . Ген цитозольной формы — или PEPCK-C располагается на длинном плече (q-плече) 20-й хромосомы . ФЕП-карбоксикиназа особенно активно экспрессируются в гепатоцитах (клетках печени), почках и адипоцитах (т.е. в клетках тканей с повышенной активностью глюконеогенеза). В отличие от PEPCK-M, активность PEPCK-C может регулироваться гормонами .
ФЕП-карбоксикиназа (митохондриальная) состоит из 640 аминокислотных остатков и имеет молекулярную массу — 70699 Да. Цитозольная форма содержит 622 аминокислоты и имеет молекулярную массу — 69195 Да. Мутации в генах PCK1 или PCK2 могут вызывать достаточно редкое заболевание — ФЕП-карбоксикиназную недостаточность.
ФЕП-карбоксикиназу [GTP] не следует путать с ATP-зависимой PEPCK, которая встречается в растениях и бактериях , но не в клетках животных .
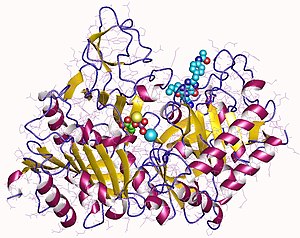
У человека присутствуют два изофермента ФЕП-карбоксикиназы: цитозольный (SwissProt P35558) и митохондриальный (SwissProt Q16822), которые имеют 63,4 % идентичности. Цитозольная форма играет важную роль в глюконеогенезе . Однако известен механизм переноса фосфоенолпирувата (PEP) из митохондрий в цитозоль с помощью специфических мембранных транспортных белков . В переносе PEP через внутреннюю митохондриальную мембрану участвует митохондриальный трикарбоксилатный транспортный белок и в меньшей степени переносчик адениновых нуклеотидов. Выдвигается также предположение о возможности существования транспортёра PEP/пирувата .
Рентгеновские структуры PEPCK дают представление о структуре и механизме каталитической активности PEPCK. Митохондриальная изоформа PEPCK из куриной печени в комплексе с ионами Mn 2+ , Mn 2+ -фосфоенолпируватом (PEP) и Mn 2+ -GDP даёт информацию о её структуре и о том, как этот фермент катализирует реакции . Delbaere et al. (2004 год) обнаружили PEPCK в клетках E. coli и выявили активный сайт, расположенный между C-концевым доменом и N-концевым доменом. Было обнаружено, что активный центр фермента закрывается при вращении этих доменов .
В процессе действия ФЕП-карбоксикиназы происходит перенос фосфорильных групп, чему, вероятно, способствует заслонённая конформация фосфорильных групп при связывании молекул ATP с ферментом .
Поскольку заслонённая конформация обладает высокой энергией, перенос фосфорильных групп имеет пониженную энергию активации, что означает эти группы будут переноситься с большей легкостью. Этот перенос, вероятно, происходит по механизму, аналогичному нуклеофильному замещению S N 2 .
Транскрипция гена PEPCK происходит у многих видов, и аминокислотная последовательность фермента у каждого вида своя.
Например, его структура и специфичность различаются у человека, кишечной палочки ( E. coli ) и паразита Trypanosoma cruzi .
Поскольку ФЕП-карбоксикиназа действует на стыке гликолиза и цикла Кребса , она вызывает декарбоксилирование молекулы оксалоацетата (C 4 ) с образованием молекулы PEP (C 3 ). В качестве первого обязательного этапа глюконеогенеза PEPCK декарбоксилирует и фосфорилирует оксалоацетат для его преобразования в PEP, в присутствии молекул GTP. При переносе фосфата в результате реакции образуется молекула GDP . В активном центре фермента имеется остаток аргинина и ионы двухвалентного марганца Mn 2+ . Кислород кетогруппы (C=O) оксалоацетата образует комплекс между аргинином и Mn 2+ и, таким образом, позволяет отщепить карбоксильную группу на более дальнем конце с образованием двойной связи . Затем фосфат переносится от GTP к кислороду. В то же время ионы Mn 2+ и аргинин также обеспечивают комплексообразование GTP в ферменте .
Когда пируваткиназа – фермент, который обычно катализирует реакцию, превращающая PEP в пируват — нокаутируется у мутантов Bacillus subtilis , PEPCK участвует в одной из замещающих анаплеротических реакций, действуя в направлении, противоположному нормального катализа, превращая PEP в оксалоацетат . Хотя эта реакция и возможна, кинетика настолько неблагоприятна, что мутанты растут очень медленно или вообще не растут .
Усиление экспрессии и активации PEPCK-С (цитозольная форма) происходит под действием многих факторов. Транскрипция гена PEPCK-C стимулируется глюкагоном , глюкокортикоидами , ретиноевой кислотой и аденозин-3',5'-монофосфатом (цАМФ), а инсулин (посредством ) её подавляет . Из этих факторов инсулин, гормон, дефицит которого наблюдается при сахарном диабете 1-го типа , считается доминирующим, поскольку он подавляет транскрипцию многих стимулирующих элементов . Активность PEPCK также ингибируется гидразинсульфатом , и это ингибирование снижает скорость глюконеогенеза .
При длительном ацидозе в клетках щёточной каймы проксимальных канальцев почек повышается активность PEPCK-C, что приводит к выделению большего количества аммиака NH 3 и, соответственно, к образованию большего количества гидрокарбонат ионов HCO 3 - .
ГТФ-специфическая активность PEPCK наиболее высока при наличии двухвалентных ионов — Mn 2+ и Mg 2+ . Кроме того, гиперреактивный цистеин (Cys307) фермента участвует в связывании Mn 2+ с активным сайтом .
Как уже говорилось ранее, при поливе растений хлористым аммонием с низким pH концентрация ФЭП-карбоксикиназы увеличивалась, хотя при высоком pH такого эффекта не наблюдалось
PEPCK-C (цитозольная форма) катализирует необратимый этап глюконеогенеза — процесс синтеза глюкозы. Поэтому считается, что этот фермент играет важную роль в гомеостазе глюкозы, что подтверждается на примере лабораторных мышей, заболевших сахарным диабетом 2-го типа в результате сверхэкспрессии гена PEPCK-C .
Роль PEPCK-C в глюконеогенезе может быть опосредована циклом лимонной кислоты , активность которого, как было установлено, напрямую зависит от количества PEPCK-C .
Уровни PEPCK-C сами по себе не сильно коррелировали с глюконеогенезом в печени мышей, как предполагали предыдущие исследования . В то время как печень мыши почти исключительно экспрессирует PEPCK-C, у людей в равной степени присутствует митохондриальный изофермент (PEPCK-M). PEPCK-M сам по себе обладает глюконеогенным потенциалом . Следовательно, роль PEPCK-C и PEPCK-M в глюконеогенезе может быть более сложной и включать больше факторов, чем считалось ранее.
ФЕП-карбоксикиназа (КФ ) — один из трёх ферментов декарбоксилирования, используемых в механизмах концентрирования неорганического углерода в растениях с C 4 -фотосинтезом и CAM . Другие — NADP-зависимая малатдегидрогеназа и NAD-зависимая малатдегидрогеназа (малик-фермент) . При фиксации углерода в С 4 -растениях углекислый газ сначала фиксируется путём присоединения к фосфоенолпирувату с образованием оксалоацетата в мезофилле . В растениях с С 4 -фотосинтезом оксалоацетат затем преобразуется ферментом PEPCK в аспартат , который поступает в проводящий пучок . В клетках проводящего пучка аспартат снова превращается в оксалоацетат. PEPCK декарбоксилирует оксалоацетат оболочки проводящего пучка, выделяя углекислый газ, который затем фиксируется ферментом Rubisco . На каждую молекулу углекислого газа, произведенную PEPCK, расходуется молекула ATP .
PEPCK активна в растениях, которые подвергаются фиксации углерода путём C 4 -фотосинтеза, где её действие локализовано в цитозоле , в отличие от млекопитающих, у которых было обнаружено, что PEPCK активна также в митохондриях .
Хотя ФЕП-карбоксикиназа обнаружена во многих частях растений, её активность была отмечена только в определённых типах клеток, в том числе в участках флоэмы .
Также было обнаружено, что в огурце ( Cucumis sativus L. ) концентрация PEPCK повышается под действием многочисленных эффектов, которые, как известно, снижают значение pH клеток растений, хотя эти эффекты специфичны для части растения .
Уровни PEPCK повышались в корнях и стеблях, когда растения поливали хлоридом аммония при низком значении pH (но не при высоком pH) или масляной кислотой . Однако уровни PEPCK в листьях в этих условиях не увеличивались.
В листьях, при 5%-ном содержание CO 2 в атмосфере, происходит увеличение количества ФЕП-карбоксикиназы .
В попытке изучить роль ФЕП-карбоксикиназы исследователи вызвали сверхэкспрессию гена PEPCK в бактериях E. coli с помощью рекомбинантной ДНК .
Было показано, что PEPCK Mycobacterium tuberculosis запускает иммунную систему у мышей, за счёт повышения активности цитокинов .
В результате было установлено, что PEPCK может быть подходящим компонентом для разработки эффективной субъединичной вакцины против туберкулёза .
PEPCK до недавнего времени не рассматривался в исследованиях рака . Было показано, что в образцах опухолей человека и линиях раковых клеток человека (клетки рака молочной железы , толстой кишки и лёгких ) PEPCK-M, а не PEPCK-C, экспрессировался на достаточных уровнях, чтобы играть соответствующую метаболическую роль . Таким образом, PEPCK-M может играть роль в раковых клетках, особенно при ограничении питательных веществ или других стрессовых условиях.