Химия
- 1 year ago
- 0
- 0
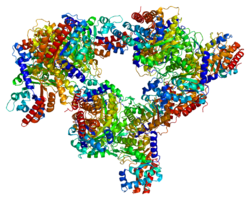
Альдолаза C , также фруктозо-бисфосфат альдолаза C или реже мозговой тип альдолазы (англ. Aldolase C , сокр. ALDOC ) — фермент (КФ ) из семейства фруктозо-1,6-бисфосфат альдолазы I типа (класс лиазы ), является одним из трёх изоферментов (A, B и C). Альдолаза С играет ключевую роль в углеводном обмене : в глюконеогенезе и гликолизе (в меньшей степени) в головном мозге и нервной ткани . Фермент катализирует обратимую реакцию альдольного расщепления (негидролитического) и конденсации молекулы фруктозо-1,6-бисфосфата по реакции:
В результате альдольного расщепления фруктозо-1,6-бисфосфата образуются два триозофосфата — дигидроксиацетонфосфат (ДАФ) и глицеральдегид-3-фосфат (ГАФ) соответственно .
Фермент экспрессируется во многих тканях, но преимущественно синтез фермента осуществляется в гиппокампе и клетках Пуркинье головного мозга. Альдолаза C закодирована геном , который у человека локализуется на длинном плече (q-плече) 17-й хромосомы .
Альдолаза C является одним из трёх изоферментов альдолазы (A, B и C), кодируемых тремя различными генами . Аминокислотная последовательность ALDOC очень похожа на последовательность других изоферментов, имея 68 % идентичности с ALDOB и 78 % идентичности с ALDOA . В частности, остатки Asp33, Arg42, Lys107, Lys146, Glu187, Ser271, Arg303 и Lys229 являются консервативными в активных сайтах всех трёх изоферментов. Этот активный сайт расположен в центре гомотетрамерной αβ-бочонковой структуры этих альдолаз. Однако ряд структурных деталей отличает ALDOC от других изоферментов. Так, остаток Arg303 в ALDOC принимает промежуточную конформацию между лигандированной и нелигандированной структурами, наблюдаемыми в других изоферментах. Кроме того, С-концевая область между Glu332 и Lys71 образует солевой мостик с бочкообразной областью, отсутствующий в изоформах А и В. Кроме того, электростатическая поверхность ALDOC более отрицательно заряжена, что может служить сайтом связывания кислот или сайтом стыковки для размещения С-концевых конформаций . Четыре специфических для ALDOC остатка (N90, V92, R96 и D100) могут быть ключевыми для специфических функций ALDOC .
Альдолаза C является ключевым ферментом на четвёртой стадии гликолиза, а также на обратном пути глюконеогенеза. Он катализирует обратимое превращение фруктозо-1,6-бисфосфата в глицеральдегид-3-фосфат (ГАФ), или глицеральдегид, и дигидроксиацетонфосфат (ДАФ) путём альдольного расщепления. В результате она является важнейшим участником биосинтеза АТФ . Будучи альдолазой, ALDOC, предположительно, выполняет и другие "подрабатывающие" функции (минорные), хотя её точное участие в них остаётся неясным . Например, она менее прочно связывается с цитоскелетом, чем другие изоферменты, что, вероятно, связано с её более кислым значением pI ( изоэлектрической точки ) . Кроме того, ALDOC участвует в стресс-реактивном пути функционирования эпителиальных клеток лёгких при гипоксии и в устойчивости клеток Пуркинье мозжечка к эксайтотоксическому воздействию .
Альдолаза С является убиквитарной и экспрессируется в большинстве тканей, хотя преимущественно её синтез протекает в головном мозге (гиппокамп, клетки Пуркинье мозжечка), гладких мышцах и нервной ткани . Однако, поскольку изоформа альдолазы А совместно экспрессируется с ALDOC в ЦНС , предполагается, что ALDOC вносит вклад в функционирование ЦНС, не связанное с гликолизом . Более того, её присутствие в других типах клеток, таких как тромбоциты и тучные клетки (мастоциты), может служить защитой на случай инактивации других преобладающих изоферментов альдолазы . Внутри клеток альдолаза C локализуется в цитозоле .
Эта альдолаза ассоциируется с раком .
В мозге больных шизофренией обнаружена повышенная экспрессия ALDOC . Примечательно, что если у мужчин, страдающих шизофренией, ALDOC экспрессируется в передней поясной коре (ППК), то у женщин с шизофренией, экспрессия не претерпевает существенных изменений, что указывает на возможное участие различных механизмов регуляции у мужчин и женщин, страдающих шизофрений. Вероятно, альдолаза C вовлечена в развитии шизофрении благодаря своей роли в гликолизе, который является одним из центральных биохимических путей при заболевании .
Кроме того, сообщается, что ALDOC подвергается окислению в мозге, поражённом лёгкими когнитивными нарушениями (MCI) и болезнью Альцгеймера (AD). Эта окислительная модификация ингибирует активность ALDOC, вызывая накопление фруктозо-1,6-бисфосфата и запускает обратную реакцию в направлении глюконеогенеза , а не гликолиза, таким образом останавливая синтез АТФ .