Interested Article - Альдолаза B
- 2020-10-09
- 1
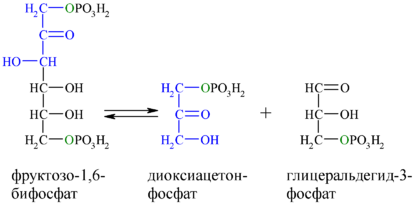
Альдолаза B , также фруктозо-бисфосфат альдолаза B или реже печёночный тип альдолазы (англ. Aldolase B , сокр. ALDOB ) — фермент (КФ ) из семейства фруктозо-1,6-бисфосфат альдолазы I класса (класс лиазы ), является одним из трёх изоферментов (A, B и C). Альдолаза B играет ключевую роль в углеводном обмене : в процессах гликолиза и глюконеогенеза , а также в метаболизме фруктозы . Фермент катализирует реакцию альдольного (негидролитического) расщепления связей C-C в молекуле фруктозо-1,6-бисфосфата (Ф-1,6-БФ) до дигидроксиацетонфосфата (ДАФ) и глицеральдегид-3-фосфата (ГАФ), обратную реакцию — альдольную конденсацию , а также расщепление фруктозо-1-фосфата на глицеральдегид и дигидроксиацетонфосфат, и их альдольную конденсацию во фруктозо-1-фосфат. Схема реакции, катализируемой альдолазой B:
-
фруктозо-1,6-бисфосфат
 дигидроксиацетонфосфат + глицеральдегид-3-фосфат
дигидроксиацетонфосфат + глицеральдегид-3-фосфат
-
фруктозо-1-фосфат
 дигидроксиацетонфосфат + глицеральдегид.
дигидроксиацетонфосфат + глицеральдегид.
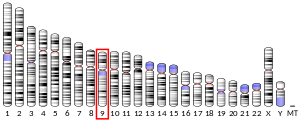
У млекопитающих (включая и человека) альдолаза B преимущественно экспрессируется в печени . Субстратная специфичность альдолазы В такова, что она примерно в одинаковом соотношении способна катализировать расщепление и конденсацию молекул, как фруктозо-1,6-бисфосфата , так и фруктозо-1-фосфата (до глицеральдегида и дигидроксиацетонфосфата ), в то же время альдолазы A и C , предпочитают первый субстрат (фруктозо-1,6-бисфосфат) . Различия в субстратной специфичности альдолазы B обусловлены структурными особенностями данного фермента, она закодирована другим геном. У человека ген, кодирующий альдолазу B — , локализован на длинном плече (q-плече) 9-й хромосомы . Ген имеет длину 14 500 пар оснований и содержит 9 экзонов . Дефекты этого гена были идентифицированы как причина .
Структура
Альдолаза B представляет собой гомотетрамерный фермент, состоящий из четырёх субъединиц с молекулярной массой 36 кДа и локальной симметрией 222. Каждая субъединица имеет молекулярную массу 36 кДа и содержит восьмицепочечный , который окружает лизин -229 (данная аминокислота, образует основание Шиффа , которое является ключевой для катализа ) .
Изофермент-специфические области
Несмотря на то, что большая часть общей структуры фермента альдолазы является консервативной для всех трёх изоферментов , было установлено, что четыре области общего фермента альдолазы сильно различаются между изоферментами. Такие области были названы изофермент-специфичными (ISR1-4). Считается, что именно эти участки придают изоферментам специфичность и структурные различия. Все ISR 1-3 находятся в экзоне 3 гена ALDOB . ISR 4 является наиболее вариабельным из четырёх и находится на с-концевой части белка .
ISR 1-3 обнаруживаются преимущественно в участках на поверхности фермента. Эти участки не перекрываются с активным сайтом, что указывает на то, что ISRs могут изменять субстратную специфичность изофермента на расстоянии или вызывать взаимодействие С-конца с активным сайтом . Согласно недавно выдвинутой теории, ISRs могут обеспечивать различную конформационную динамику фермента альдолазы, которая объясняет её специфичность .
Механизм катализа
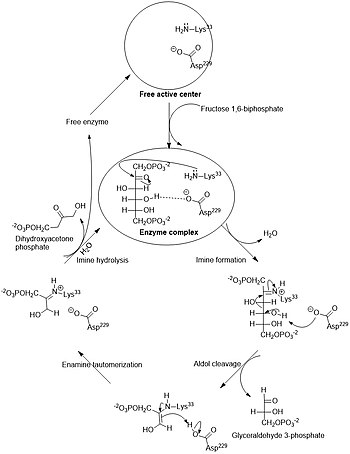
Общий фермент фруктозо-бисфосфат альдолаза расщепляет 6-углеродный сахар фруктозу на два 3-углеродных продукта в реакции ретроальдольной конденсации (обратная альдольной конденсации ). Для этой реакции характерно образование интермедиата (промежуточного соединения) основания Шиффа с остатком лизина (лизин-229) в активном сайте фермента; образование основания Шиффа является ключевым отличием альдолаз I типа (продуцируемых животными ) от альдолаз II типа (продуцируемых грибами и бактериями ). После образования основания Шиффа четвёртая гидроксильная группа на фруктозном остове депротонируется остатком аспартата (аспартат-33), что приводит к альдольному расщеплению. При гидролизе основания Шиффа образуются два трёхуглеродных продукта. В зависимости от реактанта, Ф-1-Ф или Ф-1,6-БФ, продуктами являются ДАФ и глицеральдегид или глицеральдегид-3-фосфат , соответственно .
ΔG°' этой реакции составляет +23,9 кДж/моль (реакция — эндергоническая ). Хотя эта реакция может показаться слишком сложной для протекания, следует отметить, что в физиологических условиях ΔG этой реакции падает до значения, близкого к нулю или ниже. Например, ΔG этой реакции в физиологических условиях в эритроцитах составляет -0,23 кДж/моль .
Физиология
Альдолаза В играет ключевую роль в углеводном обмене , поскольку катализирует один из основных этапов гликолитико-глюконеогенного пути. Хотя она катализирует расщепление глюкозы, особенно важную роль она играет в метаболизме фруктозы , который происходит в основном в печени , в корковом слое почек и слизистой оболочке тонкого кишечника. При всасывании фруктозы она фосфорилируется фруктокиназой с образованием фруктозо-1-фосфата (Ф-1-Ф). Затем альдолаза В катализирует распад Ф-1-Ф на глицеральдегид и дигидроксиацетонфосфат . После того как глицеральдегид фосфорилируется триозокиназой с образованием глицеральдегид-3-фосфата , оба продукта могут быть использованы в гликолитико-глюконеогенном пути, то есть модифицированы в глюкозу или пируват .
Хотя механизм регуляции альдолазы В неизвестен, было отмечено усиление транскрипции гена ALDOB в печени животных при увеличении количества углеводов в рационе и снижении концентрации глюкагона .
Патология
Мутации в гене ALDOB , приводящие к дефектам альдолазы В, вызывают заболевание, называемое . Из-за отсутствия функциональной альдолазы В организмы с наследственной непереносимостью фруктозы не могут должным образом утилизировать фруктозо-1-фосфат (Ф-1-Ф), что приводит к накоплению Ф-1-Ф в тканях организма. Высокий уровень Ф-1-Ф не только токсичен для клеток тканей, но и удерживает фосфат в непригодной для использования форме, которая не возвращается в общий фосфатный пул, что приводит к истощению запасов фосфатов и АТФ . Отсутствие легкодоступного фосфата приводит к прекращению гликогенолиза в печени, что приводит к гипогликемии . Такое накопление Ф-1-Ф также ингибирует глюконеогенез , что ещё больше снижает количество легкодоступной глюкозы . Потеря АТФ приводит к множеству проблем, включая подавление синтеза белка, печёночную и почечную дисфункцию. Однако в случаях наследственной непереносимости фруктозы прогноз пациентов благоприятный. Отказ от продуктов, содержащих фруктозу , сахарозу и сорбит , позволяет пациентам жить без симптомов .
Наследственная непереносимость фруктозы (ННФ) — врождённое заболевание с аутосомно-рецессивным типом наследованием . Идентифицировано около 30 мутаций, вызывающих ННФ, и их совокупность приводит к тому, что частота заболевания составляет 1 на каждые 20 000 рождений . Мутантные аллели являются результатом различных типов мутаций, включая замены пар оснований и небольшие делеции . Наиболее распространённой мутацией является A149P, представляющая собой трансверсию гуанина в цитозин в экзоне 5, в результате чего аланин в положении 149 заменяется на пролин . На долю этого специфического мутантного аллеля приходится 53 % аллелей ННФ . Другие мутации, приводящие к ННФ, встречаются реже и часто коррелируют с наследственным происхождением .
Примечания
- ↑ - Ensembl , May 2017
- ↑ - Ensembl , May 2017
- Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ↑ Dalby AR, Tolan DR, Littlechild JA (November 2001). "The structure of human liver fructose-1,6-bisphosphate aldolase". Acta Crystallogr. D . 57 (Pt 11): 1526—33. doi : . PMID .
- .
- Henry I, Gallano P, Besmond C, Weil D, Mattei MG, Turleau C, Boué J, Kahn A, Junien C (July 1985). "The structural gene for aldolase B (ALDB) maps to 9q13----32". Ann. Hum. Genet . 49 (Pt 3): 173—80. doi : . PMID . S2CID .
- Tolan DR, Penhoet EE (June 1986). "Characterization of the human aldolase B gene". Mol. Biol. Med . 3 (3): 245—64. PMID .
- Sygusch J, Beaudry D, Allaire M (November 1987). . Proc. Natl. Acad. Sci. U.S.A . 84 (22): 7846—50. doi : . PMC . PMID .
- ↑ Pezza JA, Choi KH, Berardini TZ, Beernink PT, Allen KN, Tolan DR (May 2003). . J. Biol. Chem . 278 (19): 17307—13. doi : . PMID .
- Pezza JA, Stopa JD, Brunyak EM, Allen KN, Tolan DR (November 2007). . Biochemistry . 46 (45): 13010—8. doi : . PMC . PMID .
- ↑ Biochemistry. — 4th. — Brooks/Cole, 2010.
- ↑ Inborn Metabolic Diseases. — Fourth Revised. — Springer Berlin Heidelberg, 2006.
- Gomez PF, Ito K, Huang Y, Otsu K, Kuzumaki T, Ishikawa K (November 1994). "Dietary and hormonal regulation of aldolase B gene transcription in rat liver". Arch Biochem Biophys . 314 (2): 307—14. doi : . PMID .
- Munnich A, Besmond C, Darquy S, et al. (March 1985). . J. Clin. Invest . 75 (3): 1045—52. doi : . PMC . PMID .
- Bouteldja N, Timson DJ (April 2010). "The biochemical basis of hereditary fructose intolerance". J. Inherit. Metab. Dis . 33 (2): 105—12. doi : . PMID . S2CID .
- Esposito G, Vitagliano L, Santamaria R, Viola A, Zagari A, Salvatore F (November 2002). . FEBS Lett . 531 (2): 152—6. doi : . PMID . S2CID .
- Malay AD, Allen KN, Tolan DR (March 2005). "Structure of the thermolabile mutant aldolase B, A149P: molecular basis of hereditary fructose intolerance". J Mol Biol . 347 (1): 135—44. doi : . PMID .
- Tolan DR (1995). . Hum. Mutat . 6 (3): 210—8. doi : . PMID . S2CID .
Внешние ссылки
- 2020-10-09
- 1