Реакция Вассермана
- 1 year ago
- 0
- 0
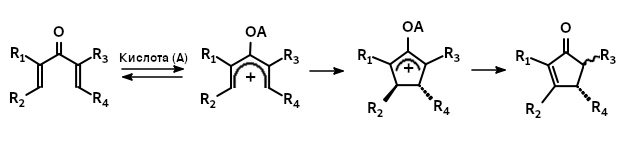
Реакция Назáрова — реакция циклизации дивинилкетонов в под действием кислот Льюиса или . Механизм этой реакции включает 4π- пентадиенильных катионных интермедиатов.
В англоязычной литературе известна как «циклизация Назарова» (Nazarov cyclization).
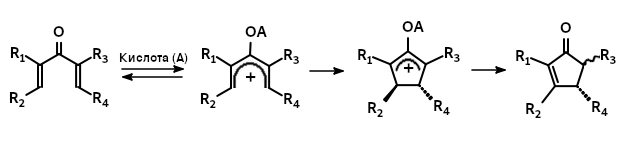
В 1941 г. в лаборатории Ивана Николаевича Назарова в ходе систематических исследований свойств винилацетиленов было обнаружено, что дивинилацетилены под действием солей ртути и растворов серной кислоты образуют не только предполагаемые продукты гидратации — аллилвинил- и дивинилкетоны (см. реакция Кучерова ), но и продукты их последующей циклизации — замещённые циклопентеноны. Оригинальная статья, в которой описана «циклогидратация» 5-метилгептадиен-1,5-ина-3 в 1,2,3-триметилциклопентен-2-он-5, была получена редакцией 12 июня 1941 г. и опубликована в 1942 г. В этой же работе было показано, что выход циклического продукта можно увеличить до 42 %, если проводить гидратацию данного углеводорода , нагревая до 50-60°С его бензольный раствор с фосфорной кислотой в течение 30 часов.
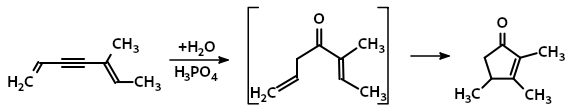
Строение полученного продукта циклизации доказано озонированием , в результате чего получены β-метиллевулиновая и уксусная кислоты.
Хотя реакция Назарова была описана более 80 лет назад, до начала XXI века её возможности практически не исследовались, вероятно, по причине низкой региоселективности циклизации при проведении её в классическом варианте. В последнее время, напротив, появились многочисленные работы, освещающие синтетический потенциал этого превращения, и разработано множество вариаций её проведения, устраняющих или минимизирующих известные недостатки.
После выяснения электроциклической природы реакция Назарова обрела прочный теоретический фундамент и огромное значение для синтетической органической химии, благодаря возможности создания в структуре циклического продукта новых , конфигурация которых определяется орбитальными взаимодействиями и может быть задана при введении в реакцию нужным образом замещённых исходных диенонов.
К настоящему времени реакция Назарова заслуженно считается не только удобным препаративным методом, но и одной из базовых органических реакций.
Реакцию Назарова катализируют сильные кислоты Брёнстеда или Льюиса, причём обычно необходим один или более эквивалент кислоты:
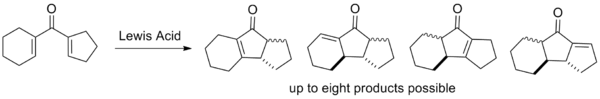
Селективность циклизации низка в случае, если боковые цепи имеют одинаковую степень замещения.
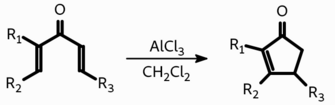
Введение в реакцию Назарова высокозамещённых субстратов приводит к продукту с наибольшим количеством заместителей при двойной связи:
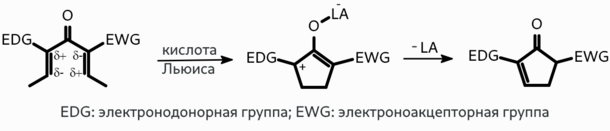
Электронодонорные и электроноакцепторные заместители могут поляризовать сопряжённую систему связей субстрата, что облегчает протекание циклизации и увеличивает региоселективность:
Механизм реакции Назарова оставался загадкой вплоть до 1960-х гг., когда японским химиком Кэнъити Фукуи была выдвинута концепция сохранения орбитальной симметрии. Детальные исследования показали, что реакция Назарова является электроциклической и протекает с участием 4 π-электронов по конротаторному механизму.
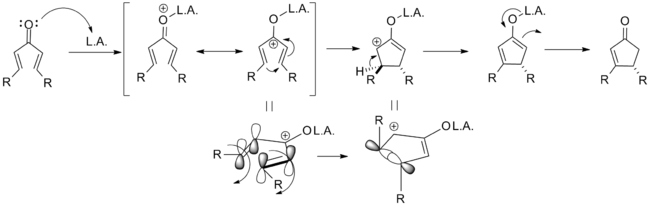
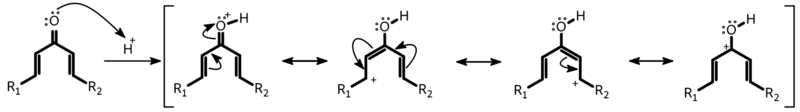
Координирование протона или кислоты Льюиса с атомом кислорода диенона вызывает образование пентадиенильного катиона, который претерпевает . В соответствии с принципом сохранения орбитальной симметрии, в результате конротаторной циклизации возникает оксиаллильный катион с анти-расположением заместителей R 1 и R 3 . Этот интермедиат в оригинальном варианте реакции Назарова отщепляет протон, образуя енолят, переходящий в конечный продукт, циклопентенон, в результате . Один из образующихся стереоцентров на стадии отщепления протона разрушается. В иных условиях (см. раздел Вариации) оксиаллильный интермедиат может присоединять нуклеофил или вовлекаться в карбокатионные перегруппировки.
В отсутствие стереохимического контроля реакция протекает с образованием равных количеств продуктов конротаторной циклизации по часовой и против часовой стрелки, в результате чего получается рацемическая смесь.
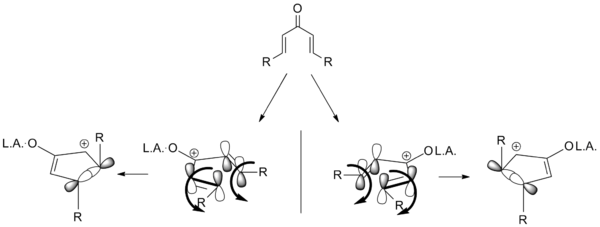
Проведение реакции Назарова возможно с широким кругом субстратов, имеющих разнообразные заместители. Это открывает путь к лёгкому синтезу функционализированных производных циклопентенона, включая циклопентеноны, конденсированные с неароматическими, ароматическими или гетероциклическими фрагментами структуры, из доступных исходных веществ.
Существует множество веществ, катализирующих реакцию Назарова; им посвящен отдельный обзор. Можно разделить катализаторы на следующие классы:
Кислоты Брёнстеда: фосфаты 1,1'-биc-2-нафтола ( ), трифторметансульфокислота , , трифлимид, о-бензолдисульфонимид, трифторуксусная кислота и др.
Кислоты Льюиса: триметилсилил трифлат, эфират трифторида бора, соли и комплексные соединения меди (II), саленовые комплексы ванадия (IV), хлорид алюминия, трифлат серебра, гексафторстибат (V) серебра, трифлаты скандия, индия, иттербия, железа (II), перхлораты кобальта (II) и железа (II), соли золота (I) и (III), серебра и др.
Гетерогенные катализаторы: фосфомолибденовая кислота, Амберлист 15, активированный силикагель, оксид алюминия (кислый, нейтральный или основный).
Органокатализаторы на основе тиомочевины.
В некоторых случаях реакция индуцируется ультрафиолетовым излучением.
Классический вариант циклизации Назарова имеет несколько недостатков, которые современные её вариации пытаются обойти. Первые два не очевидны из механизма, но указывают на барьеры для циклизации; последние три проистекают из проблем с селективностью, связанных с протонированием/отщеплением от интермедиата.
1. Для реакции обычно требуются сильные кислоты Льюиса или Брёнстеда (например, TiCl 4 , BF 3 , MeSO 3 H). Эти промоторы несовместимы с некоторыми лабильными функциональными группами, что ограничивает использование субстратов, имеющих в структуре такие функциональные группы.
2. Несмотря на вытекающую из механизма возможность катализа, для осуществления реакции часто требуется много эквивалентов промотора. Это ограничивает атом-экономичность реакции.
3. Стадия отщепления не является региоселективной; если для отщепления доступно несколько атомов водорода в неэквивалентных β-положениях, часто наблюдается образование смесей продуктов, что крайне нежелательно, поскольку обычно требуется трудоёмкое разделение.
4. Отщепление разрушает потенциальный стереоцентр, снижая желаемые стереохимические возможности реакции.
5. Протонирование енолята иногда не является стереоселективным, что означает, что продукты могут образовываться в виде смесей эпимеров.
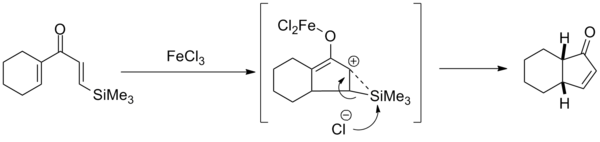
Один из современных вариантов реакции Назарова использует способность кремния стабилизировать β-карбокатионы, а также способность триалкилсилильных групп легко отщепляться от катиона под действием нуклеофилов. Это позволяет получать продукты с заданным расположением двойной связи в циклопентаноновом цикле.
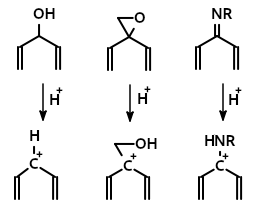
Пентадиенильный катион может быть получен как из дивинилкетонов, так и из других подходящих прекурсоров: ненасыщенных спиртов и их производных, оксиранов, иминов и др.
Любой пентадиенильный катион, вне зависимости от происхождения, способен вступать в реакцию Назарова. Так, например, дихлораллилциклопропаны под действием солей серебра образуют карбокатион, который после раскрытия циклопропильного цикла становится пентадиенильным и циклизуется.
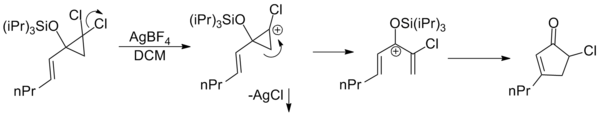
|
|
Этот раздел
не завершён
.
|
Еще одной важной вариацией является аза-реакция Назарова, представляющая собой удобный способ синтеза пятичленных азотсодержащих гетероциклических соединений, в особенности, замещенных пирролов. Исходными веществами для циклизации в данном случае являются имины. Например, в присутствии трифторметилсульфоновой кислоты происходит циклизация непредельных иминоспиртов. Имины могут образовываться и в ходе реакции из других соединений (например, из аминов и образующихся при окислении спиртов альдегидов) и без выделения вступать в реакцию Назарова.
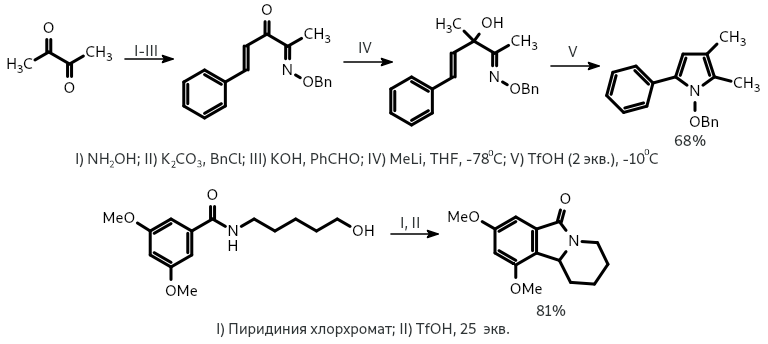
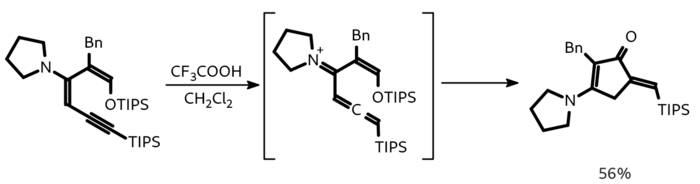
Использование дивинилиминов (или их синтетических эквивалентов) вместо дивинилкетонов позволяет получить циклопентенилимины или циклопентениламины. В отличие от аза-реакции, атом азота в данном случае не входит в образующийся циклопентеновый фрагмент. Первая реакция такого рода была описана только в 2001 году. Имино-реакции Назарова сравнительно мало исследованы, известно лишь несколько примеров.

Примером имино-реакции Назарова может служить образование аминоциклопентенов из аминодиенинов под действием трифторуксусной кислоты:
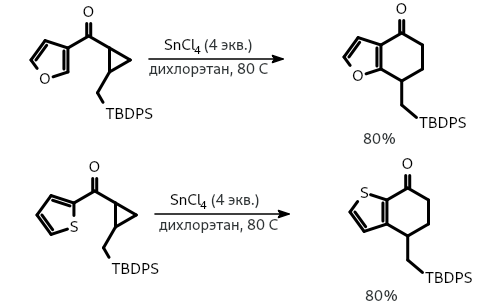
Поскольку известно, что циклопропильные фрагменты являются синтетическими эквивалентами двойных С=С связей, реакция Назарова была расширена на винилциклопропилкетоны. Так, циклизация фурилциклопропилкетонов и тиенилциклопропилкетонов под действием кислот Льюиса, таких как хлорид олова (IV), позволила получить конденсированные циклогексаноны.
Диенали и линейно сопряженные диеноны также способны вступать в реакцию Назарова, называемую в этом случае изо-реакцией Назарова. Так, было обнаружено, что некоторые диенали циклизуются под действием толуолсульфокислоты при комнатной температуре в соответствующие циклопентеноны:

Циклизоваться в присутствии кислот Льюиса способны и некоторые арилдиенилкетоны, причём в приведённом ниже случае это сопровождается миграцией толильной группы. Интересно, что при использовании подобных субстратов с более электронодонорными заместителями в ароматическом фрагменте протекает обычная циклизация Назарова, в результате которой образуются инданоны.
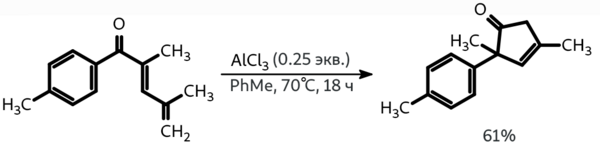
При обработке диеналей избытком хлорного железа был получен продукт изо-реакции Назарова, который превращается в более термодинамически устойчивый изомер при действии того же катализатора при пониженной температуре в течение двух суток:
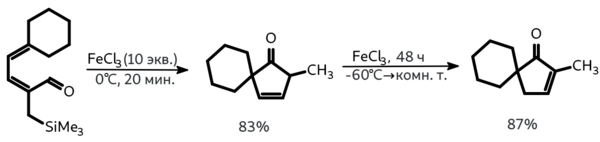
Прерванная реакция Назарова это последовательность превращений, включающая электроциклическое замыкание цикла диенона в циклопентенильный катион на первом шаге и атаку нуклеофила по этому катиону на втором. Нуклеофилами могут выступать электроноизбыточные алкены, ароматические соединения, различные N-нуклеофилы, О-нуклеофилы и галогены.
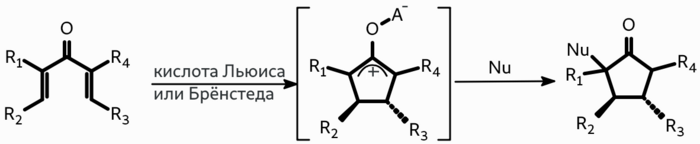
Первая прерванная реакция Назарова, описанная Форлендером (Vorländer) в 1903 году, заключалась в образовании дифенилоксициклопентенона из дибензилиденацетона в кислой среде в присутствии уксусного ангидрида:
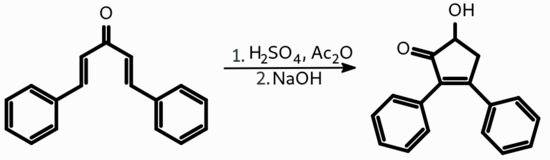
Прерванный вариант имеют также изо-, гомо-, азо- и имино-варианты реакции Назарова:
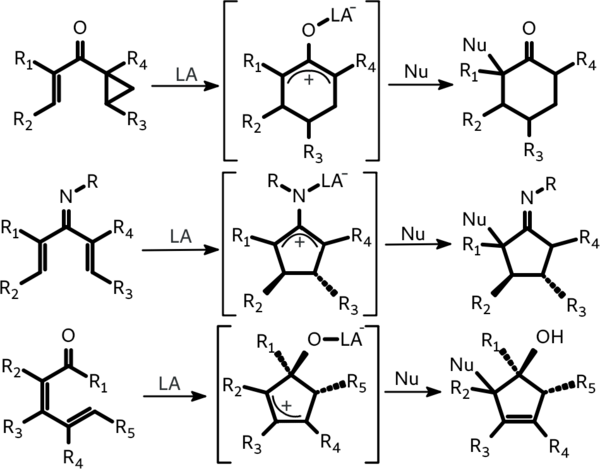
|
|
Этот раздел
не завершён
.
|
1. G. Ru, T. Zhang, M. Zhang, X. Jiang, Z. Wan, X. Zhu, W. Shen, G. Gao. Recent progress towards the transition-metal-catalyzed Nazarov cyclization of alkynes via metal carbenes // Organic & Biomolecular Chemistry. — 2021. — Vol. 19. — Pp. 5274-5283.
2. A. V. Yadykov, V. Z. Shirinian. Recent Advances in the Interrupted Nazarov Reaction // Advanced Synthesis & Catalysis. — 2020. — Vol. 362 — Pp. 702—723.
3. M. G. Vinogradov, O. V. Turova, S. G. Zlotin. Nazarov reaction: current trends and recent advances in the synthesis of natural compounds and their analogs // Org. Biomol. Chem. — 2017. — Pp. 8245-8269.
4. S. P. Simeonov, J. P. M. Nunes, K. Guerra, V. B. Kurteva, C. A. M. Afonso. Synthesis of Chiral Cyclopentenones // Chem. Rev. — 2016. — Vol. 116 — Pp. 5744-5893.
5. N. S. Sheikh. 4π Electrocyclisation in domino processes: contemporary trends and synthetic applications towards natural products // Org. Biomol. Chem. — 2015. — Vol. 13. — Pp. 10774-10796.
6. N. Jana, T. G. Driver. Assembly of functionalized carbocycles or N-heterocycles through a domino electrocyclization-[1,2] migration reaction sequence // Org. Biomol. Chem. — 2015. — Vol. 13 — Pp. 9720-9741.
7. D. R. Wenz, J. R. Alaniz. The Nazarov Cyclization: A Valuable Method to Synthesize Fully Substituted Carbon Stereocenters // Eur. J. Org. Chem. — 2015. — Pp. 23-37.
8. M. A. Tius. Allene ether Nazarov cyclization // Chem. Soc. Rev. — 2014. — Vol. 43. — Pp. 2979-3002.
9. M. J. Di Grandi. Nazarov-like cyclization reactions // Org. Biomol. Chem. — 2014. — Vol. 12. — Pp. 5331-5345.
10. F. de Nanteuil, F. De Simone, R. Frei, F. Benfatti, E. Serrano, J. Waser. Cyclization and Annulation Reactions of Nitrogen-Substituted Cyclopropanes and Cyclobutanes // Chem. Commun. — 2014. — Vol. 50. — Pp. 10912-10928.
11. W. T. Spencer III, T. Vaidya, A. J. Frontier. Beyond the Divinyl Ketone: Innovations in the Generation and Nazarov Cyclization of Pentadienyl Cation Intermediates // Eur. J. Org. Chem. — 2013. — Pp. 3621-3633.
12. N. Shimada, C. Stewart, M. A. Tius. Asymmetric Nazarov cyclizations // Tetrahedron — 2011. — Vol. 67. — Pp. 5851-5870.
13. T. Vaidya, R. Eisenberg, A. J. Frontier. Catalytic Nazarov Cyclization: The State of the Art // ChemCatChem — 2011. — Vol. 3. — Pp. 1531—1548.
14. A. Moyano, R. Rios. Asymmetric Organocatalytic Cyclization and Cycloaddition Reactions // Chem. Rev. — 2011. — Vol. 111. — Pp. 4703-4832.
15. W. Nakanishi, F. G. West. Curr. Opin. Drug Discovery Dev. — 2009. — Vol 12. — Pp. 732—751.
16. T. N. Grant, C. J. Rieder, F. G. West. Interrupting the Nazarov reaction: domino and cascade processes utilizing cyclopentenyl cations // Chem. Commun. — 2009. — Pp. 5676-5688.
17. H. Pellissier. Recent developments in the Nazarov process // Tetrahedron — 2005. — Vol. 61. — Pp. 6479-6517.
18. M. A. Tius. Some New Nazarov Chemistry // Eur. J. Org. Chem. — 2005. — Pp. 2193—2206.
19. A. J. Frontier, C. Collison. The Nazarov cyclization in organic synthesis. Recent advances // Tetrahedron — 2005. — Vol. 61. — Pp. 7577-7606.
20. M. Harmota. The Nazarov Reaction: Substituent Effects, Catalysis and Asymmetric Catalysis // Chemtracts — 2004. — Vol. 17. — Pp. 416—435.
21. K. L. Habermas, S. Denmark, T. K. Jones. The Nazarov Cyclization // Org. React. — 1994. — Vol. 45. — Pp. 1-158.
22. И. Н. Назаров. О механизме гидратации и циклизации диенинов // Успехи химии. — 1951. — Т. 20. — С. 71-103.