Interested Article - Гидразин
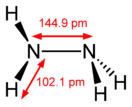
- 2020-05-22
- 2
Гидрази́н (диамин, диамид) H 2 N—NH 2 — неорганическое вещество , бесцветная, чрезвычайно токсичная , сильно гигроскопичная жидкость с неприятным запахом.
Молекула N 2 H 4 состоит из двух групп NH 2 , повёрнутых друг относительно друга, что обусловливает полярность молекулы гидразина, μ = 0,62⋅10 −29 Кл · м. Смешивается в любых соотношениях с водой , жидким аммиаком , этанолом ; в неполярных растворителях растворяется плохо. Образует органические производные: алкилгидразины и .
История открытия
Первое производное гидразина, а именно гидразобензол был получен Николаем Зининым в 1845 году, который восстановил азобензол сернистым натрием . Полученное вещество содержало фрагмент -NH-NH-. Тридцать лет спустя немецкие химики Эмиль и Отто Фишеры выделили фенилгидразин C 6 H 5 NHNH 2 , однако они не смогли заменить фенильную группу в нем на водород.
Обычно сообщается, что первооткрывателем гидразина является Теодор Курциус (1887) . Такая информация содержится в «Основах химии» Дмитрия Менделеева и «Истории химии» Микеле Джуа. Однако Курциус получил сульфат гидразина N 2 H 6 SO 4 , тогда как чистый гидразин был выделен только 1894 году французским химиком Лобре де Брином.
Получение
Основные способы
Гидразин получают окислением аммиака или мочевины гипохлоритом натрия (метод Рашига):
-
- ,
реакция проводится при температуре 160 °C и давлении 2,5—3,0 МПа. Повышенная температура и высокое содержание аммиака по отношению к гипохлориту позволяют свести к минимуму побочные реакции, а именно взаимодействие хлорамина с гидразином и дихлорамина с аммиаком. Выход гидразина можно существенно увеличить, если вводить клеевые добавки: глицерин, сахар, крахмал, декстрин (выход гидразина 40-50%) или казеин, альбумин (60-70%). Введение клея в сочетании с очень большим соотношением аммиака к гипохлориту позволяет довести выход гидразина до 75-80%. Рашиг считал, что добавки влияют на вязкость раствора, но позже было показано, что они связывают ионы некоторых металлов, которые катализируют побочную реакцию между хлорамином и гидразином, замедляющую целевой процесс. Содержание, например, ионов меди даже в концентрации 1 ppm сильно препятствует образованию гидразина, поэтому добавки необходимы. Наиболее эффективными из них являются желатин.
.
Синтез гидразина окислением мочевины гипохлоритом по механизму аналогичен синтезу аминов из амидов по Гофману:
-
- ,
реакция проводится при температуре ~100 °C и атмосферном давлении.
Применяется также метод Байера:
-
- .
Безводный гидразин
Указанные выше способы позволяют получить гидразин в виде водных растворов, которые являются непригодными для дальнейшего применения. Необходимо получить концентрированный или безводный гидразин. Для этого разбавленные растворы концентрируют физическими или физико-химическими методами .
- Дистилляция . Кипячением раствора гидразина можно удалить избыток воды, однако такой способ имеет ограничения, потому что при содержании гидразина в растворе выше 50% состав пара не отличается от состава жидкой фазы. Иными словами, гидразин и вода образуют азеотропную смесь. Иногда при дистилляции добавляют ацетон или ксилол, что позволяет повысить качество разделения.
- Вымораживание воды . При охлаждении раствора гидразина до температуры ниже 0°С возможно удаление воды вымораживанием. Однако этот метод трудоемок, потому что отделение льда от маточного раствора представляет определенные трудности.
- Дегидратация . Метод основан на том, что некоторые вещества могут связывать воду путем образования кристаллогидратов. Например, было предложено использовать для этой цели безводный сульфат натрия. Недостатками метода являются невысокая степень концентрирования и необходимость очистки раствора от избытка соли. Однако метод можно применять, когда раствор гидразина уже достаточно концентрированный.
- Экстракция . Подобрать растворитель для экстракции гидразина из воды очень трудно, потому что молекулы и гидразина, и воды имеют высокую полярность и образуют прочную связь друг с другом. Для экстракции предложен косвенный подход, когда альдегиды и кетоны связывают гидразин в неионные производные - гидразоны и альдазоны. Такие соединения затем экстрагируют бензолом, четыреххлористым углеродом, диэтиловым эфиром и другими. Также для экстракции применяют анилин.
- Осаждение солей . Гидразин может быть осажден в виде солей, например, сульфата N 2 H 4 ∙H 2 SO 4 или двойных солей MSO 4 (N 2 H 4 ) 2 SO 4 , где М - медь, никель, цинк, кадмий и кобальт.
Кислотно-основные свойства
Жидкий гидразин частично ионизирован на ионы гидразония и гидразида:
Благодаря наличию двух неподелённых пар электронов у атомов азота, гидразин способен к присоединению одного или двух ионов водорода. При присоединении одного протона получаются соединения гидразиния с зарядом 1+, двух протонов — гидразония с зарядом 2+, содержащие соответственно ионы N 2 H 5 + и N 2 H 6 2+ . Водные растворы гидразина обладают основными свойствами, но его основность значительно меньше, чем у аммиака:
(для аммиака K b = 1,78⋅10 −5 )
Протонирование второй неподеленной пары электронов протекает ещё труднее:
Химические свойства
Термодинамически гидразин значительно менее устойчив, чем аммиак, так как связь N—N не очень прочна: разложение гидразина — экзотермическая реакция, протекающая в отсутствие катализаторов при 200—300 °C:
Переходные металлы ( Co , Ni , Cu , Ag ) катализируют разложение гидразина. При катализе платиной , родием и палладием основными продуктами разложения являются азот и водород:
Реакция окисления гидразина хлором используется для удаления следов хлора из концентрированной соляной кислоты:
Энергично реагирует с фтором, причем смесь гидразина и фтора самовоспламеняется, а развивающаяся температура горения может достигать 4500К:
Окисляется кислородом воздуха, а также пероксидом водорода до азота и воды.
Щелочные металлы при растворении в гидразине образуют гидразиды MN 2 H 3 .
Известны соли гидразина — хлорид гидразиния N 2 H 5 Cl, сульфат гидразония N 2 H 6 SO 4 и т. д. Иногда их формулы записывают N 2 H 4 · HCl, N 2 H 4 · H 2 SO 4 и т. д. и называют гидрохлорид гидразина, сульфат гидразина и т. д. Большинство таких солей растворимо в воде.
Соли гидразина бесцветны, почти все хорошо растворимы в воде. К числу важнейших относится сульфат гидразина N 2 H 4 · H 2 SO 4 .
Гидразин — энергичный восстановитель . В растворах гидразин обычно также окисляется до азота:
-
- .
Восстановить гидразин до аммиака можно только сильными восстановителями, такими, как , , водородом в момент выделения ( ):
-
- .
Известны многие органические производные гидразина. Гидразин, а также гидразин-гидрат, гидразин-сульфат , гидразин-хлорид , широко применяются в качестве восстановителей золота , серебра , платиновых металлов из разбавленных растворов их солей. Медь в аналогичных условиях восстанавливается до закиси.
В органическом синтезе гидразин применяется для восстановления карбонильной группы альдегидов и кетонов до метиленовой по Кижнеру — Вольфу ( реакция Кижнера — Вольфа ), реакция идёт через образование гидразонов , расщепляющихся затем под действием сильных оснований.
Гидразин как растворитель
В гидразине хорошо растворимы галогениды щелочных металлов, причем растворимость растет при переходе от хлоридов к иодидам. При температуре 12-13°C в 100 г гидразина растворяется 8,15 г хлорида калия и 135,7 г иодида калия. Однако сульфаты, карбонаты и сульфиды имеют, как правило, низкую растворимость. Хорошо растворимы соли аммония. При растворении солей в гидразине происходит их гидразинация, то есть фактически сольватация:
Обнаружение
Качественной реакцией на гидразин служит образование окрашенных гидразонов с некоторыми альдегидами , в частности — с 4-диметиламинобензальдегидом .
Применение
Гидразин применяют в органическом синтезе , в производстве пластмасс , резины , инсектицидов , взрывчатых веществ , в качестве компонента ракетного топлива , как восстановитель при выделении золота из растворов.
Гидразин также применяется в качестве топлива в гидразин-воздушных низкотемпературных топливных элементах.
Жидкая смесь гидразина и нитрата аммония используется как мощное взрывчатое средство с нулевым кислородным балансом — астролит , который, однако, в настоящее время практического значения не имеет.
Антикоррозийный агент
Гидразин применяется как антикоррозионный агент в тех случаях, когда коррозия связана с поглощением кислорода. Его добавляют в воду для защиты от коррозии теплосилового оборудования и нефтеналивных танкеров. Для этой же цели могут использоваться соли-восстановители, например, сульфит натрия, но гидразин имеет перед ними то преимущество, что продукт его окисления в отличие от сульфита натрия не является солью и таким образом не приводит к росту концентрации солей в воде.
Гидразин широко применяется в химической промышленности в качестве восстановителя кислорода, содержащегося в деминерализованной воде, применяемой для питания котлов (котельные установки, производства аммиака, слабой азотной кислоты и другое). При этом протекает следующая химическая реакция:
-
- .
Металлические покрытия
Путем восстановления гидразином можно получать металлические покрытия, порошки и золи некоторых веществ. Получение металлических покрытий таким способом относится к классу химических методов. Его преимуществом является возможность равномерного осаждения металла на изделия со сложным профилем, мелкие детали и неметаллические поверхности, при этом покрытия являются менее напряженными, чем при гальваническом способе. Также они содержат минимальное количество примесей. Кроме того, гидразин применяют в качестве добавки к электролитам при нанесении гальванических покрытий с целью улучшения их качества.
Лекарство в онкологии
В 1960-х годах были обнаружены лекарственные свойства гидразин-сульфата, и с тех пор препараты на основе этого вещества применяются для лечения онкологических больных. Раковые заболевания сопровождаются нарушением метаболизма молочной кислоты, в результате чего молочная кислота не превращается в углекислоту, а может наоборот переходить в глюкозу, из которой она образуется. Нарушение углеводного обмена лишает клетку энергии и приводит к потере веса и истощению у раковых больных. Было показано, что гидразин-сульфат ингибирует фермент, ответственный за превращение молочной кислоты в глюкозу. Сообщается также, что гидразин-сульфат может останавливать рост опухолей и даже вызывать их распад .
Гидразина сульфат применяется в случае таких заболеваний, как неоперабельные прогрессирующие распространённые формы, рецидивы и метастазы злокачественных опухолей — рак лёгкого (особенно немелкоклеточный), молочных желёз , желудка , поджелудочной железы , гортани , эндометрия , шейки матки , десмоидный рак , саркома мягких тканей, фибросаркома , нейробластома , лимфогранулематоз , лимфосаркома (монотерапия или в составе полихимиотерапии ).
Ракетное топливо
Во время Второй мировой войны гидразин применялся в Германии в качестве одного из компонентов топлива для реактивных истребителей « Мессершмитт Ме-163 » ( C-Stoff , содержащий до 30 % гидрата гидразина).
Гидразин и его производные ( метилгидразин , несимметричный диметилгидразин и их смеси ( аэрозин )) широко распространены как ракетное горючее. Они могут быть использованы в паре с самыми разными окислителями, а некоторые и в качестве однокомпонентного топлива , в этом случае рабочим телом двигателя являются продукты разложения на катализаторе. Последнее удобно для маломощных двигателей.
| Окислитель | Удельная тяга (P1, с*) | Плотность топлива г/см³ | Прирост скорости, ΔVид, 25, м/с | Весовое содержание горючего % |
|---|---|---|---|---|
| Фтор | 364,4 с | 1,314 | 5197 м/с | 31 % |
| Тетрафторгидразин | 334,7 с | 1,105 | 4346 м/с | 23,5 % |
| ClF 3 | 294,6 с | 1,507 | 4509 м/с | 27 % |
| ClF 5 | 312,0 с | 1,458 | 4697 м/с | 26,93 % |
| Перхлорилфторид | 295,3 с | 1,327 | 4233 м/с | 40 % |
| Фторид кислорода | 345,9 с | 1,263 | 4830 м/с | 40 % |
| Кислород | 312,9 с | 1,065 | 3980 м/с | 52 % |
| Пероксид водорода | 286,9 с | 1,261 | 4003 м/с | 33 % |
| N 2 O 4 | 291,1 с | 1,217 | 3985 м/с | 43 % |
| Азотная кислота | 279,1 с | 1,254 | 3883 м/с | 40 % |
- Удельная тяга равна отношению тяги к весовому расходу топлива; в этом случае она измеряется в секундах (с = Н·с/Н = кгс·с/кгс). Для перевода весовой удельной тяги в массовую её надо умножить на ускорение свободного падения (примерно равное 9,81 м/с²). В ракетно-космической сфере для обозначения чаще используют термин «удельный импульс тяги» (выражаемый в м/с) или просто «удельный импульс» (в секундах). Выраженная в м/с, эта величина характеризует скорость истечения реактивной струи (приблизительно, с учётом дополнительного слагаемого в формуле тяги ЖРД). Удельный импульс является важнейшей характеристикой совершенства ракетных двигателей. Зависит от типа применяемой топливной пары, схемы и конструкции двигателя и других параметров.
Токсичность
Гидразин и большинство его производных очень токсичны по отношению к млекопитающим. На живые организмы гидразин оказывает общетоксическое действие. Небольшие концентрации гидразина вызывают раздражение глаз, дыхательных путей. При повышении концентрации начинается головокружение, головная боль и тошнота. Далее следуют судороги, токсический отёк лёгких, а за ними — кома с последующим летальным исходом. Рекомендуемая ПДК в воздухе рабочей зоны = 0,1 мг/м 3 .
Гидразин и зарегистрированные препараты на его основе относятся к 1-му и 2-му классу опасности (для человека).
Примечания
- ↑
- Hall H. K. (англ.) // / — ACS , 1957. — Vol. 79, Iss. 20. — P. 5441—5444. — ISSN ; ; —
- (англ.) : A CRC quick reference handbook — CRC Press , 1993. — ISBN 978-0-8493-4498-5
- Греков А.П., Веселов В.Я. // Химия и жизнь. — 1979. — № 7 . 13 апреля 2022 года.
- Волков В. А., Вонский Е. В., Кузнецова Г. И. Выдающиеся химики мира. — М. : ВШ, 1991. — С. 656.
- .
- Коровин Н.В. Гидразин. — М. : Химия, 1980. — С. 153.
- Зеленин К.Н. Гидразин // Соросовский образовательный журнал. — 1998. — № 5 . — С. 59-65 .
- ГОСТ 19503-88 Гидразин-гидрат технический
- name=
Литература
- Коровин Н. В. Гидразин. — М. : Химия, 1980. — 272 с., ил., табл.
- Ахметов Н. С. Общая и неорганическая химия. — 4-е изд., испр. — М. : Высшая школа, 2003. — 743 с. — ISBN 5-06-003363-5 .
- Карапетьянц М. Х. , Дракин С. И. Общая и неорганическая химия. Учебное пособие для вузов. — 4-е изд., стер. — М. : Химия, 2000. — 592 с., ил. — ISBN 5-7245-1130-4 ; ББК 540 К 21; УДК 546(075.8).
- Третьяков Ю. Д. и др. 15.3.3.1. Водородные соединения азота и их производные. Гидразин. Гидроксиламин. // Неорганическая химия. Химия элементов: Учебник для вузов. В 2 книгах. Кн. II / Ю. Д. Третьяков, Л. И. Мартыненко, А. Н. Григорьев, А. Ю. Цивадзе. — М. : Химия, 2001. — С. 869—872. — 583 с., ил. — ISBN 5-7245-1214-9 ; ББК 24.1 (я 7); УДК 546 Т 66.
- Одрит Л., Огг Б. Химия гидразина = The Chemistry of Hydrazine. — М. : ИИЛ , 1954. — 238 с., ил.
- 2020-05-22
- 2







![{\displaystyle {\mathsf {2N_{2}H_{4}\rightleftarrows N_{2}H_{5}^{+}+N_{2}H_{3}^{-},\ \ K=[N_{2}H_{5}^{+}][N_{2}H_{3}^{-}]=2,0\cdot 10^{-25}}}}](/images/005/008/5008084/19.jpg?rand=841344)
![{\mathsf {N_{2}H_{4}+H_{2}O\rightarrow [N_{2}H_{5}]^{+}+OH^{-},\ \ K_{b}=3,0\cdot 10^{{-6}}}}](/images/005/008/5008084/20.jpg?rand=156963)
![{\mathsf {[N_{2}H_{5}]^{+}+H_{2}O\rightarrow [N_{2}H_{6}]^{{2+}}+OH^{-},\ \ K_{b}=8,4\cdot 10^{{-16}}}}](/images/005/008/5008084/21.jpg?rand=12777)




![{\mathsf {N_{2}H_{4}+HCl\rightarrow [N_{2}H_{5}]Cl}}](/images/005/008/5008084/26.jpg?rand=538570)





![{\displaystyle {\mathsf {ZnSO_{4}+2N_{2}H_{4}\rightleftarrows [Zn(N_{2}H_{4})_{2}]SO_{4}}}}](/images/005/008/5008084/32.jpg?rand=812220)
![{\displaystyle {\mathsf {CoCl_{2}+3N_{2}H_{4}\rightleftarrows [Co(N_{2}H_{4})_{3}]Cl_{2}}}}](/images/005/008/5008084/33.jpg?rand=496629)













