Interested Article - Хлорид железа(III)

- 2020-07-29
- 1

Хлорид железа(III) (хлорное железо, также — трихлорид железа) FeCl 3 — средняя соль трёхвалентного железа и соляной кислоты , слабое амфотерное соединение.
Физические свойства

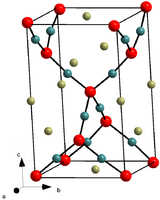
Мерцающие, черно-коричневые, либо темно-красные, либо фиолетовые в проходящем свете, зеленые в отраженном свете листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl 3 · 6Н 2 О — гигроскопичные жёлтые, по другим источникам желто-коричневые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли). T пл 309 °C.
Методы получения
- Самым простым методом получения трихлорида железа является действие на железные опилки или раскалённую железную проволоку газообразным хлором. При этом, в отличие от действия соляной кислоты , образуется соль трёхвалентного железа — выделяется бурый дым из мельчайших её частиц . Также можно получить трихлорид железа взаимодействием железа с хлором на свету. Так как молекулы хлора распадаются в присутствии света на высокореакционноспособные атомы-радикалы:
- Также трихлорид получается при окислении хлором хлорида железа(II) :
- Также существует метод окисления оксидом серы(IV) :
- Другим способом получения трихлорида железа (FeCl3) является взаимодействие оксида железа(III) с соляной кислотой , сопровождающееся выделением воды и энергии в виде тепла:
Химические свойства
- При нагревании в атмосферном давлении до температуры плавления начинается медленное разложение трихлорида железа с образованием дихлорида и молекулярного хлора :
- За счёт того, что трихлорид железа является сильной кислотой Льюиса , он вступает во взаимодействие с некоторыми другими хлоридами , при этом образуются комплексные соли тетрахлороферратной кислоты :
- При нагревании до 350 °C с оксидом железа(III) образуется оксохлорид железа :
- Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окисляет металлическую медь, переводя её в растворимые хлориды:
- реагирует с иодоводородом :
Восстанавливается сернистым газом, сульфитами и органическими спиртами:
Применение
- Хлорид железа(III) применяется при травлении печатных плат ( радиотехника , системотехника ).
- Используется для травления печатных форм ( офорт , цинкография ), как альтернатива азотной кислоте , реакция с которой сопровождается выделением высокотоксичных паров ( «лисий хвост» ).
- Используется в кузнечном деле для проявления рисунка железа.
- Применяется как при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
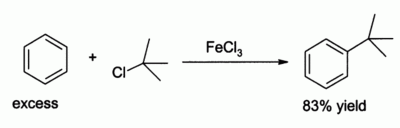
- За счёт чётко выраженных кислотных свойств широко применяется в качестве катализатора в органическом синтезе . Например, для реакции электрофильного замещения в ароматических углеводородах.
Безопасность
Хлорид железа(III) является токсичным, высококоррозионным соединением. Безводная соль служит осушителем.
На вкус представляет терпкую безвкусную массу. Язык приобретает сильную сухость и становится губкой.
См. также
Примечания
- от 4 марта 2016 на Wayback Machine — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 76. Хлор // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М. : Просвещение , 1987. — С. 184-187. — 240 с. — 1 630 000 экз.
- 2020-07-29
- 1





![{\displaystyle {\mathsf {FeCl_{3}+Cl^{-}\rightarrow [FeCl_{4}]^{-}}}}](/images/005/017/5017937/15.jpg?rand=539907)