Цианиды
- 1 year ago
- 0
- 0
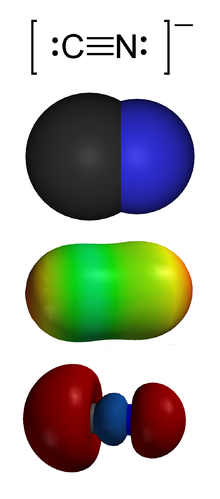
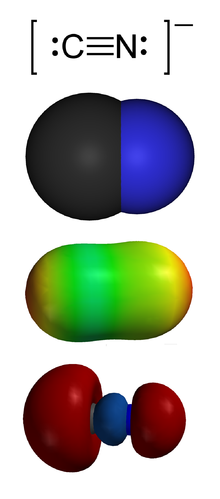
Циани́ды — соли цианистоводородной (синильной) кислоты . В номенклатуре IUPAC к цианидам относят также C-производные синильной кислоты — нитрилы .
Основой способ промышленного получения цианидов щелочных металлов — взаимодействие соответствующего гидроксида с синильной кислотой , которая получается в ходе метода Андрусова или метода BMA. В частности, это основной метод получения наиболее крупнотоннажного цианида — цианида натрия .
Другой промышленный метод получения цианида натрия — сплавление цианамида кальция с углём и хлоридом натрия либо карбонатом натрия с образованием цианплава :
Прочие цианиды получают в основном реакциями обмена цианидов щелочных металлов с соответствующими солями.
Цианиды щелочных металлов также могут быть получены в лаборатории взаимодействием металла с дицианом или гидроксида металла с синильной кислотой:
Цианиды также могут быть получены восстановлением цианатов или тиоцианатов щелочных металлов в присутствии, например, порошка магния или железа соответственно:
До изобретения промышленных способов получения цианидов, в Европе их получали пиролизом гексацианоферрата(II) калия . При проведении реакции на открытом воздухе могут выделиться различные вещества, среди которых: α- оксид железа(III) , оксид железа(II, III) , карбид железа , железо , оксид железа(II) , , β- метагидроксид железа , цианат калия , карбонат калия и цианид калия .
Для максимизации выхода цианида калия, безводный гексацианоферрат(II) калия сплавляли с карбонатом калия . Однако продукт был загрязнён некоторым количеством цианата калия
Цианиды щелочных и щёлочноземельных металлов — ионные соединения , хорошо растворимые в воде. Их водные растворы вследствие гидролиза имеют щелочную реакцию, и при использовании в промышленности в растворы цианидов щелочных металлов в качестве стабилизатора добавляют соответствующие гидроксиды . Цианиды щелочных металлов во влажном воздухе разлагаются с выделением синильной кислоты и образованием соответствующего карбоната .
При нагревании водные растворы ионных цианидов разлагаются с образованием формиата и аммиака :
Цианид-ион проявляет свойства восстановителя. Под действием даже мягких окислителей (в том числе при действии кислорода воздуха) цианиды щелочных металлов легко окисляются до цианатов :
Цианиды являются хорошими комплексообразователями. Так, они способы растворять многие металлы (например, серебро и золото ), создавать различные комплексные соединения . Это свойство используется в добыче благородных металлов :
Существуют различные комплексные соединения цианидов с металлами:
Сначала, цианиды взаимодействуют с железом(II) с образованием цианида железа(II) :
Цианид железа(II) растворим в избытке цианидов с образованием комплекса гексацианоферрата(II):
После этого, гексацианоферрат(II) взаимодействует с железом(III) с образованием осадка берлинской лазури характерного синего цвета:
Вся реакция проводится следующим образом: к нескольким капелям исследуемого раствора прибавляют 1 каплю соли железа(II) и 1 каплю сильного основания (NaOH, KOH), и ставят на водяную баню. После этого, прибавляют 1 каплю раствора соли железа(III). Положительной реакцией является выпадение синего осадка. Наличие гексацианоферратов (II) и (III) вызывают ложное срабатывание, то есть мешают проведению реакции .
Цианиды взаимодействуют с веществами, легко отдающими серу (например, с дисульфидом аммония) с образованием тиоцианатов :
После этого, тиоцианаты взаимодействуют с железом(III) с образованием тиоцианата железа(III) кроваво-красного цвета:
Реакцию проводят следующим образом: на водяной бане под тягой выпаривают несколько капель исследуемого раствора и дисульфида аммония. После охлаждения прибавляют несколько капель соляной кислоты и раствора железа(III). Реакция считается положительной, если появилось кроваво-красное окрашивание. Реакции мешают тиоцианаты .
Сульфид меди(II) полностью растворим в присутствии цианидов:
Данный способ может быть использован даже в присутствии тиоцианатов, гексацианоферратов и иных анионов . Реакцию проводят следующим образом: лист фильтровальной бумаги опускают в раствор сульфата тетраамминмеди(II) и высушивают. Перед испытанием, его вносят в атмосферу сульфида водорода , после чего она окрашивается в бурый цвет. На неё помещают каплю исследуемого раствора. Реакция считается положительной, в случае обесцвечивания участка фильтровальной бумаги, ибо комплекс тетрацианокупрата(I) бесцветен .

Все (неорганические) цианиды очень ядовиты. Цианиды в XX веке применялись как отравляющее вещество против грызунов в сельском хозяйстве. В начале XX века синильная кислота использовалась французами как боевое отравляющее вещество .
Цианид-анион является ингибитором фермента цитохром с-оксидаза (он же aa 3 ) в IV комплексе дыхательной цепи переноса электронов (у эукариот локализована на внутренней мембране митохондрий ). Анион синильной кислоты связывается с трёхвалентным железом, входящим в состав фермента, чем препятствует переносу электронов между цитохром с-оксидазой и кислородом. В результате нарушается транспорт электронов, и наступает клеточная гипоксия .
Наиболее токсичным и опасными цианидом является синильная кислота ввиду своей летучести, низкой молярной массы и возможности проходить сквозь кожные покровы как в жидкой, так и газообразной форме. Так, смертельная доза HCN составляет 1,0 мг/кг массы тела, а для цианидов натрия и калия - 1,8 мг/кг и 2,4 мг/кг массы тела соответственно .
В сточных водах предприятий промывные воды , в которых используются цианиды, относительно легко обезвреживаются с помощью окислителей. В связи с этим в 80-х — 90-х годах XX века был приостановлен массовый переход на «нецианистые электролиты» — оказалось, что несмотря на меньшую токсичность , они сложнее в обезвреживании и часто менее технологичны.
Наиболее часто применяются гипохлориты ( хлорная известь , гипохлорит натрия ), перманганат калия , оксид серы(IV) и пероксид водорода (конц.), которые переводят цианиды в менее опасные цианаты или вовсе разрушают соединение с образованием иных соединений азота и углерода:
Гипохлориты окисляют цианиды ступенчато. Сначала, цианиды переводятся в цианаты, которые подвергаются быстрому гидролитическому расщеплению с образованием гидрокарбонат-иона и аммиака, которой окисляется до азота. Суммарно реакция протекает следующим образом :
Катализаторами реакции с оксидом серы(IV) служат ионы меди(II), а кислород берётся из воздуха. Оптимальный pH реакции составляет 9 .
Помимо этого, в промышленности часто применяется метод связывания цианидов в безопасные комплексы, например, [Fe(CN)6] 4- . Для этого часто использует сульфат железа(II) :
Противоцианидные антидоты вводят внутривенно или перорально . Их можно разделить на три основных класса.
Первый — сахара (прежде всего глюкоза ), необратимо связывающие цианиды в нетоксичные циангидрины . Они постоянно присутствуют в крови, собственно, и обеспечивая максимальную несмертельную дозу в десятки миллиграммов.
Из второй группы можно назвать тиосульфат натрия , который реагирует с цианидами, превращая их в роданиды , которые также безвредны.
Третья группа антидотов — вещества, превращающие гемоглобин крови в метгемоглобин . Он не способен переносить кислород , но быстро связывает цианиды с образованием , который впоследствии выводится из организма. К этой группе относятся некоторые красители (например, метиленовый синий ), органические и неорганические нитриты .
Метгемоглобинобразователи наиболее эффективны из всех антидотов, так как действуют быстрее других, но в то же время они и опасны сами по себе: при их передозировке кровь теряет способность переносить кислород. Кроме того, реакция образования обратима , и со временем часть цианида будет высвобождаться обратно. Поэтому антидоты этой группы применяют обычно в сочетании с антидотами других групп. Особо эффективным антидотом из этой группы является изоамиловый эфир азотистой кислоты (также известен как амилнитрит), ибо он действует очень быстро и может быть использован практически моментально.
|
|
В статье
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|