Гидроксид титана(II)
- 1 year ago
- 0
- 0

Оксид титана(IV) ( диоксид титана , двуокись титана , титановые белила , пищевой краситель E171 ) TiO 2 — амфотерный оксид четырёхвалентного титана . Является основным продуктом титановой индустрии (на производство чистого титана идёт лишь около 5 % титановой руды) .
Оксид титана существует в виде нескольких модификаций. В природе встречаются кристаллы с тетрагональной сингонией ( анатаз , рутил ) и ромбической сингонией ( брукит ). Искусственно получены ещё две модификации высокого давления — ромбическая IV и гексагональная V.
| Модификация/Параметр | Рутил | Анатаз | Брукит | Ромбическая IV | Гексагональная V | |
|---|---|---|---|---|---|---|
| Параметры элементарной решётки, нм | a | 0,45929 | 0,3785 | 0,51447 | 0,4531 | 0,922 |
| b | — | — | 0,9184 | 0,5498 | — | |
| c | 0,29591 | 0,9486 | 0,5145 | 0,4900 | 0,5685 | |
| Число формульных единиц в ячейке | 2 | 4 | 8 | |||
| Пространственная группа | P4/mnm | I4/amd | Pbca | Pbcn | ||
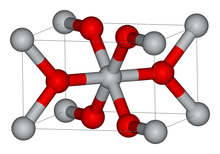
При нагревании и анатаз , и брукит необратимо превращаются в рутил (температуры перехода соответственно 400—1000 °C и около 750 °C). Основой структур этих модификаций являются октаэдры TiO 6 , то есть каждый ион Ti 4+ окружён шестью ионами O 2 − , а каждый ион O 2− окружён тремя ионами Ti 4+ .
Октаэдры расположены таким образом, что каждый ион кислорода принадлежит трём октаэдрам. В анатазе на один октаэдр приходятся 4 общих ребра, в рутиле — 2.
В чистом виде в природе встречается в виде минералов рутила , анатаза и брукита (по строению первые два имеют тетрагональную, а последний — ромбическую сингонию), причём основную часть составляет рутил.
Третье в мире по запасам рутила месторождение находится в Рассказовском районе Тамбовской области . Крупные месторождения находятся также в Чили (Cerro Bianco), канадской провинции Квебек , Сьерра-Леоне .

Чистый диоксид титана — бесцветные кристаллы (желтеют при нагревании). Для технических целей применяется в раздроблённом состоянии, представляя собой белый порошок. Не растворяется в воде и разбавленных минеральных кислотах (за исключением плавиковой ).
Температура плавления, кипения и разложения для других модификаций не указана, так как они переходят в рутильную форму при нагревании (см. ).
| Модификация | Интервал температуры, K | |||||
|---|---|---|---|---|---|---|
| 298—500 | 298—600 | 298—700 | 298—800 | 298—900 | 298—1000 | |
| рутил | 60,71 | 62,39 | 63,76 | 64,92 | 65,95 | 66,89 |
| анатаз | 63,21 | 65,18 | 66,59 | 67,64 | 68,47 | 69,12 |
| Модификация | ΔH° f, 298 , кДж/моль | S° 298 , Дж/моль/K | ΔG° f, 298 , кДж/моль | C° p, 298 , Дж/моль/K | ΔH пл. , кДж/моль |
|---|---|---|---|---|---|
| рутил | -944,75 (-943,9 ) | 50,33 | -889,49 (-888,6 ) | 55,04 (55,02 ) | 67 |
| анатаз | -933,03 (938,6 ) | 49,92 | -877,65 (-888,3 ) | 55,21 (55,48 ) | 58 |
Вследствие более плотной упаковки ионов в кристалле рутила увеличивается их взаимное притяжение, снижается фотохимическая активность, увеличиваются твёрдость (абразивность), показатель преломления (2,55 — у анатаза и 2,7 — у рутила), диэлектрическая постоянная .
Диоксид титана амфотерен , то есть проявляет как осно́вные, так и кислотные свойства (хотя реагирует главным образом с концентрированными кислотами).
Медленно растворяется в концентрированной серной кислоте, образуя соответствующие соли четырёхвалентного титана:
При сплавлении с оксидами, гидроксидами, карбонатами образуются — соли титановой кислоты (амфотерного гидроксида титана TiO(OH) 2 )
C пероксидом водорода даёт ортотитановую кислоту :
При нагревании с аммиаком даёт нитрид титана :
При нагревании восстанавливается углеродом и активными металлами ( Mg , Ca , Na ) до низших оксидов.
При нагревании с хлором в присутствии восстановителей (углерода) образует тетрахлорид титана .
Нагревание до 2200 °C приводит сначала к отщеплению кислорода с образованием синего Ti 3 O 5 (то есть TiO 2 Ti 2 O 3 ), а затем и тёмно-фиолетового Ti 2 O 3 .
Гидратированный диоксид TiO 2 n H 2 O [гидроксид титана(IV), оксо-гидрат титана, оксогидроксид титана] в зависимости от условий получения может содержать переменные количества связанных с Ti групп ОН, структурную воду, кислотные остатки и адсорбированные катионы. Полученный на холоде свежеосаждённый TiO 2 n H 2 O хорошо растворяется в разбавленных минеральных и сильных органических кислотах, но почти не растворяется в растворах щелочей. Легко пептизируется с образованием устойчивых коллоидных растворов .
При высушивании на воздухе образует объёмистый белый порошок плотностью 2,6 г/см³, приближающийся по составу к формуле TiO 2 2H 2 O (ортотитановая кислота). При нагревании и длительной сушке в вакууме постепенно обезвоживается, приближаясь по составу к формуле TiO 2 H 2 O (метатитановая кислота). Осадки такого состава получаются при осаждении из горячих растворов, при взаимодействии металлического титана с HNO 3 и т. п. Их плотность ~ 3,2 г/см³ и выше. Они практически не растворяются в разбавленных кислотах, не способны пептизироваться.
При старении осадки TiO 2 n H 2 O постепенно превращается в безводный диоксид, удерживающий в связанном состоянии адсорбированные катионы и анионы. Старение ускоряется кипячением суспензии с водой. Структура образующегося при старении TiO 2 определяется условиями осаждения. При осаждении аммиаком из солянокислых растворов при рН < 2 получаются образцы со структурой рутила, при рН 2—5 — со структурой анатаза, из щелочной среды — рентгеноаморфные. Из сульфатных растворов продукты со структурой рутила не образуются.
Кроме того, под воздействием ультрафиолетовых лучей способен разлагать воду и органические соединения.
Регистрационный номер ООН — UN2546
TLV (предельная допустимая концентрация): как TWA (средневзвешенная во времени концентрация, США) — 10 мг/м³ A4 (ACGIH 2001).
ПДК в воздухе рабочей зоны — 10 мг/м³ (1998)
IARC (МАИР) относит оксид титана к (потенциально канцерогенный) в случае вдыхания наночастиц .
Оценки безопасности пищевой добавки E171 (Оксид титана) со стороны (European Food Safety Authority): был разрешён к пищевому применению до 2022 года директивой 94/36/EEC (в отдельных формах) , ADI не установлен, 2250 мг/кг .
В конце 2010-х появилось несколько публикаций INRA об исследовании оксида титана на мышах или на малом числе пациентов. Агентство EFSA направило авторам статей ряд вопросов и не нашло причин для переоценки рисков на основании данных публикаций, остаётся в силе мнение 2016 года .
В США по данным FDA допускается использование красителя — пищевой добавки E171 (Оксид титана) в пищевых продуктах (на уровне не более 1 % по массе), в косметике, в составе лекарственных препаратов , что подтверждается CFR Title 21 (Food and Drugs) Chapter I Subchapter A Part 73 (LISTING OF COLOR ADDITIVES EXEMPT FROM CERTIFICATION) — § 73.575 Titanium dioxide.
C 2020 года запрещена во Франции . В 2021 году Европейское агентство по безопасности продуктов питания постановило, что в связи с новыми данными о наночастицах диоксид титана «более не может рассматриваться в качестве безопасной пищевой добавки», его генотоксичность , которая может вести к канцерогенным эффектам, не может сбрасываться со счетов, а «безопасный уровень дневного потребления этой пищевой добавки невозможно установить». Европейский комиссар по здравоохранению анонсировал планы по запрету его использования на территории Европейского Союза
По данным Роспотребнадзора пищевая добавка E171 разрешена для применения на территории России
Мировое производство диоксида титана на конец 2004 года достигло приблизительно 5 миллионов тонн .
Основные производители и экспортёры диоксида титана:
В последние годы чрезвычайно быстро растёт производство диоксида титана в Китае .
Сумской государственный институт минеральных удобрений и пигментов (МИНДИП) в своих научно-исследовательских работах особое место уделяет технологиям получения оксида титана (IV) сульфатным способом: исследование, разработка новых марок, модернизация технологии и аппаратурного оформления процесса.
Существуют два основных промышленных метода получения TiO 2 : из ильменитового (FeTiO 3 ) концентрата и из тетрахлорида титана . Поскольку запасов ильменита для удовлетворения нужд промышленности явно недостаточно, значительная часть TiO 2 производится именно из тетрахлорида титана.
Первый завод по производству титановых белил из природного титанового минерала ильменита FeTiO 3 был построен в Норвегии в 1918 г., однако первые промышленные партии белил имели жёлтый цвет из-за примесей соединений железа и плохо подходили для живописи , так что фактически белые титановые белила стали использоваться художниками лишь в 1922—1925 гг. При этом следует указать, что до 1925 г. были доступны лишь композитные титановые пигменты на базе барита или кальцита .
До 1940-х гг. двуокись титана выпускалась в кристаллической модификации — анатаз (β-TiO 2 ) тетрагональной сингонии с показателем преломления ~2,5
Технология производства состоит из трёх этапов:
В 1938—1939 гг. способ производства изменился — появился так называемый хлорный метод производства белил из тетрахлорида титана , благодаря чему титановые белила стали выпускаться в кристаллической модификации рутил (α-TiO 2 ) — также тетрагональной сингонии , но с другими параметрами решётки и несколько бо́льшим по сравнению с анатазом показателем преломления 2,61.
Существуют три основных метода получения диоксида титана из его тетрахлорида:
Основные применения диоксида титана:
| 2001 г. | 2002 г. | 2003 г. | 2004 г. | |
|---|---|---|---|---|
| Америка | 1730 | 1730 | 1730 | 1680 |
| Западная Европа | 1440 | 1470 | 1480 | 1480 |
| Япония | 340 | 340 | 320 | 320 |
| Австралия | 180 | 200 | 200 | 200 |
| Прочие страны | 690 | 740 | 1200 | 1400 |
| Всего | 4380 | 4480 | 4930 | 5080 |
Другие применения — в производстве резиновых изделий, стекольном производстве (термостойкое и оптическое стекло), как огнеупор (обмазка сварочных электродов и покрытий литейных форм), в косметических средствах (мыло и т. д.), в фармакологической промышленности в качестве пигмента и наполнителя некоторых лекарственных форм ( таблетки и т.д.), в пищевой промышленности ( пищевая добавка E171 ) .
Используется в процессах очистки воздуха методом фотокатализа .
Ведутся исследования по использованию диоксида титана в фотохимических батареях — ячейках Гретцеля , в которых диоксид титана, являющийся полупроводником с широкой запрещённой зоной 3-3,2 эВ (в зависимости от кристаллической фазы) и развитой поверхностью, сенсибилизируется органическими красителями .
7 февраля 2022 года в ЕС вступил запрет на использовании диоксида титана (E171) в пищевой промышленности. Переходный период продлится 6 месяцев. Применение диоксида титана в фармацевтической промышленности пока сохранится в связи с отсутствием альтернативных веществ.
Цены на диоксид титана отличаются в зависимости от степени чистоты и марки. Так, особо чистый (99,999 %) диоксид титана в рутильной и анатазной форме стоил в сентябре 2006 года 0,5—1 доллара за грамм (в зависимости от размера покупки), а технический диоксид титана — 2,2—4,8 доллара за килограмм в зависимости от марки и объёма покупки.