Дисульфид дицезия
- 1 year ago
- 0
- 0
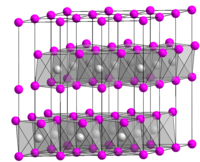
Дисульфи́д тита́на — неорганическое соединение , соль переходного металла титана и сероводородной кислоты с формулой TiS 2 , относится к группе дихалькогенидов переходных металлов .
При обычных условиях — золотисто-жёлтые кристаллы со слабым запахом сероводорода , не растворимые в воде, реагирует с горячей водой с выделением сероводорода.
Применяется в качестве катодной массы электрохимических источников тока и аккумуляторов и в качестве твёрдого смазочного материала .
Синтезом из элементов:
Нагреванием смеси паров тетрахлорида титана и сероводорода при высокой температуре, эта реакция пригодна для формирования тонких плёнок вещества на какой-либо подложке, реакция протекает в две стадии:
суммарная реакция:
Действием сероводорода на элементарный титан при высокой температуре:
Дисульфид титана образуется также при действии расплавленной серы на при 120°С:
Действием сероводорода на тетрафторид титана при температуре красного каления:
Дисульфид титана образуется при восстановлении сульфата титана(IV) водородом :
Вместе с примесями дисульфид титана получается при пропускании очень медленного тока паров сероуглерода над нагретым спрессованным и высушенным диоксидом титана :
Дисульфид титана также образуется при восстановлении сульфата титана(IV) водородом:
Разлагается при сильном нагревании без доступа воздуха:
Восстанавливается при нагревании в атмосфере водорода сначала до степени окисления +3, а затем до степени окисления +2:
Реагирует с расплавленными щелочами , пример реакции с гидроксидом калия с образованием титаната калия и сульфида калия :
При нагревании реагирует с углекислым газом :
При комнатной температуре диоксид титана устойчив к атмосферным воздействиям, но при умеренном нагревании на воздухе начинает окисляться до диоксида титана и диоксида серы . При сильном нагреве загорается:
При реакции с горячей концентрированной серной кислоты образуется сульфат титанила , элементарная сера, сернистый газ и вода:
При взаимодействии с холодной концентрированной азотной кислотой образует , серу, диоксид азота и воду:
Реакция взаимодействия с концентрированной соляной кислотой образует и сероводород:
Воcстановление активным металлом до элементарного титана в инертной атмосфере, например, в аргоне , активный металл окисляется до соответствующего сульфида:
Дисульфид титана при обычных условиях представляет собой золотисто-жёлтые, «бронзового» цвета чешуйчатые мелкие кристаллы, крупные кристаллы имеют золотистый цвет с зеленоватым оттенком, в мелкодисперсном виде после возгонки — бурый порошок . Диамагнетик .
Из-за взаимодействия с парами воды воздуха имеет слабый запах сероводорода. Не растворяется в холодной воде. Медленно реагирует с горячей водой. Огнеопасен, при сильном нагреве на воздухе загорается, выделяя диоксид серы .
Кристаллизуется в тригональной сингонии , пространственная группа P 3 m 1, параметры ячейки a = 0,3397 нм , c = 0,5691 нм , Z = 1 . Имеет слоистую кристаллическую структуру типа иодида кадмия .
При 1470 °C дисульфид претерпевает полиморфное превращение .
Атомы серы пространственно расположены в гексагональной плотной упаковке . Через каждые 2 плоских слоя атомов серы расположен плоский слой атомов титана, находящихся в октаэдрических полостях. Силы сцепления Ван-дер-Ваальса между двумя соседними слоями атомов серы малы и между слоями может происходить лёгкое скольжение, подобно скольжению слоёв атомов углерода в кристалле графита .
Теплоемкость дисульфида титана при 25 °C составляет 16,23 кал/(К·моль) или 55,4 Дж/(К·моль).
Стандартная теплота образования дисульфида титана составляет 80 ккал/моль.
Плотность дисульфида титана при 25 °C равна 3,22 г/см 3 .
Дисульфид титана является полупроводником с электронным типом проводимости c концентрацией носителей заряда ~10 21 см 3 и имеет высокую электропроводность характерную для полуметаллов .
Высокая электропроводность наряду с другими его свойствами обуславливает применение вещества в катодных массах литий-ионных аккумуляторов . Для увеличения электропроводности катодной массы в аккумуляторах его смешивают с сажей или графитом .
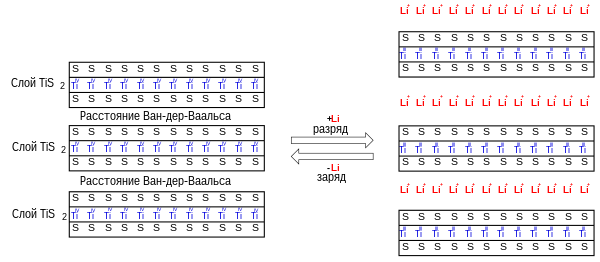
Дисульфид титана как и графит может обратимо интеркалировать и деинтеркалировать в свою кристаллическую структуру некоторые атомы и молекулы между слоями атомов серы так ка эти слои слабо связаны силами Ван-дер-Ваальса , например, атомы щелочных металлов , аммиак , гидразин , амиды кислот , при этом происходит «разбухание» кристаллической решётки с увеличением расстояния между кристаллическими слоями атомов. Дисульфид титана часто используется в качестве катодной массы в литий-ионных аккумуляторах и интеркаляция лития в это соединение изучена наиболее полно.
Интеркаляцию лития можно упрощённо описать в виде окислительно-восстановительной реакции :
Соединение обычно записывают в ионной форме . На этом свойстве вещества основано его применение в качестве катодной массы аккумулятора как накопитель ионов лития. При разряде аккумулятора ионы внедряются в кристалл дисульфида титана. При разряде происходит обратный процесс.
Применяется в качестве катодной массы электрохимических источников тока и аккумуляторов и в качестве твёрдого смазочного материала .
Дисульфид титана относится согласно ГОСТ 12.1.005-88 к классу опасности III — вещества с умеренной степенью опасности. Предельно допустимая концентрация вещества в виде аэрозоля в воздухе производственных помещений 6 мг/м 3 . Требуется хранение с предосторожностями, так как вещество способно самовозгораться.