Серотониновый синдром
- 1 year ago
- 0
- 0
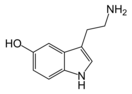
Серотони́н , 5-гидрокситриптамин , 5-НТ — один из основных нейромедиаторов . Серотонин относится к моноаминам , как и норадреналин , дофамин и гистамин . Моноамины не только поддерживают гомеостаз , но и регулируют поведение .
По химическому строению серотонин относится к биогенным аминам , классу триптаминов .
В основном серотониновая система мозга поддерживает функционирование многих областей мозга, а также тела. Мнение, что эта система является тормозящей , устарело, т. к. серотонин также поддерживает энергетический статус сенсорных и исполнительных систем . Более точно функцию серотонина можно описать как способствующую гомеостазу через противодействие нарушениям в циклах обмена веществ. Когда эти циклы имеют расстройство с избытком возбуждения, серотонин, действительно, выступает как тормозящий нейротрансмиттер, подавляя этот избыток. Однако, когда нервной системе и телу недостаточно возбуждения в сенсорных и испольнительных органах, серотонинная система использует свою тесную связь с нейропептидами гипоталамуса , и обеспечивает энергетическую поддержку этим органам.
Серотонин, как тканевый гормон , вызывает сокращение гладкой мускулатуры, расширяет либо сужает кровеносные сосуды , регулирует кишечник , участвует в формировании и регуляции различных физиологических параметров организма . Серотонинная система тесно связана с функциями, вовлекаемыми в регуляцию настроения, сна, полового и пищевого поведения.
Большая часть серотонина образуется за пределами центральной нервной системы (ЦНС) , где он выступает важным нейротрансмиттером и межклеточным мессенджером, а также гормоном .
Основные источники серотонина в организме – энтерохромаффинные клетки и интрамуральные нейроны ЖКТ. При проведении разбора патогенеза аллергических заболеваний необходимо учитывать, что тучные клетки также являются источником серотонина, который освобождается из них при воспалении.
Секретируемый серотонин накапливается в тромбоцитах и освобождается при агрегации . Это определяет его участие в патогенезе заболеваний, связанных с воспалением, дизрегенерацией, с нарушением моторики и микроциркуляции .
Субстрат для синтеза серотонина – аминокислота триптофан . Концентрация аминокислоты может снижаться при ряде патологических состояний: травме, респираторном дистресс-синдроме , аутоиммунных заболеваниях .
Серотонин синтезируется через активацию двух разных триптофангидроксилаз – TpH1 и TpH2, которые найдены соответственно в эндокринных клетках и нейронах .
Эффекты серотонина могут изменяться за счёт комбинации разных типов рецепторов и их десенситизации .

В 1935 году итальянским фармакологом Витторио Эрспамером впервые было выделено вещество из слизистой желудочно-кишечного тракта , сокращающее гладкую мускулатуру . Некоторые считали, что это был всего лишь адреналин , но только через два года первооткрывателю удалось доказать, что этим веществом оказался ранее неизвестный амин. Эрспамер назвал полученное соединение «энтерамином» . В 1948 году Морис Раппорт, Арда Грин и Ирвин Пейдж в Кливлендской клинике обнаружили сосудосуживающее вещество в сыворотке крови , которое назвали «серотонином». Структура данного вещества, предложенная Морисом Раппортом, в 1951 году была подтверждена химическим синтезом. В 1952 году было доказано, что энтерамин и серотонин — одно и то же вещество . В 1953 году нейрофизиологам Ирвину Пейджу и Бетти Твэрег удалось обнаружить серотонин в головном мозге .
После открытия серотонина началось изучение его рецепторов. В 1957 Джон Гаддум провёл ряд исследований, по итогам которых выяснилось, что серотониновые рецепторы неоднородны: способность серотонина сокращать гладкие мышцы блокировалась диэтиламидом Д-лизергиновой кислоты ( ЛСД — мощный галлюциноген и психотропный препарат вёл себя как агонист серотонина в периферических тканях), а свойство возбуждать вегетативные нервные узлы предотвращалось морфином . Соответствующие рецепторы были названы «Д»- и «М»- серотониновыми рецепторами . В 90-х годах XX века с помощью методов молекулярной биологии удалось выяснить, что существуют, по крайней мере, 14 видов серотониновых рецепторов, которые отвечают за разнообразные функции серотонина.
Серотонин образуется из аминокислоты триптофана путём её последовательного 5-гидроксилирования ферментом 5-триптофангидроксилазой (в результате чего получается 5-гидрокситриптофан , 5-ГТ) и затем декарбоксилирования получившегося гидрокситриптофана ферментом триптофандекарбоксилазой. 5-триптофангидроксилаза синтезируется только в соме серотонинергических нейронов , гидроксилирование происходит в присутствии ионов железа и кофактора птеридина .
Фермент 5-триптофангидроксилаза использует кофактор тетрагидробиоптерин, тогда как раннее считалось, что это был витамин Д. Реакция следующая: L-Триптофан + Тетрагидробиоптерин + O 2 = 5-Гидрокситриптофан + дигидробиоптерин .
Рецепторы серотонина представлены как метаботропными , так и ионотропными . Всего насчитывается от 14 до 17 типов таких рецепторов, классифицированных как 5-HT 1-7, причём 5-HT3-рецептор — ионотропный, остальные — метаботропные, семидоменные, связанные с G-белками . Установлено сходство метаботропных 5-HT рецепторов с рецепторами норадреналина .
5-HT 1 тип, насчитывающий несколько подтипов: 5-HT1A , 5-HT1B, 5-HT1D, 5-HT1E, которые могут быть как пре-, так и постсинаптическими, подавляет аденилатциклазу ; 5-HT4 и 5-HT7 — стимулируют; 5-HT2 , насчитывающий несколько подтипов: 5-HT2А , 5-HT2B , 5-HT2C , которые могут быть только постсинаптическими, активирует инозитолтрифосфат . 5-HT5 также подавляет аденилатциклазу .
Для некоторых типов рецепторов обнаружены эндогенные лиганды , помимо серотонина. Это, например, 5HT-модулин ( Leu - Ser - Ala -Leu), эндогенный лиганд 1B и 1D пресинаптических рецепторов, индуктор тревожности и стресса.
Структура серотонина имеет сходство со структурой психоактивного вещества ЛСД . ЛСД действует как агонист некоторых 5-HT рецепторов и ингибирует обратный захват серотонина, увеличивая его содержание.
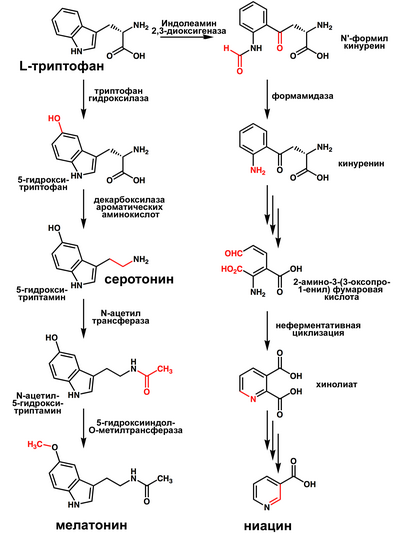
Под действием фермента моноаминоксидазы (МАО) серотонин превращается в 5-гидроксииндолальдегид, который, в свою очередь, может обратимо превращаться в 5-гидрокситриптофол под действием алкогольдегидрогеназы. Необратимо 5-гидроксииндолальдегид под действием ацетальдегиддегидрогеназы превращается в , которая затем выводится с мочой и калом.
Серотонин является предшественником мелатонина , образующегося под действием фермента эпифиза арилалкиламин-N-ацетилтрансферазы (ААНАТ) в эпифизе .
Серотонин может принимать участие в формировании эндогенных опиатов , вступая в реакцию с ацетальдегидом с образованием гармалола.
Существует определённое сходство в строении клеточных рецепторов к серотонину и норадреналину, подобие их транспортных клеточных систем. Известно также, что норадреналин ингибирует выброс серотонина. На их связи основано действие антидепрессанта миртазапина , который, блокируя альфа-2 рецепторы норадреналина, по принципу отрицательной обратной связи повышает содержание в синаптической щели и норадреналина, и серотонина (так как его ингибирование также тормозится) до нормы.
Ганс Селье описал стресс и дистресс как общий адаптационный синдром, развивающийся вследствие воздействия на человека неблагоприятных факторов окружающей среды. В его понимании стресс – это «неспецифический ответ организма на любое предъявленное ему требование» .
Можно сказать, что стрессоустойчивость – это способность организма противостоять воздействию стрессоров без развития неблагоприятных последствий для организма.
Дистресс развивается при длительном воздействии умеренного стрессорного фактора или кратковременном воздействии стрессора большой силы. Стресс лимитирующие системы (СЛС) активируются в ответ на воздействие стрессора.
Выделяют центральные и периферические СЛС организма.
К центральным СЛС относят ГАМК-ергическую, опиоидергическую и серотонинергическую системы .
Серотонинергическая система играет ведущую роль в ослаблении поведенческих последствий воздействия стрессоров, участвует в регуляции поведения, эмоций, аппетита, температуры тела, выполняет защитную роль, выступает химическим посредником в синапсах лимбической системы мозга.
Большой серотониновый цикл (БСЦ) – это запасы серотонина и рецепторы серотонина вне ЦНС .
Малый серотониновый цикл (МСЦ) – серотонин и рецепторы, синтезируемые в ЦНС . Участвует в регуляции микроциркуляции головного мозга и периферических тканей за счёт прямого воздействия на гладкую мускулатуру сосудов. При взаимодействии серотонина с серотонинреактивными структурами гладких мышц происходит их сокращение .
Серотонин адсорбируется тромбоцитами , которые обеспечивают его сохранность и транспортировку. Средний диаметр эритроцитов (7–7,5 мкм) превышает диаметр микроциркуляторного русла (4–5 мкм), поэтому эритроциты, проходя через капилляры , оказывают давление на их стенки или на пристеночно расположенные тромбоциты, которые перфузируются через микроциркуляторное русло непрерывно.
Из каждого тромбоцита под давлением эритроцитов идёт выдавливание «лабильного» серотонина, который реагирует с серотонинреактивными структурами гладкомышечных элементов стенки капилляра и происходит сокращение гладкомышечных элементов – спазм капилляра .
Такая пульсация капилляров обеспечивает функционирование микроциркуляторного русла , восстановление нарушенных обменных процессов в тканях и купирует гипоксию клеток.
После выделения серотонина тромбоциты вновь адсорбируют серотонин из энтерохромафинных клеток ЖКТ и уже с новой порцией серотонина перфузируются через микроциркуляторное русло .
Приток и отток крови в тканях зависит от системного и органного кровотока и регулируется сосудистой системой , функция которой зависит от функции всей гладкой мускулатуры.
Благодаря эндогенной внутренней активности миоцитов (сокращение–расслабление–сокращение) в организме поддерживается нормальный обмен веществ между кровью и тканями.
Без нормальной двигательной активности гладкой мускулатуры организм существовать не может. При нарушении одного или нескольких звеньев МСЦ в ЦНС может возникнуть относительная и/или абсолютная серотониновая недостаточность , которая будет в той или иной степени нарушать функции ЦНС .
Рецепторы серотонина находятся как в ЦНС, так и вне её. Нарушение одного или нескольких звеньев БСЦ приводит к нарушению МСЦ, и наоборот, если первичное нарушение произошло в МСЦ, то оно распространяется и на БСЦ .
Стрессоры приводят к образованию эндотоксинов . В результате, нарушается взаимодействие серотонина с серотониновыми рецепторами : происходит развитие относительной серотониновой недостаточности. Нарушается эндогенная вазомоторика, ухудшается микроциркуляция, возникает локальная и регионарная гипоксия , ухудшается обмен веществ .
Эти данные позволили учёным сформулировать новую концепцию стресса . У человека и животных стресс возникает в результате нарушения оптимального преобразования энергии в организме при воздействии на него различных факторов (стрессоров). Это приводит к появлению транзиторных изменений микроциркуляции и развитию тканевой гипоксии в различных органах, со временным снижением их функции и последующей активацией в них эндогенных адаптационных процессов, самостоятельным восстановлением микроциркуляции, нормального тканевого обмена и функции.
При стрессе повышается активность серотонинергических нейронов, что увеличивает потребление серотонина и приводит к развитию относительной серотониновой недостаточности .
Одновременно с этим компенсаторно растёт уровень триптофана в ЦНС. При дистрессе увеличивается потребление серотонина, развивается нейровоспаление и системная воспалительная реакция, при которой цитокины , минуя гематоэнцефалический барьер (ГЭБ), нарушают метаболизм триптофана, снижая его уровень. То есть при дистрессе развивается относительная и абсолютная серотониновая недостаточность в ЦНС .
Доказана иммунокорригирующая роль серотонинергической системы в ЦНС.
Анализ воздействия различных стрессоров на нейротрофические процессы в ЦНС показал нормализующее действие серотонина на репаративные процессы в ЦНС и, как следствие, улучшение психовегетативного статуса и регресс неврологического и когнитивного дефицита .
Короткое и продолжительное воздействие стрессоров снижает выброс, обратный захват и уровень внеклеточного серотонина, а также количество серотониновых рецепторов в отделах ЦНС, ответственных за регуляцию мозгового кровотока и формирование страха и тревоги.
При дистрессе ответная реакция сопровождается нарушением поведенческих адаптационных механизмов с возможным развитием тревожных психических состояний и депрессии .
Известно о синергизме и взаимном потенцировании стресслимитирующих эффектов опиоидергической и серотонинергической систем .
Участие в стресс-реакции принимают также периферические СЛС: антиоксидантная система , система простагландинов и система NO .
Нарушения СЛС при воздействии стрессоров разной интенсивности приводят к нарушениям центральной и периферической гемодинамики . При стрессе в некоторых областях головного мозга выявлены повышенная активность нейронов и увеличенный кровоток, а при дистрессе наблюдается ещё и снижение кровотока в тех же областях головного мозга. Такие нейрососудистые реакции приводят к когнитивной дисфункции и депрессии .
Изменения гемодинамики головного мозга при воздействии стрессоров обусловливают клиническую симптоматику психоэмоционального стресса и высокие риски развития цереброкардиальных катастроф .
Стрессоустойчивость – это способность противостоять воздействию эндогенных и экзогенных стрессоров без развития функциональных и органических изменений в организме.
Стрессоустойчивость поддерживается серотонинергической и опиоидергической системами, входящими в структуру СЛС, а также работой механизмов адаптации, реализующихся через взаимодействие сердечно-сосудистой системой (ССС) и вегетативной нервной системы (ВНС).
При стрессе сбалансированная работа ССС, ВНС и СЛС предупреждает развитие тканевой гипоксии, а при дистрессе из-за истощения резервов этих трёх систем наблюдается тканевая гипоксия. Это приводит к полиорганной дисфункции , а впоследствии – к полиорганной недостаточности.
Данные представления о механизме стрессоустойчивости закладывают теоретическую основу для разработки новых методик, направленных на профилактику и лечение стресса.
Более 60–70% населения страдает различными заболеваниями желудочно-кишечного тракта (ЖКТ) и не менее 15% из них нуждается в госпитализации .
Важную роль в этих процессах играет серотонин. У принимающих серотонин наблюдается положительная динамика при лечении болезни Крона , неспецифического язвенного колита (НЯК), синдрома раздражённого кишечника (СРК), гастроэзофагеальной рефлюксной болезни (ГЭРБ) .
Установлена роль серотонина в реализации компенсаторно-приспособительных и патологических процессов при ульцерогенезе (образовании язв) в гастродуоденальной зоне.
Источником синтеза серотонина в висцеральных органах являются тучные клетки , базофилы крови, энтерохромаффинные клетки и нейроны ЖКТ .
60–90% серотонина в организме человека продуцируется в ЖКТ, а более 90% серотонина ЖКТ секретируется энтерохромаффинными клетками и откладывается в запасающие гранулы этих клеток .
Серотонин играет важную роль в регуляции моторики ЖКТ, секреции соляной кислоты , транспорте хлора в эпителии двенадцатиперстной кишки (ДПК), секреции бикарбонатов в ней. В ДПК при действии пептических факторов (кислоты, жёлчи, ферментов) отмечается увеличение продукции серотонина, обеспечивающего острый секретогенный эффект и усиление моторики .
Изучение роли серотонина в патогенезе ульцерогенеза и осложнений язвенной болезни желудка и ДПК продолжается, так как во многом анализ механизмов затруднён многофакторностью регуляции синтеза и секреции серотонина, широким спектром клеток-мишеней и многочисленными рецепторами к серотонину, сопряжённости с системой свёртывания крови и реализацией острого воспалительного ответа организма на повреждение .
Уровень серотонина в плазме крови зависит от:
В эндокринных ЕС-клетках стимулятором продукции серотонина является снижение люменального рН . Этот механизм лежит в основе защитного эффекта серотонина в условиях повышенной секреции соляной кислоты. Усиление его продукции сопровождается включением моторного рефлекса , ускорением секреции слизи и бикарбонатов. Это происходит из-за повышения уровня цитоплазматического цАМФ через 5-НТ4-рецепторы .
Результатом включения системы сигнализации является усиление интестинальной секреции хлора и бикарбонатов .
Не менее важной мишенью серотонина в плазмолемме энтероцитов служит Nа + –Са 2+ -обменник. Такой эффект аналогичен карбахолу , что подтверждает синергичность функционирования ацетилхолина и серотонина в ЖКТ. Это связано с наличием на ЕС-клетках мускариновых и никотиновых холинорецепторов , стимуляция которых вызывает повышение освобождения серотонина из эндокринных клеток. Соответственно активация парасимпатических нейронов повышает плазменную концентрацию свободного серотонина .
Важным фактором, стимулирующим выработку серотонина в ЕС-клетках, является утрата их контактов с нервными окончаниями . Контакты «ЕС-клетки – нервные окончания» (как афферентные , так и эфферентные), в отличие от нейромышечных синапсов, – нестабильны.
Их высокая лабильность определяется выраженной кинетикой клеток эпителия кишки и желудка и связана с постоянной миграцией клеток. Усиление секреции серотонина при потере контакта с нервным окончанием считают компенсаторным механизмом, поскольку серотонин стимулирует рост нервных волокон и восстановление иннервации .
Следствием освобождения 5-HT из эндокринных клеток интестинальной слизистой оболочки (СО) является активация 5-HT рецепторов на афферентах вагуса , чем обеспечивается гибкая система реципрокных отношений между ацетилхолин (АХ) и 5-HT.
Важным источником серотонина в ЖКТ служат и серотонинергические интрамуральные нейроны. Они составляют малую часть общего числа интрамуральных нейронов ЖКТ. Этот вид клеток дивергентно иннервирует другие нейроны интрамуральных сплетений. Большая их часть представлена холинергическими нейроцитами, которые формируют синаптические связи далеко от тела нейрона .
Обилие холинергических синапсов в стенке ЖКТ, в которых происходит освобождение АХ (например, при стимуляции 5-HT 4 рецепторов), определяет важную роль серотонина в синхронизации моторики разных отделов ЖКТ. Вероятно, этим объясняется высокая эффективность использования агонистов 5-НТ рецепторов в терапии ГЭРБ , СРК и пр.
Не менее важным фактором является скорость инактивации активного серотонина. Классическая петля обратной связи в парасимпатическом отделе нервной системы строится на механизмах фермент-медиируемого
катаболизма
сигнальной молекулы.
Серотонин катаболизируется с помощью моноаминоксидазы , а в кишке – с помощью трансфераз и других ферментов . Эти ферменты не вовлекаются в завершение серотонин-медиируемых сигнальных событий. В основном инактивация происходит за счёт захвата серотонина клетками с помощью транспортёров . Обратный захват характерен как для клеток, секретирующих серотонин, так и для соседних клеток, например энтероцитов .
Установлена возможность утилизации серотонина в моноцитах , макрофагах , дендритных клетках (ДК) и лимфоцитах через активацию системы захвата серотонина, реализуемую за счёт транспортёра обратного захвата серотонина (SERT) .
Приведённые данные о нарушении метаболизма и эффектов 5-HT в ЖКТ при ряде заболеваний требуют более детального анализа механизмов его влияния .
Нарушение метаболизма серотонина показано при различных воспалительных заболеваниях ЖКТ . Например, при нелеченой целиакии в ДПК отмечено увеличение количества ЕС-клеток и значимое повышение уровня плазменного серотонина. Пики подъёма уровня серотонина коррелировали с приступами диспепсии , подтверждая роль гормона в патогенезе и клинической манифестации данной патологии .
При язвенном колите выявлено снижение количества ЕС-клеток, уровня серотонина в СО и мРНК, кодирующей TpH-1 и SERT, при значимом снижении иммунореактивности SERT .
Противоположная ситуация – повышение иммунореактивности, особенно в нейронах межмышечного сплетения, отмечено при болезни Крона .
При диарейной форме СРК установили нарушение экспрессии мРНК серотонина в СО, TpH 1 и SERT. Показана зависимость между формой СРК и уровнем серотонина – снижение содержания серотонина и ферментов его обмена при форме, сопряжённой с запорами , и повышение – при диарейной форме .
Приведённые факты не приближают к пониманию патогенетических механизмов развития разных вариантов патологии ЖКТ. При решении данного вопроса невозможно обойтись без анализа механизмов влияния 5-НТ на разнообразные мишени в слизистой оболочке .
Мишенями серотонина в ЖКТ являются:
Благодаря такому многообразию мишеней серотонин в ЖКТ функционирует не только как нейротрансмиттер, но и как паракринный мессенджер. Он определяет межтканевые и межклеточные кооперации в СО, реализует компенсаторно-приспособительные реакции.
Рядом авторов серотонин рассматривается как фактор роста, поскольку он усиливает пролиферацию клеток в кишечных криптах. В онтогенезе серотонин стимулирует развитие интрамуральных нейронов, а в постнатальном периоде повышает выживание нейронов и их пластичность за счёт стимуляции 5-HT 4 рецепторов. Серотонин присутствует в нейронах и ЕС-клетках на самых ранних стадиях развития ЖКТ . Предполагается, что экспрессия серотонина определяет численность и типы нейронов, а также особенности дифференцировки кишечных нейронов слизистой оболочки кишки в будущем .
За счёт поддержания жизнеспособности нейронов серотонин поддерживает устойчивость интрамуральной системы нейронов к действию экстремальных факторов и препятствует старению.
Таким образом, в ЖКТ 5-HT оказывает разнообразное влияние на интрамуральные нейроны, внешние афференты, энтероциты, систему кровотока и гладкомышечные клетки, что обусловлено экспрессией разных 5-HT рецепторов, регулирующих подвижность, сосудистый тонус, секрецию и восходящий поток афферентации в ЦНС .
Широкий спектр 5-НТ-медиируемых эффектов связан с индивидуальной экспрессией разных классов G-белок-связанных рецепторов .
Уникальное распределение рецепторов серотонина в структурах ЖКТ открывает возможности использования селективных агонистов или антагонистов для коррекции разных вариантов нарушений деятельности ЖКТ .
Экстрамуральные нервы, передающие поток сенсорной информации в ЦНС , активируются за счёт 5-HTR 3 , что позволяет использовать селективные антагонисты (например, ондансетрон , гранисетрон и алосетрон) для снижения вызванного серотонином дискомфорта при проведении химиотерапии онкологическим больным .
Другие типы рецепторов, включая 5-HT 1 и 5-HT 7 , стимулируют IPANs, которые контролируют перистальтику и секрецию .
Ацетилхолин (АХ) и пептид , ассоциированный с геном кальцитонина (КГРП) отвечают за быструю и медленную составляющие возбуждающей нейротрансмиссии , регуляция которых является целью разработки новых препаратов, корригирующих спастические симптомы и нарушения перистальтики .
Стимуляция 5-HTR 4 повышает освобождение АХ. Усиливается амплитуда быстрой волны возбуждения и удлиняет синаптическую передачу .
5-HTR 4 также локализованы на терминалях эфферентных нервов, выделяющих АХ. Их активация повышает освобождение последнего из нервных окончаний и стимулирует интрамуральные нейроны. Благодаря таким эффектам агонисты 5-HTR 4 обеспечивают усиление нейромышечной передачи. Это обосновывает их использование для лечения патологии ЖКТ, ассоциированной со сниженной моторикой .
Установлено, что агонисты 5-HTR 4 оказывают умеренный позитивный эффект при лечении пациентов с ГЭРБ , хотя и менее эффективны, чем ингибиторы протонной помпы .
Агонисты 5-HTR 4 могут купировать висцеральную гиперсенситивность. При нарушениях функции ЖКТ позитивна роль ингибиторов обратного захвата серотонина, которые, за счёт пролонгации действия освобождённого серотонина, усиливают его влияние на мишени как в ЦНС, так и в органах ЖКТ .
Показано, что трициклические антидепрессанты ингибируют SERT и могут моделировать работу ЖКТ, но оказывают побочное действие – ингибируют транспортёры норадреналина и дофамина .
Несмотря на эффективность использования указанных препаратов, нужно отметить их ограниченное применение. Не учитываются иммуномодулирующие свойства серотонина.
Игнорирование данного факта не только ограничивает понимание роли серотонина в нейроиммуногуморальном контроле, но и может стать « ящиком Пандоры » при медикаментозной коррекции механизмов серотонин-медиируемых интерцитокиновых связей .
При анализе патогенеза атопических/ аллергических заболеваний важно учитывать также тучные клетки , освобождающие серотонин после связи аллергенов с IgE . Секретируемый серотонин накапливается в тромбоцитах и освобождается при агрегации . Уровень данного амина резко повышается при стимуляции агрегационной активности тромбоцитов и при воспалении .
Серотонин – вазоактивный агент, проагрегант и мощный иммуномодулятор. 5-НТ может регулировать в лейкоцитах такие процессы, как миграция, фагоцитоз , секреция цитокинов . В зоне воспаления активация тромбоцитов с участием фактора активации тромбоцитов, компонента системы комплемента – анафилаксина C 5a и IgE-содержащих иммунных комплексов сопровождается агрегацией тромбоцитов и освобождением серотонина. C 5a также активирует тучные клетки и стимулирует освобождение из них серотонина. Нейроэндокринный контроль иммунной системы обеспечивается через гипоталамо-гипофизарную ось посредством прямых эфферентных связей и пептидергической сенсорной системы в периферических лимфоидных органах. Циркулирующие гормоны и освобождаемые нейротрансмиттеры регулируют презентацию антигенов , продукцию антител , хоуминг и активность лимфоцитов , пролиферацию и дифференцировку лимфоцитов, секрецию цитокинов , селективное включение ответа Т-хелперов 1-го или 2-го типов (Th1 или Th2) и соответственно клеточного или гуморального иммунитета .
При воспалительных процессах активация «стресс-системы» посредством стимуляции Th2-пути защищает организм от системного воспаления, запускаемого при участии Th1-ассоциированных провоспалительных цитокинов. В ряде ситуаций «стресс-гормоны», ATФ и активация регуляторной петли КГРП (субстанция P-гистамин) могут усиливать воспаление посредством активации секреции провоспалительных цитокинов – интерлейкинов (ИЛ-1β, ИЛ-6, ИЛ-8, ИЛ-18) и фактора некроза опухоли α (ФНО-α). Дисбаланс нейро-иммуноэндокринных отношений может вести не только к гиперактивности локальных провоспалительных факторов, но и к нарушению активации системы обратной связи – системного антивоспалительного ответа .
Впервые нейроиммуногуморальные эффекты серотонина были описаны при изучении патогенеза бронхиальной астмы (БА). Оказалось, что стимуляция серотонинергических рецепторов в моноцитах, эпителиоцитах воздухоносных путей и лёгких сопровождается продукцией провоспалительных цитокинов .
Непосредственная роль серотонина при БА была подтверждена зависимостью между тяжестью заболевания и уровнем серотонина. Он играет важную роль в активации Т-лимфоцитов и их взаимодействии с ДК, обладает активностью хемоаттрактанта для эозинофилов и тучных клеток.
Анализ механизмов регуляции иммунного ответа приводит к мысли, что большинство хронических заболеваний ЖКТ связано с нарушением разрешения воспалительного процесса и включением механизмов аутоиммунизации, сопряжённых с нарушением интерцитокиновых отношений.
При воспалении активируется миграция различных типов клеток крови, включая моноциты и нейтрофилы, рекрутируемых в зону повреждения. При этом моноциты и их производные – макрофаги и ДК – играют важную роль в распознавании и элиминации микроорганизмов .
Связывание цитокинов, биогенных аминов и продуктов, секретируемых микроорганизмами, с рецепторами стимулирует освобождение цитокинов и других эффекторных молекул, набор которых определяет реализацию реакций неспецифической защиты и адаптивного иммунитета.
В норме существует баланс между секреторными уровнями провоспалительных и антивоспалительных цитокинов. Последовательность их освобождения считается одной из ключевых детерминант, определяющих паттерн молекулярных и морфологических событий, сопровождающих воспаление и репарацию. Нарушение этого баланса может пролонгировать, усиливать воспалительный ответ и вызывать развитие патологического процесса. В связи с этим особое внимание отводится клеточным механизмам, контролирующим уровень цитокинов в норме и при патологии. В пределах ЖКТ в этом списке первыми считаются АХ и 5-HT. В соответствии с концепцией холинергического противовоспалительного ответа мозг посредством вагуса контролирует системный воспалительный ответ на эндотоксины и бактериальный липополисахарид (ЛПС). Стимуляция вагуса также ограничивает освобождение ФНО-α из макрофагов ретикулоэндотелиальной системы. Этот эффект отсутствует у мышей с дефектом никотиновых α7 рецепторов и связан с посттранскрипционной регуляцией экспрессии цитокинов .
Активация холинергического контроля снижает рекрутирование лейкоцитов в зону воспаления. Известно, что в ЛПС-стимулированных макрофагах АХ снижает освобождение ИЛ-1β, ИЛ-6 и ИЛ-18, но не меняет продукцию ИЛ-10. Влияние 5-HT на освобождение цитокинов более сложное.
В лейкоцитах серотонин регулирует фагоцитоз , миграцию, продукцию супероксидных анионов, секрецию цитокинов и др. Понимание механизмов влияния серотонина на реализацию неспецифического и специфического ответа иммунной системы требует детального рассмотрения клеточно-специфической экспрессии рецепторов 5-НТ .
5-HT оказывает противоположный эффект на продукцию провоспалительных цитокинов в нейтрофилах, вызывая снижение ФНО-α и повышение ИЛ-1β в дендритных клетках, нейтрофилах и моноцитах человека .
Таким образом, 5-HT может контролировать развитие воспаления благодаря регуляции паттерна секретируемых цитокинов.
На нейтрофилах периферической крови представлены 5-HT 2A рецепторы, активация которых сопряжена со стимуляцией фосфолипазы Сβ через Gq-белок и сопровождается повышением уровня Са 2+ (через инозитол-3-фосфат – И3-Ф) и активацией протеинкиназы С .
Аналогичный механизм активации характерен и для тромбоцитов . В результате активации 5-НТ 2А рецепторов в тромбоцитах происходит секреция гранул, изменение формы (за счёт активации протеинкиназы С и цитоскелета ), усиление агрегации (прогрессирование тромбогенеза) и повышение экспрессии Р-селектина. Такой феномен обеспечивает сопряжённую работу тромбоцитов и лейкоцитов в зоне повреждения.
Активация данной сигнальной системы сопровождается стимуляцией фосфолипазы А 2 и запуском каскада арахидоновой кислоты , которая в тромбоцитах ведёт к образованию тромбоксана А2, а в нейтрофилах – к повышению секреции простагландинов и лейкотриенов .
Повышение уровня внутриклеточного Са 2+ , продукция активных форм кислорода и модуляция Rho-киназ ведёт к активации семейства митоген-активируемых киназ – МАРК, в частности р-38МАРК, что в нейтрофилах определяет изменение функционального ответа на транскрипционном уровне .
Основным результатом действия 5-НТ на нейтрофилы является снижение экспрессии ФНО-α при повышении продукции ИЛ-1β и экспрессия молекул клеточной адгезии , потенцирующих рекрутирование нейтрофилов в зону воспаления .
Преимущественная экспрессия 5-НТR 2 характерна также для эозинофилов и тучных клеток, в которых серотонин вызывает активацию цитоскелета и ведёт к усилению миграции .
Моноциты и их производные (ДК и макрофаги) экспрессируют широкий спектр 5-НТ-рецепторов. Эффекты серотонина на разные представители данного дифферона значимо отличаются (моноциты, фагоциты – макрофаги и АПК – ДК) . Моноциты человека экспрессируют несколько подтипов рецепторов к серотонину. В моноцитах 5-НТ ингибируется освобождение ФНО-α. Показано, что агонисты 1-го и 3-го типов 5-НТ рецепторов не оказывают влияния на секрецию ФНО-α в нестимулированных моноцитах, однако добавление 5-НТ вместе с ЛПС снижало освобождение ФНО-α . При изучении механизмов влияния 5-НТ на моноциты установлено, что 5-HTR 4 и 5-HTR 7 вовлекаются в модуляцию секреции ИЛ-1β, ИЛ-6 ИЛ-8/CXCL8, ИЛ-12p40 и ФНО-α, тогда как 5-HTR 3 субтип модулирует секрецию ИЛ-6, ИЛ-8/ CXCL8 и ИЛ-1β, но не оказывает влияния на продукцию ИЛ-12p40 и ФНО-α . Активация 5-HTR 4 и 5-HTR 7 в моноцитах ингибирует продукцию ФНО-α и ИЛ-12, но повышает продукцию ИЛ-1β, ИЛ-8 и снижает уровни секреции ИЛ-12 и ФНО-α. Активация 5-HTR 3 в моноцитах стимулирует повышение продукции ИЛ-1β и ИЛ-6 . Таким образом, большинство цитокин-модулирующих эффектов серотонина сопряжено с функционированием 5-HTR 3 , 5-HTR 4 и 5-HTR 7 . Эти ответы могут вносить вклад в развитие разных вариантов воспалительного паттерна, отражая регуляторную роль серотонина в иммунной системе .
Анализ рецепторов серотонина выявил, что 5-HTR 4 и 5-HTR 7 связаны через Gs со стимуляцией аденилатциклазы , ведущей к повышению внутриклеточного уровня цАМФ. Доказано, что цАМФ модулирует продукцию ИЛ-1β, ИЛ-6, ИЛ-12p40, ИЛ-8/CXCL8 и ФНО-α в других клеточных типах . В отличие от ИЛ-12p70 гетеродимеров мономеры и гомодимеры ИЛ-12p40 оказывают ингибирующее влияние на Th1, формируя условия для стимуляции Th2 . Повышение продукции ИЛ-12p40 под действием серотонина вызывает поляризацию иммунного ответа в направлении доминирования Th2-ответа, что является важнейшим патогенетическим событием в развитии БА и атопической патологии ЖКТ.
Основная роль в регуляции иммунного ответа принадлежит дендритным клеткам , спектр продукции хемокинов и цитокинов определяет поляризацию Т-клеток .
Освобождение 5-HT может иметь важное значение в рекрутировании моноцитов и их превращении в ДК в зоне воспаления. 5-НТ является хемоаттрактантом для незрелых ДК, но не влияет на миграционную активность зрелых ЛПС-стимулированных ДК, это связано с активацией 5-HTR 1B и 5HT 2 подтипов.
Использование антагониста 5-HTR 1B – GR 55562 и антагониста 5-HTR 2A – кетансерина показало, что оба подтипа рецепторов вовлечены в 5-HT-вызванную миграцию незрелых ДК. По мере созревания ДК утрачивают способность ответа на 5-HT через 5-HTR 2A . В зрелых ДК 5-НТ модулирует секрецию ИЛ-6, CXCL10, CCL22 и поляризацию иммунного ответа через активацию 5-HTR4 и 5-HTR7 подтипов. Созревание ДК может индуцироваться внешними сигналами.
Серотонин повышает миграцию незрелых ДК, но не влияет на продукцию ими хемоаттрактантов. При этом незрелые ДК продуцируют высокий уровень CCL22, привлекающий преимущественно клетки Тh2 класса, но низкий уровень CXCL10, являющийся хемоаттрактантом для клеток Тh1 типа . В отличие от этого ЛПС-стимулированные зрелые ДК секретируют оба типа хемоаттрактантов, регулируя миграцию Тh1 и Тh2 в тканях. При инкубации ДК с ЛПС и серотонином отмечается дозозависимое ингибирование продукции CXCL10 и повышение секреции CCL22. Эти данные подтверждают стимулирующее влияние серотонина на ДК в отношении поляризации Тh2-ответа . Ключевая роль в обеспечении Тh1/Тh2 полярности иммунного ответа принадлежит ИФН-γ и ИЛ-12, которые стимулируют включение Th1 клеточного ответа. Серотонин не влияет на базальную продукцию этих цитокинов. Однако добавление 5-НТ вместе с ЛПС ингибирует продукцию ИЛ-12р70 и повышает секрецию ИЛ-10. Этот эффект был опосредован активацией 4-го и 7-го типов 5-НТ рецепторов (добавление антагонистов этих рецепторов предотвращало развитие названного эффекта) .
Современная информация в отношении эффектов серотонина в органах ЖКТ свидетельствует о его многогранной роли в контроле функционирования, реализации компенсаторно-приспособительных процессов и осуществлении иммунологического гомеостаза слизистой оболочки. Однако сегодня приходится констатировать недостаток сведений о влиянии серотонина и модуляторов его рецепторов на структуры СО и КАЛТ при различных вариантах патологии ЖКТ – гастритах, дуоденитах, язвенной болезни.
Комплексный анализ параметров продукции, депонирования и инактивации серотонина с учётом клеточно-специфических механизмов реализации эффекта данного нейротрансмиттера, гормона и паракринного иммуномодулятора является перспективным направлением исследования в области гастроэнтерологии и патофизиологии , которое может стать основой разработки новой стратегии коррекции гастроинтестинального барьера при разных вариантах патологии ЖКТ .
Серотонин используется для регуляции боли и сигнализации как в мозге, так и в висцеральных системах органов .
В мозге серотонинергические нейроны расположены в ядрах срединного шва. Нисходящие проекции из ядер шва влияют на спинной мозг и ствол мозга , где вовлекаются в центральную регуляцию боли и патологического болевого синдрома.
Была обнаружена закономерность, что при заболеваниях опорно-двигательного аппарата резко уменьшается уровень серотонина в периферической крови. Выявлено, что по мере увеличения степени деформации позвоночника уменьшается уровень серотонина в крови. Получается, что чем сильнее искривлён позвоночник, тем сильнее падает количество серотонина.
Обнаружена связь уровня серотонина с выраженностью болевого синдрома и вегетативными нарушениями . Чем меньше серотонина в крови, тем выраженнее болевой синдром. Уменьшение уровня серотонина в периферической крови может служить инструментом для оценки степени тяжести поражения .
Содержание серотонина в сыворотке больных с политравмой при поступлении достоверно различается в зависимости от её тяжести. Серотонин можно применять в качестве диагностического биомаркера . Отмечена двухфазная активация симпатической нервной системы в течение первых двух суток, что проявилось в достоверных изменениях уровня серотонина независимо от первичной тяжести политравмы .
Физиологические функции серотонина чрезвычайно многообразны. Серотонин «руководит» очень многими функциями в организме.
Доктором Виллисом доказано, что при снижении серотонина повышается чувствительность болевой системы организма, то есть даже самое слабое раздражение отзывается сильной болью.
Серотонин играет роль нейромедиатора в центральной нервной системе . Серотонинергические нейроны группируются в стволе мозга : в варолиевом мосту и ядрах шва . От моста идут нисходящие проекции в спинной мозг , нейроны ядер шва дают восходящие проекции к мозжечку , лимбической системе, базальным ганглиям, коре. При этом нейроны дорсального и медиального ядер шва дают аксоны , различающиеся морфологически, электрофизиологически, мишенями иннервации и чувствительностью к некоторым нейротоксичным агентам, например, метамфетамину .
Синтезированный нейроном серотонин закачивается в везикулы. Этот процесс является протон-сопряжённым транспортом. В везикулу с помощью протон-зависимой АТФазы закачиваются ионы H + . При выходе протонов по градиенту в везикулу поступают молекулы серотонина.
Далее, в ответ на деполяризацию терминали, серотонин выводится в синаптическую щель. Часть его участвует в передаче нервного импульса, воздействуя на клеточные рецепторы постсинаптической мембраны, а часть возвращается в пресинаптический нейрон с помощью . Ауторегуляция выхода серотонина обеспечивается путём активации пресинаптических 5-НТ рецепторов, запускающих каскад реакций, которые регулируют вход ионов кальция внутрь пресинаптической терминали. Ионы кальция, в свою очередь, активируют фосфорилирование фермента 5-триптофангидроксилазы, обеспечивающей превращение триптофана в серотонин, что приводит к усилению синтеза серотонина.
Обратный захват производится транспортёром серотонина, двенадцатидоменным белком, производящим натрий-калий-сопряжённый транспорт. Вернувшийся в клетку медиатор расщепляется с помощью моноаминоксидазы до 5-гидроксилиндолилуксусной кислоты.
Химизм транспортных систем серотонина также подобен таковым норадреналина .
Серотонин облегчает двигательную активность, благодаря усилению секреции субстанции Р в окончаниях сенсорных нейронов путём воздействия на ионотропные и метаботропные рецепторы.
Серотонин наряду с дофамином играет важную роль в механизмах гипоталамической регуляции гормональной функции гипофиза. Стимуляция серотонинергических путей, связывающих гипоталамус с гипофизом , вызывает увеличение секреции пролактина и некоторых других гормонов передней доли гипофиза — действие, противоположное эффектам стимуляции дофаминергических путей.
Серотонин также участвует в регуляции сосудистого тонуса.
Избыток серотонина может быть потенциально опасен, вызывая последствия, известные как серотониновый синдром . Такая критическая концентрация серотонина зачастую является следствием параллельного применения антидепрессантов классов ингибиторов моноаминоксидазы и селективных ингибиторов обратного захвата серотонина .
Серотонин играет важную роль в процессах свёртывания крови . Тромбоциты крови содержат значительные количества серотонина и обладают способностью захватывать и накапливать серотонин из плазмы крови . Серотонин повышает функциональную активность тромбоцитов и их склонность к агрегации и образованию тромбов . Стимулируя специфические серотониновые рецепторы в печени , серотонин вызывает увеличение синтеза печенью факторов свёртывания крови. Выделение серотонина из повреждённых тканей является одним из механизмов обеспечения свёртывания крови по месту повреждения.
Серотонин участвует в процессах аллергии и воспаления . Он повышает проницаемость сосудов, усиливает хемотаксис и миграцию лейкоцитов в очаг воспаления, увеличивает содержание эозинофилов в крови, усиливает дегрануляцию тучных клеток и высвобождение других медиаторов аллергии и воспаления.
Местное (например, внутримышечное) введение экзогенного серотонина вызывает сильную боль в месте введения. Предположительно серотонин наряду с гистамином и простагландинами , раздражая рецепторы в тканях, играет роль в возникновении болевой импульсации из места повреждения или воспаления.
Также большое количество серотонина производится в кишечнике . Серотонин играет важную роль в регуляции моторики и секреции в желудочно-кишечном тракте, усиливая его перистальтику и секреторную активность. Кроме того, серотонин играет роль фактора роста для некоторых видов симбиотических микроорганизмов, усиливает бактериальный метаболизм в толстой кишке . Сами бактерии толстой кишки также вносят некоторый вклад в секрецию серотонина кишечником, поскольку многие виды симбиотических бактерий обладают способностью декарбоксилировать триптофан. При дисбактериозе и ряде других заболеваний толстой кишки продукция серотонина кишечником значительно снижается.
Массовое высвобождение серотонина из погибающих клеток слизистой желудка и кишечника при воздействии цитотоксических химиопрепаратов является одной из причин возникновения тошноты и рвоты, диареи при химиотерапии злокачественных опухолей. Аналогичное состояние бывает при некоторых злокачественных опухолях, эктопически продуцирующих серотонин.
Большое содержание серотонина также отмечается в матке . Серотонин играет роль в паракринной регуляции сокращения матки и маточных труб и в координации родов . Продукция серотонина в миометрии возрастает за несколько часов или дней до родов и ещё больше увеличивается непосредственно в процессе родов. Также серотонин вовлечён в процесс овуляции — содержание серотонина (и ряда других биологически активных веществ) в фолликулярной жидкости увеличивается непосредственно перед разрывом фолликула, что, по-видимому, приводит к увеличению внутрифолликулярного давления.
Серотонин оказывает значительное влияние на процессы возбуждения и торможения в системе половых органов. Например, увеличение концентрации серотонина у мужчин задерживает наступление эякуляции .
Серотонин часто называют «гормоном счастья», он вырабатывается в организме в моменты экстаза, его уровень повышается во время эйфории и понижается во время депрессии. Для выработки серотонина обязательно нужен ультрафиолет [ источник не указан 1642 дня ] , недостаток ультрафиолета в зимнее время года и является причиной столь распространённой сезонной депрессии.
На уровень серотонина в организме можно влиять:
Чтобы вырабатывался серотонин, в организм обязательно должны поступать триптофан и глюкоза. Глюкоза стимулирует повышенный выход инсулина в кровь, который даёт команду основным аминокислотам уйти из кровяного русла в депо, освобождая триптофану дорогу через гематоэнцефалический барьер в мозг на выработку серотонина. Чтобы повысить уровень серотонина в плазме крови и, соответственно, в ЦНС , используются ингибиторы обратного захвата серотонина, например, сертралин . Эти препараты способны угнетать захват серотонина и тем самым повышать его концентрацию. Все лекарства этого ряда являются рецептурными препаратами и подлежат использованию только по назначению врача.
В прошлом считалось, что дефицит или ингибирование серотонинергической передачи, например, вызванные снижением уровня серотонина в мозге , являются причиной депрессивных состояний . Такое предположение получило название « серотониновая гипотеза депрессии ».
Гиперактивация серотониновых рецепторов (например, при приёме некоторых наркотиков ) может привести к галлюцинациям . C хронически повышенным уровнем их активности может быть связано развитие шизофрении .
Накопление серотонина в ЦНС вследствие приёма серотонинергических препаратов может приводить к возникновению серотонинового синдрома :59 .
Пищевые продукты с повышенным содержанием триптофана (аминокислота, из которой образуется серотонин): молочные продукты (особенно сыр), финики , сливы , инжир , томаты , соя , чёрный шоколад , способствуют биосинтезу серотонина и часто улучшают настроение. Они же могут быть причиной острых токсических реакций ( серотониновый синдром ), если употребляются в больших количествах на фоне лечения некоторыми группами антидепрессантов — ингибиторами моноаминоксидазы (ИМАО) или селективными ингибиторами обратного захвата серотонина (СИОЗС).