Рака (река)
- 1 year ago
- 0
- 0
Иммунотерапия рака (иногда называемая иммуноонкологией ) – это искусственная стимуляция иммунной системы для лечения рака , помогающая иммунной системе естественным путём бороться с болезнью. Это программа фундаментальных исследований в области иммунологии рака и развивающейся специализации онкологии .
Иммунотерапия рака заключается в том, чтобы антитела белков иммунной системы могли обнаружить и связываться с молекулами, находящимися на поверхности опухолевых антигенов раковых клеток . Опухолевыми антигенами часто являются белки или другие макромолекулы (например, углеводы ). Нормальные антитела связываются со внешними патогенами, но модифицированные иммунотерапевтические антитела связываются с опухолевыми антигенами, которые маркируются и идентифицируются как опухолевые клетки, для подавления или уничтожения иммунной системой.
В 2018 году американский иммунолог Джеймс Эллисон и японский иммунолог Тасуку Хондзё получили Нобелевскую премию по физиологии и медицине за открытие терапии рака путём ингибирования негативной иммунной регуляции.
Первые свидетельства иммунотерапии рака появились в Иберийском папирусе (1550 г. до н. э.): Египетский фараон Имхотеп (2600 г. до н. э.) использовал припарки с последующим разрезом для лечения опухоли; что облегчало развитие инфекции в нужном месте и вызвало регрессию опухоли. «В течение 17-го и 18-го веков различные формы иммунотерапии при раке получили широкое распространение... В XVIII и XIX веках для лечения рака использовались септические повязки, закрывающие язвенные опухоли. Хирургические раны оставляли открытыми, чтобы облегчить развитие инфекции, а гнойные язвы создавались намеренно... Один из наиболее известных эффектов микроорганизмов на рак был зарегистрирован в 1891 году, когда американский хирург Уильям Коли привил пациентам с неоперабельными опухолями Streptococcus pyogenes ." "Коли тщательно изучил литературу, доступную в то время, и обнаружил 38 сообщений о раковых пациентах со случайной или ятрогенной лихорадочной рожей. У 12 пациентов саркома или карцинома полностью исчезла; а состояние других значительно улучшилось. Коли решил попробовать ятрогенную рожу в качестве терапии..." " Коли разработал токсин, который содержал тепловыделяющие бактерии Streptococcus pyogenes и . До 1963 года это лечение использовалось для лечения саркомы". "Коли ввёл более 1000 раковым больным бактерии или их продукты". 51,9% пациентов [Коли] с неоперабельными саркомами мягких тканей показали полную регрессию опухоли и прожили на 5 лет дольше, а 21,2% пациентов не имели клинических признаков опухоли по крайней мере через 20 лет после этого лечения.…"
Иммунотерапия может быть разделена на активную или пассивную. Активная иммунотерапия специфически нацелена на опухолевые клетки через иммунную систему. Например, вакцины против рака и CAR-T-клетки , а также таргетная терапия антителами. Напротив, пассивная иммунотерапия не нацелена непосредственно на опухолевые клетки, но усиливает способность иммунной системы их атаковать. К примеру, и цитокины .
Активная клеточная терапия направлена на уничтожение раковых клеток путём распознавания различных маркеров, известных как антигены . В вакцинах против рака цель состоит в том, чтобы сгенерировать иммунный ответ на эти антигены с помощью вакцины. В настоящее время одобрена только одна вакцина ( sipuleucel-T для лечения рака предстательной железы). В клеточно-опосредованной терапии, такой как CAR-T-клеточная терапия, иммунные клетки извлекаются из пациента генетически модифицируются для распознавания опухолеспецифических антигенов и возвращаются пациенту. Типы клеток, которые могут быть использованы таким образом, - это естественные киллеры (NK) , , цитотоксические Т-лимфоциты и дендритные клетки . Наконец, могут быть разработаны специфические антитела, которые распознают опухолевые клетки и нацеливают их на уничтожение иммунной системой. Примеры таких антител включают ритуксимаб (нацеленный на CD-20), трастузумаб (нацеленный на HER-2) и цетуксимаб (нацеленный на EGFR).
Пассивная терапия антителами направлена на повышение активности иммунной системы без целенаправленного воздействия на опухолевые клетки. Например, цитокины непосредственно стимулируют иммунную систему и повышают иммунную активность. Ингибиторы контрольных точек нацелены на белки ( ), которые обычно ослабляют иммунный ответ. Это повышает способность иммунной системы атаковать опухолевые клетки. В настоящее время проводятся исследования по выявлению новых потенциальных мишеней для усиления иммунной функции. Одобренные ингибиторы контрольных точек включают такие антитела, как ипилимумаб , ипилимумаб и пембролизумаб .

Терапия дендритными клетками вызывает противоопухолевый ответ, заставляя их показывать опухолевые антигены лимфоцитам, что активирует последних, заставляя их убивать другие клетки, которые проявляют антиген. Дендритные клетки – это антигенпрезентирующие клетки (АПК) иммунной системы млекопитающих. При лечении рака они помогают нацеливаться на опухолевые антигены. Единственной одобренной терапией клеточного рака, основанной на дендритных клетках, является sipuleucel-T .
Одним из способов индуцирования дендритных клеток к представлению опухолевых антигенов является вакцинация аутологичными опухолевыми лизатами или короткими пептидами (небольшие части белка, соответствующие белковым антигенам на раковых клетках). Эти пептиды часто вводят в сочетании с адъювантами ( высокоиммуногеннымивеществами ) для усиления иммунных и противоопухолевых реакций. Другие адъюванты включают белки или другие химические вещества, которые привлекают и/или усиливают дендритные клетки, такие как гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF). Наиболее распространённым источником антигенов, используемых для вакцинации дендритных клеток при глиобластоме (ГБМ) как агрессивной опухоли головного мозга, были лизат цельной опухоли, РНК ЦМВ-антигена и ассоциированные с опухолью пептиды, такие как EGFRvIII.
Дендритные клетки также могут быть активны in vivo , заставляя опухолевые клетки экспрессировать GM-CSF. Это может быть достигнуто либо путём генной инженерии опухолевых клеток для получения GM-CSF, либо путём заражения опухолевых клеток онколитическим вирусом , экспрессирующим GM-CSF.
Другая стратегия состоит в том, чтобы удалить дендритные клетки из крови пациента и приумножить их вне организма. Дендритные клетки усиливаются в присутствии опухолевых антигенов, которые могут представлять собой один опухолеспецифический пептид/белок или лизат опухолевых клеток (раствор разрушенных опухолевых клеток). Эти клетки (с дополнительными адъювантами) инфузируются и провоцируют иммунный ответ.
Терапия дендритными клетками включает использование антител, которые связываются с рецепторами на поверхности дендритных клеток. Антигены могут быть добавлены к антителу и могут индуцировать созревание дендритных клеток и обеспечивать иммунитет к опухоли. В качестве мишеней для антител использовались рецепторы дендритных клеток, такие как TLR3 , TLR7 , TLR8 или CD40 . Интерфейс дендритных клеток и NK-клеток также играет важную роль в иммунотерапии. Разработка новых стратегий вакцинации на основе дендритных клеток должна также охватывать стимулирующую NK-клетки потенцию. Крайне важно систематически мониторить то, какой результат оказывают естественные киллеры в противоопухолевых клинических испытаниях.
Sipuleucel-T (Provenge) был одобрен для лечения бессимптомного или с минимальными симптомами метастатического кастрационно-резистентного рака предстательной железы в 2010 году. Лечение заключается в удалении антигенпрезентирующих клеток из крови методом и выращивании их с помощью гибридного белка PA2024, полученного из GM-CSF и (PAP) и реинфузии. Этот процесс повторяется три раза.
Предпосылкой иммунотерапии CAR-T является модификация Т-клеток для распознавания раковых клеток с целью более эффективного нацеливания и уничтожения их. Учёные собирают Т-клетки у людей, генетически изменяют их, чтобы добавить химерный антигенный рецептор (CAR), который специфически распознаёт опухолевые клетки, а затем вводят полученные CAR-Т-клетки пациентам, чтобы атаковать их опухоли.
Тисагенлеклеусел (Kymriah) – это химерный рецептор антигена (CAR-Т) терапии, был одобрен FDA в 2017 году для лечения острого лимфобластного лейкоза (ALL). Это лечение удаляет CD19 -позитивные клетки (В-клетки) из организма (включая больные и нормальные клетки, продуцирующие антитела).
(Yescarta) – ещё одна терапия CAR-T, одобренная в 2017 году для лечения острого лимфобластного лейкоза (DLBCL).

Антитела являются ключевым компонентом адаптивного иммунного ответа , играя центральную роль как в распознавании чужеродных антигенов, так и в стимулировании иммунного ответа. Антитела представляют собой Y-образные белки, продуцируемые некоторыми B-лимфоцитами , и состоят из двух областей: антигенсвязывающего фрагмента (Fab) , который связывается с антигенами, и области кристаллизации фрагмента (Fc) , которая взаимодействует с так называемыми Fc-рецепторами экспрессируемыми на поверхности различных типов иммунных клеток, включая макрофаги , нейтрофилы , и NK-клетки. Многие иммунотерапевтические схемы включают антитела. Технология моноклональных антител проектирует и генерирует антитела против специфических антигенов, таких как те, которые присутствуют на поверхности опухоли. Эти антитела чувствительны к антигенам опухоли, поэтому могут быть введены в опухоль.
В лечении рака используются два типа препаратов:
Способность Fc связывать Fc-рецепторы важна, потому что она позволяет антителам усиливать иммунную систему. Области Fc разнообразны: они существуют в многочисленных подтипах и могут быть дополнительно модифицированы, например, с добавлением сахаров в процессе, называемом гликозилированием . Перемены в области Fc могут изменить способность антитела вовлекать Fc-рецепторы и, как следствие, определять тип иммунного ответа, который запускает антитело. Например, , нацеленные на PD-1, представляют собой антитела, предназначенные для связывания PD-1, экспрессируемого Т-клетками, и реактивации этих клеток для устранения опухолей . Анти-PD-1 препараты содержат не только Fab-область, которая связывает PD-1, но и Fc-область. Экспериментальная работа показывает, что Fc-порция препаратов иммунотерапии рака может влиять на исход лечения. Например, Анти-PD-1 препараты с Fc-областями, которые связывают ингибиторные Fc-рецепторы, могут иметь сниженную терапевтическую эффективность. Визуализирующие исследования также показали, что Fc-область Анти-PD-1 препаратов может связывать Fc-рецепторы, экспрессируемые опухоль-ассоциированными макрофагами. Этот процесс удаляет лекарства от их предполагаемых целей (т. е. Молекулы PD-1 экспрессируются на поверхности Т-клеток) и ограничивает терапевтическую эффективность. Кроме того, антитела, нацеленные на Ко-стимулирующий белок CD40 , требуют взаимодействия с селективными Fc-рецепторами для оптимальной терапевтической эффективности. Вместе эти исследования подчёркивают важность статуса Fc в стратегиях таргетирования иммунных контрольных точек на основе антител.
Антитела могут поступать из различных источников, включая клетки человека, мышей и их комбинацию (химерные антитела). Различные источники антител могут провоцировать различные виды иммунных реакций. Например, иммунная система человека может распознавать мышиные антитела (также известные как крысиные антитела) и вызывать иммунный ответ против них. Это может снизить эффективность антител в качестве лечения и вызвать иммунную реакцию. Химерные антитела пытаются снизить иммуногенность мышиных антител путём замены части антитела соответствующим человеческим аналогом. Гуманизированные антитела почти полностью являются человеческими; вариабельных областей получается только из мышей. Человеческие антитела получаются с использованием немодифицированной человеческой ДНК.

(ADCC) требует, чтобы антитела связывались с поверхностью клеток-мишеней. Антитела формируются из области связывания (Fab) и области Fc, которые могут быть обнаружены клетками иммунной системы через их поверхностные рецепторы Fc . Fc-рецепторы находятся на многих клетках иммунной системы, включая NK-клетки. Когда NK-клетки сталкиваются с клетками, покрытыми антителами, Fc-области последних взаимодействуют с их Fc-рецепторами, высвобождая перфорин и , чтобы убить опухолевую клетку. Например, Ритуксимаб , Офатумумаб , Элотузумаб и Алемтузумаб . Разрабатываемые антитела имеют изменённые области Fc, которые имеют более высокое сродство к определённому типу Fc-рецептора, FcyRIIIA, что может значительно повысить эффективность.
Система комплемента включает в себя белки крови, которые могут вызвать гибель клеток после того, как антитело связывается с клеточной поверхностью ( классический путь активации системы комплемента , один из способов активации комплемента). Как правило, система имеет дело с чужеродными патогенами, но может быть усилена терапевтическими антителами при раке. Это можно сделать, если антитело химерное, гуманизированное или человеческое; до тех пор, пока оно содержит область IgG1 Fc . Комплемент может привести к гибели клеток путём усиления мембраноатакующего комплекса , известного как комплементзависимая цитотоксичность ; усиление ; и CR3- зависимой клеточной цитотоксичности. Комплементзависимая цитотоксичность возникает, когда антитела связываются с поверхностью раковой клетки, комплекс С1 связывается с этими антителами, и впоследствии в клеточной мембране рака образуются белковые поры.
Блокирование
Антитела также могут функционировать, связываясь с белками и физически блокируя их взаимодействие с другими белками. Ингибиторы контрольных точек (CTLA-4, PD-1 и PD-L1) действуют по этому механизму. Короче говоря, ингибиторы контрольных точек - это белки, которые обычно помогают замедлить иммунные реакции и предотвратить атаку иммунной системы на нормальные клетки. Ингибиторы контрольных точек связывают эти белки и препятствуют их нормальному функционированию, что повышает активность иммунной системы. Примеры включают , ипилимумаб , ниволумаб и пембролизумаб .
| Антитело | Бренд | Тип | Цель | Дата одобрения | Одобренное лечение |
|---|---|---|---|---|---|
| Алемтузумаб | Campath | гуманизированный | CD52 | 2001 | Т-лимфоцитный хронический лимфолейкоз (CLL) |
| Атезолизумаб | Tecentriq | гуманизированный | PD-L1 | 2016 | рак мочевого пузыря |
| Авелумаб | Bavencio | человеческий | PD-L1 | 2017 | метастатическая карцинома Меркеля |
| Yervoy | человеческий | CTLA4 | 2011 | метастатическая меланома | |
| Элотузумаб | Empliciti | гуманизированный | SLAMF7 | 2015 | множественная миелома |
| Офатумумаб | Arzerra | человеческий | CD20 | 2009 | рефракторный |
| Ниволумаб | Opdivo | человеческий | PD-1 | 2014 | нерезектабельная или , плоскоклеточный немелкоклеточный рак лёгких , почечно-клеточный рак, колоректальный рак, гепатоцеллюлярная карцинома, классическая лимфома Ходжкина |
| Пембролизумаб | Keytruda | человеческий | PD-1 | 2014 | нерезектабельная или , плоскоклеточный немелкоклеточный рак лёгких (NSCLC), лимфогранулематоз , (MCC), (PMBCL), рак желудка , рак шейки матки |
| Ритуксимаб | Rituxan, Mabthera | химический | CD20 | 1997 | неходжкинские лимфомы |
| Дурвалумаб | Imfinzi | человеческий | PD-L1 | 2017 | рак мочевого пузыря, немелкоклеточный рак лёгких |
Алемтузумаб (Campath-1H) – это анти- CD52 гуманизированное моноклональное антитело IgG1, предназначенное для лечения флударабин -рефрактерного хронического лимфолейкоза (CLL), , и . CD52 обнаруживается на >95% лимфоцитов периферической крови (как Т-клеток, так и В-клеток) и моноцитов , но его функция в лимфоцитах неизвестна. Он связывается с CD52 и инициирует его цитотоксический эффект с помощью механизмов фиксации комплемента и ADCC. Из-за антител-мишеней (клеток иммунной системы) распространёнными осложнениями терапии алемтузумабом являются инфекция, токсичность и .
(Imfinzi) – это моноклональное антитело к человеческому иммуноглобулину G1 kappa (IgG1k), которое блокирует взаимодействие запрограммированного лиганда клеточной смерти 1 (PD-L1) с молекулами PD-1 и CD80 (B7.1). Дурвалумаб одобрен для лечения пациентов с местнораспространенным или метастатическим уротелиальным раком, у которых:
16 февраля 2018 года Управление по контролю за продуктами и лекарствами одобрило применение дурвалумаба у пациентов с нерезектабельным немелкоклеточным раком лёгкого III стадии (NSCLC), заболевание которых не прогрессировало после одновременной химиотерапии на основе платины и лучевой терапии.
Ипилимумаб (Yervoy) - это человеческое антитело IgG1 , связывающее поверхностный белок CTLA4 . В нормальной физиологии Т-клетки активируются двумя сигналами: Т-клеточный рецептором , связывающимся с антиген - MHC-комплексом , и Т-клеточным поверхностным рецептором CD28, связывающимся с белками CD80 или CD86 . CTLA 4 связывается с CD80 или CD86, предотвращая связывание CD28 с этими поверхностными белками и, следовательно, отрицательно регулирует активацию Т-клеток.
Активные цитотоксические Т-лимфоциты необходимы иммунной системе для атаки клеток меланомы. Обычно ингибируемые активные специфичные для меланомы цитотоксические Т-клетки могут вызывать эффективный противоопухолевый ответ. Ипилимумаб может вызывать сдвиг соотношения регуляторных Т-клеток к цитотоксическим Т-клеткам для усиления противоопухолевого ответа. Регуляторные Т-клетки ингибируют другие Т-клетки, что может принести пользу в отношении опухоли.
Ниволумаб – это человеческое антитело IgG4 , которое предотвращает инактивацию Т-клеток, блокируя связывание запрограммированного лиганда 1 клеточной смерти 1 или запрограммированного лиганда 2 клеточной смерти 1 (PD-L1 или PD-L2), белка, экспрессируемого раковыми клетками, с PD-1 , белком, обнаруженным на поверхности активированных Т-клеток. Ниволумаб используется при прогрессирующей меланоме, метастатическом почечно-клеточном раке, прогрессирующем раке лёгких, прогрессирующем раке головы и шеи, а также лимфоме Ходжкина.
Офатумумаб – это человеческое антитело IgG1 второго поколения, которое связывается с CD20 . Он используется при лечении хронического лимфолейкоза (CLL), поскольку опухолевые клетки CLL обычно являются CD20-экспрессирующими В-клетками. В отличие от ритуксимаба, который связывается с большой петлёй белка CD20, офатумумаб связывается с отдельной маленькой петлёй. Это может объяснить их различные характеристики. По сравнению с ритуксимабом офатумумаб индуцирует комплементзависимую цитотоксичность в более низкой дозе при меньшей иммуногенности .
С 2019 года пембролизумаб , который блокирует PD-1 , запрограммированный белок клеточной смерти 1, используется путём внутривенной инфузии для лечения неоперабельной или метастатической меланомы, метастатического немелкоклеточного рака лёгкого (NSCLC) в определённых ситуациях, в качестве второй линии лечения плоскоклеточного рака головы и шеи (HNSCC), после химиотерапии на основе платины , а также для лечения взрослых и педиатрических пациентов с рефрактерным классическим лимфогранулематозом (cHL). Он также показан некоторым пациентам с уротелиальной карциномой, раком желудка и раком шейки матки.
Ритуксимаб - химерное моноклональное IgG1 -антитело, специфичное к CD20, разработанное из родительского антитела . Как и в случае с ибритумомабом, ритуксимаб нацелен на CD20, что делает его эффективным при лечении некоторых злокачественных опухолей В-клеток. К ним относятся агрессивные и вялые лимфомы, такие как , фолликулярная лимфома, а также лейкозы , такие как В-клеточный хронический лимфолейкоз . Хотя функция CD20 относительно неизвестна, CD20 может быть кальциевым каналом , участвующим в активации В-клеток. Способ действия антител заключается в основном в индукции ADCC и комплемент-опосредованной цитотоксичности . Другие механизмы включают апоптоз и остановку клеточного роста. Ритуксимаб также повышает чувствительность раковых В-клеток к химиотерапии.
Цитокины – это белки, продуцируемые многими типами клеток, присутствующих в опухоли. Они могут модулировать иммунные реакции. Опухоль часто использует их, чтобы разрастись и уменьшить иммунный ответ. Эти иммуномодулирующие эффекты позволяют использовать их в качестве лекарств для провоцирования иммунного ответа. Обычно используются цитокин-интерфероны и интерлейкины.
Интерлейкин-2 и интерферон -α – это цитокины, белки, которых регулируют и координируют поведение иммунной системы. Они обладают способностью усиливать противоопухолевую активность и поэтому могут использоваться в качестве пассивного лечения рака. Интерферон-α используется при лечении , связанной со СПИДом саркомы Капоши , фолликулярной лимфомы , хронического миелолейкоза и злокачественной меланомы . Интерлейкин-2 применяется при лечении злокачественной меланомы и почечно-клеточного рака.
Интерфероны вырабатываются иммунной системой. Они обычно участвуют в противовирусной реакции, но также имеют применение при раке. Они делятся на три группы: (IFNα и IFNβ), (IFNγ) и (IFNλ). IFNα был одобрен для использования при волосатоклеточном лейкозе, связанной со СПИДом саркоме Капоши, фолликулярной лимфоме, хроническом миелоидном лейкозе и меланоме. I и II тип ИФН были широко исследованы, и хотя оба типа способствуют противоопухолевым действиям иммунной системы, клинически эффективными оказались только ИФН I типа I. IFNλ хорошо проявил себя в качестве антитумора на моделях животных .
В отличие от ИФН I типа, интерферон гамма ещё не был одобрен для лечения любого рака. Однако улучшение выживаемости наблюдалось при введении интерферона гамма пациентам с раком мочевого пузыря и меланомой. Наиболее многообещающий результат был достигнут у пациенток со 2-й и 3-й стадиями рака яичников . Исследование ИФН-гамма в раковых клетках in vitro является более обширным, и результаты указывают на антипролиферативную активность ИФН-гамма, приводящую к ингибированию роста или гибели клеток, как правило, индуцируемой апоптозом, но иногда и аутофагией .
Интерлейкины оказывают огромное влияние на иммунную систему. Интерлейкин-2 применяется при лечении злокачественной меланомы и почечно-клеточного рака. При нормальной физиологии он стимулирует как эффекторные Т-клетки, так и Т-регуляторные клетки, но точный механизм его действия неизвестен.
Сочетание различных иммунотерапевтических препаратов, таких как ингибиторы PD1 и CTLA 4, может усилить противоопухолевый ответ, приводящий к длительным ответам.
усиливает иммуностимулирующий ответ и оказывает синергетический эффект при лечении метастатического рака.
Сочетание контрольных точек иммунотерапии с фармацевтическими препаратами имеет потенциал для улучшения ответа, и такие комбинированные методы лечения являются высоко изученной областью клинических исследований. Иммуностимулирующие препараты, такие как ингибиторы и агонисты TLR , были особенно эффективны в этой ситуации.
Министерство здравоохранения, труда и благосостояния Японии одобрило использование , выделенного из гриба Coriolus versicolor , в 1980-х годах для стимуляции иммунной системы пациентов, проходящих химиотерапию. Это пищевая добавка в США и других юрисдикциях.

Адоптивная Т-клеточная терапия – это форма путём переливания Т-клеток ( ). Они обнаруживаются в крови и тканях и обычно активируются при обнаружении чужеродных патогенов. В частности, они активируются, когда поверхностные рецепторы Т-клеток сталкиваются с клетками, которые отображают части чужеродных белков на своих поверхностных антигенах. Это могут быть либо инфицированные клетки, либо антигенпрезентирующие клетки (APCs). Они встречаются в нормальной и в опухолевой тканях, где они известны как опухолевые инфильтрирующие лимфоциты (TILs). Они активируются присутствием АЦП, таких как дендритные клетки, которые представляют опухолевые антигены. Хотя эти клетки могут атаковать опухоль, окружающая среда внутри опухоли обладает высокой иммуносупрессивной активностью, предотвращая иммунно-опосредованную гибель опухоли.
Было разработано множество способов продуцирования и получения опухолевых таргетных Т-клеток. Т-клетки, специфичные к опухолевому антигену, могут быть удалены из образца опухоли (TILs) или отфильтрованы из крови. Последующую активацию и культивирование проводят ex vivo, а полученные результаты реинфузируют. Активация может происходить с помощью генной терапии или путём воздействия на Т-клетки опухолевых антигенов.
По состоянию на 2014 год проводились многочисленные клинические испытания ACT. Важно отметить, что одно исследование, проведённое в 2018 году, показало, что клинические ответы могут быть получены у пациентов с метастатической меланомой, резистентной к многократным предыдущим иммунотерапиям.
В 2017 году FDA были одобрены первые 2 адоптивые Т-клеточной терапии: тисагенлеклеусел и .
Другой подход – адоптивный перенос гаплоидентичных или естественных киллеров от здорового донора. Основным преимуществом такого подхода является то, что эти клетки не вызывают . Недостатком часто является нарушение функции перенесённых клеток.
Многие опухолевые клетки чрезмерно экспрессируют CD47 , чтобы избежать иммуносупрессии иммунной системы хозяина. CD47 связывается со своим и подавляет фагоцитоз опухолевой клетки. Поэтому анти-CD47-терапия направлена на восстановление клиренса опухолевых клеток. Кроме того, всё больше данных подтверждают использование опухолевого антиген-специфического Т-клеточного ответа в ответ на анти-CD47-терапию. Ряд терапевтических средств разрабатываются, включая анти-CD47 антитела, инженерные , анти-SIRPα антитела и биспецифические агенты. По состоянию на 2017 год клинически тестировался широкий спектр солидных и гематологических злокачественных новообразований.
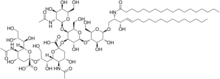
Углеводные антигены на поверхности клеток могут быть использованы в качестве мишеней для иммунотерапии. – это ганглиозид , обнаруженный на поверхности многих типов раковых клеток, включая нейробластома , ретинобластому , меланому, мелкоклеточный рак лёгких, опухоли головного мозга, остеосаркому , рабдомиосаркому , саркому Юинга , липосаркому , фибросаркому , и другие . Обычно он не экспрессируется на поверхности нормальных тканей, что делает его хорошей мишенью для иммунотерапии. По состоянию на 2014 год клинические испытания шли полным ходом.

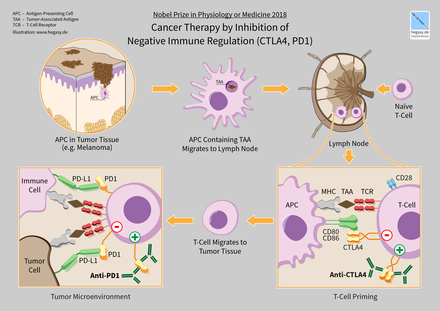
влияют на функцию иммунной системы. Иммунные контрольные точки могут быть стимулирующими или тормозящими. Опухоли могут использовать эти контрольные точки для защиты от атак иммунной системы. В настоящее время одобренные методы лечения контрольных точек блокируют ингибиторные рецепторы контрольных точек. Блокада сигналов отрицательной обратной связи к иммунным клеткам таким образом приводит к усиленному иммунному ответу против опухолей. При лимфоме Ходжкина и естественной киллерной Т-клеточной лимфоме частота ответа высока-50–60%. Однако частота ответов довольно низка при раке молочной железы и предстательной железы.
Одним из исследуемых лиганд-рецепторных взаимодействий является взаимодействие между трансмембранным белком (PDCD1, PD-1; также известным как CD279) и его лигандом, (PD-L1, CD274). PD-L1 на поверхности клетки связывается с PD1 на поверхности иммунной клетки, что ингибирует активность иммунных клеток. Среди функций PD-L1 ключевая регуляторная роль принадлежит активности Т-клеток. Похоже, что (опосредованная раком) повышенная регуляция PD-L1 на клеточной поверхности может ингибировать Т-клетки, которые в противном случае могли бы атаковать. PD-L1 на раковых клетках также ингибирует FAS - и интерферон-зависимый апоптоз, защищая клетки от цитотоксических молекул, продуцируемых Т-клетками. Антитела, которые связываются либо с PD-1, либо с PD-L1 и, следовательно, блокируют взаимодействие, могут позволить Т-клеткам атаковать опухоль.
Первым контрольным антителом, одобренным FDA, был ипилимумаб, одобренный в 2011 году для лечения меланомы. Он блокирует иммунную контрольную молекулу CTLA-4 . Клинические испытания также показали некоторые преимущества анти-CTLA-4 терапии при раке лёгких или поджелудочной железы, особенно в сочетании с другими препаратами. В текущих исследованиях комбинация блокады CTLA-4 с ингибиторами PD-1 или тестируется на различных типах рака.
Однако пациенты, получавшие блокаду контрольной точки (в частности, блокирующие антитела CTLA-4) или комбинацию блокирующих антител контрольной точки, подвергаются высокому риску возникновения побочных эффектов, связанных с иммунитетом, таких как дерматологические, желудочно-кишечные, эндокринные или печёночные аутоиммунные реакции. Это, скорее всего, связано с широтой индуцированной активации Т-клеток при введении анти-CTLA-4 антител путём инъекции в кровоток.
Используя мышиную модель рака мочевого пузыря, исследователи обнаружили, что местная инъекция низкой дозы анти-CTLA-4 в область опухоли обладает той же способностью ингибировать опухоль, что и при доставке антитела в кровь.[108] В то же время уровни циркулирующих антител были ниже, что позволяет предположить, что местное введение анти-CTLA-4 терапии может привести к меньшему количеству побочных эффектов.
Первые результаты клинических испытаний с антителом ниволумаб IgG4 PD1 были опубликованы в 2010 году . Ниволумаб был одобрен в 2014 году для лечения меланомы, рака лёгких, рака почек, рака мочевого пузыря, рака головы и шеи, а также лимфомы Ходжкина . Клиническое исследование 2016 года для немелкоклеточного рака лёгкого не смогло достичь своей первичной конечной точки для лечения в первой линии, но было одобрено FDA в последующих линиях терапии .
Пембролизумаб (кейтруда) – ещё один ингибитор PD1, одобренный FDA в 2014 году для лечения меланомы и рака лёгких .
Антитело является ингибитором PD-1 (разработанным для того, чтобы не связывать Fc гамма-рецептор I) и находится на стадии ранних клинических испытаний .
В мае 2016 года для лечения рака мочевого пузыря был одобрен ингибитор PD-L1 атезолизумаб
Анти-PD-L1 антитела, разрабатываемые в настоящее время, включают и , в дополнение к биотерапии.
Другие способы усиления [адоптивной] иммунотерапии включают нацеливание на так называемые , например . Ряд онкологических больных не реагируют на блокаду иммунных контрольных точек. Скорость ответа может быть улучшена путём сочетания блокады иммунных контрольных точек с дополнительными рационально подобранными противоопухолевыми препаратами (из которых некоторые могут стимулировать инфильтрацию Т-клеток в опухоли). Например, таргетная терапия, такая как лучевая терапия, сосудистые таргетные агенты и иммуногенная химиотерапия , может улучшить реакцию блокады иммунных контрольных точек на животных моделях рака.
Онколитический вирус – это вирус, который преимущественно заражает и убивает опухолевые клетки. Когда инфицированные опухолевые клетки разрушаются , они высвобождают новые инфекционные вирусные частицы или вирионы, чтобы помочь уничтожить оставшуюся опухоль. Считается, что онколитические вирусы не только вызывают прямое разрушение опухолевых клеток, но и стимулируют противоопухолевый иммунный ответ хозяина для длительной иммунотерапии.
Потенциал вирусов как противоопухолевых агентов был впервые осознан в начале двадцатого века, хотя скоординированные исследовательские усилия начались только в 1960-х годах. Ряд вирусов, включая аденовирус , реовирус , простой герпес , болезнь Ньюкасла и вакцина , в настоящее время прошли клинические испытания в качестве онколитических агентов. T-Vec - это первый одобренный FDA онколитический вирус для лечения меланомы. Ряд других онколитических вирусов находится в стадии II-III развития.
Некоторые соединения, содержащиеся в , в первую очередь полисахариды , могут регулировать иммунную систему и обладать противораковыми свойствами. Например, бета-глюканы , такие как , проявили себя в лабораторных исследованиях как стимуляторы макрофагов, естественных киллеров, Т-клеток и цитокинов иммунной системы и были исследованы в клинических испытаниях в качестве иммунологических адъювантов.
Многие опухоли экспрессируют мутации. Эти мутации потенциально создают новые таргетные антигены ( неоантигены ) для использования в Т-клеточной иммунотерапии. Наличие CD8+ Т-клеток в раковых поражениях, идентифицированных с помощью данных РНК-секвенирования, выше в опухолях с высокой мутационной нагрузкой. Уровень транскриптов, ассоциированных с цитолитической активностью естественных киллеров и Т-клеток, положительно коррелирует с мутационной нагрузкой во многих опухолях человека. У пациентов с немелкоклеточным раком лёгкого, получавших ламбролизумаб, мутационная нагрузка демонстрирует сильную корреляцию с клиническим ответом. У пациентов с меланомой, получавших ипилимумаб, долгосрочная польза также связана с более высокой мутационной нагрузкой, хотя и менее значимо. Предполагаемые MHC-связывающие неоантигены у пациентов с длительной клинической пользой были обогащены серией мотивов, которые не были обнаружены в опухолях пациентов с отсутствием или минимальной клинической пользой. Однако человеческие неоантигены, выявленные в других исследованиях, не демонстрируют смещения в сторону тетрапептидных сигнатур.
We demonstrate here for the first time the successful conjugation of a small molecule TLR7 agonist to an antitumor mAb (the anti-hCD20 rituximab) without compromising antigen specificity.
{{
cite journal
}}
: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (
ссылка
)
{{
cite news
}}
:
Указан более чем один параметр
|accessdate=
and
|access-date=
(
справка
)
{{
cite journal
}}
: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (
ссылка
)
{{
cite journal
}}
: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (
ссылка
)
{{
cite journal
}}
: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (
ссылка
)
{{
cite journal
}}
: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (
ссылка
)
{{
cite journal
}}
: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (
ссылка
)
{{
cite journal
}}
: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (
ссылка
)
{{
cite journal
}}
: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (
ссылка
)
{{
cite news
}}
:
Указан более чем один параметр
|accessdate=
and
|access-date=
(
справка
)
{{
cite news
}}
:
Указан более чем один параметр
|accessdate=
and
|access-date=
(
справка
)
{{
cite journal
}}
: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (
ссылка
)
{{
cite journal
}}
: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (
ссылка
)