Interested Article - Полудесмосомы

- 2020-05-28
- 1
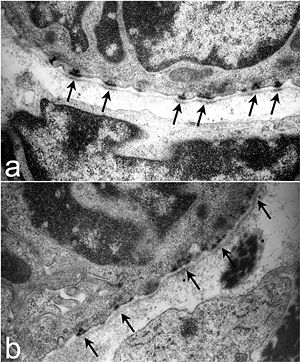
Полудесмосо́мы ( англ. Hemidesmosomes ) — клеточные контакты , расположенные на базальной стороне мембраны эпителиальной клетки и связывающие её с внеклеточным матриксом . Точнее, полудесмосомы связывают сеть промежуточных филаментов эпителиальных клеток с внеклеточным матриксом при помощи трансмембранных рецепторов . Электронная микроскопия показала, что структуры десмосом и полудесмосом очень похожи (полудесмосома выглядит как половина десмосомы, за что эта структура и получила своё название), однако десмосомы связывают не клетку и внеклеточный матрикс, а две соседние клетки. Основная функция полудесмосом заключается в прикреплении слоёв эпителия к базальной мембране .
Структура и состав
На основании белкового состава полудесмосомы можно подразделить на два типа. На цитоплазматической стороне полудесмосом первого типа находится пучок промежуточных филаментов ( кератинов и ), которые прикреплены к внутренней бляшке. Бляшка включает белки BP230 и , которые и связываются с белками промежуточных филаментов. Наружная бляшка содержит два вида трансмембранных белков-рецепторов: интегрин α6β4 и (также известен как BP180). От плазматической мембраны в базальную мембрану идут якорные филаменты, состоящие из BP180 и ламинина -332 — белок внеклеточного матрикса. В кишечнике обнаружены полудесмосомы второго типа, которые лишены BP180 и BP230 . В формировании полудесмосом участвует CD151 — белок семейства тетраспанинов , который находится на поверхности кератиноцитов и эндотелиоцитов . Важную роль в обеспечении стабильности полудесмосом играет белок BPAG1e .
Функции
Полудесмосомы обеспечивают прикрепление многослойного эпителия к базальной мембране. Полудесмосомы и десмосомы в клетке ориентированы под прямым углом друг к другу, благодаря чему они обеспечивают защиту от разных видов механического стресса. Связанные с промежуточными филаментами, полудесмосомы и десмосомы образуют плотную сеть, обеспечивающую структурную поддержку слоёв эпителия .
Несмотря на важную архитектурную роль, десмосомы и полудесмосомы не являются статическими структурами. Так, при ранении кожи клетки эпителия отсоединяются от базальной мембраны и мигрируют в область раны. Там они делятся , восстанавливая популяцию клеток в зоне ранения, и затем снова прикрепляются к базальной мембране (с помощью полудесмосом) и друг к другу (с помощью десмосом). Таким образом, полудесмосомы и десмосомы способны к обратимой разборке. Разборка полудесмосом происходит при фосфорилировании цитоплазматического участка молекулы интегрина, из-за чего она скручивается внутрь. При этом точка скрепления на плектине освобождается, что и запускает разборку. При разборке полудесмосомы их белки остаются в комплексе, который интернализуется посредством эндоцитоза . Когда клетки вновь присоединяются к базальной ламине, интегрин дефосфорилируется, комплексы вновь встраиваются в плазматическую мембрану, и полудесмосомы восстанавливаются .
Известно, что полудесмосомы участвуют в некоторых сигнальных путях , таких как миграция кератиноцитов и вторжение клеток карциномы в здоровый эпителий .
Клиническое значение
Заболевания, связанные с дисфункцией полудесмосом, проявляются в образовании пузырей на коже . Такие заболевания известны под общим названием буллёзный эпидермолиз (БЭ). При БЭ кожа становится хрупкой, отслаивается и покрывается волдырями в ответ на малейший механический стресс. Иногда также происходит отслоение эпителия роговицы , трахеи , пищеварительного тракта , пищевода , а также мышечная дистрофия .
Известно 12 мутаций генов белков полудесмосом, которые приводят к БЭ. Выделяют три типа БЭ: , и . При простом БЭ происходит разделение слоёв эпителия. К простому БЭ приводят мутации кератинов, плектина и BPAG1e. При соединительном БЭ наблюдается разделение слоёв базальной мембраны. К нему приводят, в частности, мутации интегрина α6β4 и ламинина-322. При дистрофическом БЭ сосочковый слой дермы отделяется от заякоривающих филаментов. Для этой разновидности БЭ характерны мутации в .
Примечания
- Nguyen N. M. , Pulkkinen L. , Schlueter J. A. , Meneguzzi G. , Uitto J. , Senior R. M. (англ.) // Respiratory Research. — 2006. — 16 February ( vol. 7 ). — P. 28—28 . — doi : . — .
- ↑ , с. 899.
- , с. 899—900.
- ↑ Walko G. , Castañón M. J. , Wiche G. (англ.) // Cell And Tissue Research. — 2015. — May ( vol. 360 , no. 2 ). — P. 363—378 . — doi : . — .
- ↑ , с. 900.
- Wilhelmsen K. , Litjens S. H. , Sonnenberg A. (англ.) // Molecular And Cellular Biology. — 2006. — April ( vol. 26 , no. 8 ). — P. 2877—2886 . — doi : . — .
- Fine J. D. , Bruckner-Tuderman L. , Eady R. A. , Bauer E. A. , Bauer J. W. , Has C. , Heagerty A. , Hintner H. , Hovnanian A. , Jonkman M. F. , Leigh I. , Marinkovich M. P. , Martinez A. E. , McGrath J. A. , Mellerio J. E. , Moss C. , Murrell D. F. , Shimizu H. , Uitto J. , Woodley D. , Zambruno G. (англ.) // Journal Of The American Academy Of Dermatology. — 2014. — June ( vol. 70 , no. 6 ). — P. 1103—1126 . — doi : . — .
Литература
- Кассимерис Л., Лингаппа В. Р., Плоппер Д. . Клетки по Льюину. — М. : Лаборатория знаний, 2016. — 1056 с. — ISBN 978-5-906828-23-1 .
- 2020-05-28
- 1