Interested Article - Биолюминесценция

- 2021-09-21
- 1

Биолюминесце́нция — способность живых организмов светиться, достигаемая самостоятельно или с помощью симбионтов . Название происходит от др.-греч. βίος « жизнь » + лат. lumen « свет » + лат. escendere «испускать». Свет создаётся у более высокоразвитых организмов в специальных светящихся органах (например, в фотофорах рыб), у одноклеточных и примитивных многоклеточных эукариот — в особых органоидах , а у бактерий — в цитоплазме .
Биолюминесценция является хемилюминесцентным процессом и обусловлена ферментативным окислением субстратов- люциферинов , катализируемых ферментами — люциферазами , в результате которого продукт окисления образуется в возбуждённом электронном состоянии, переход продукта окисления из возбуждённого состояния в основное сопровождается излучением фотона в видимом спектральном диапазоне.
История исследований


Свечение живых организмов отмечалось ещё античными авторами — Плиний Старший в своей «Естественной истории» упоминал свечение морских организмов , многие авторы описывали свечение моря . Однако изучение природы биолюминесценции берёт своё начало в 1668 году , когда Роберт Бойль , крупнейший представитель пневмохимии, изучавший процессы горения, обнаружил сходство между процессами горения угля и свечением гнилушек — Бойль, используя построенный им вакуум-насос , продемонстрировал, что в обоих случаях свечение исчезает, если удалить воздух (то есть кислород ).
Пионером в исследовании механизмов биолюминесценции стал Рафаэль Дюбуа, поставивший эксперимент (1887) с экстрактами из светлячков Pyrophorus — он обнаружил, что экстракт тканей фотофоров светляков, полученный гомогенизацией в холодной воде, светится в течение нескольких минут, однако экстракт, приготовленный в горячей воде, не светится. Вместе с тем Дюбуа обнаружил, что если добавить к потухшему холодному экстракту порцию несветящегося горячего экстракта, то свечение возобновляется. Таким образом, за свечение были ответственны две фракции: устойчивая к нагреву низкомолекулярная, и белковая, теряющая активность при нагревании; свечение in vitro возникало только в присутствии обеих фракций и в присутствии кислорода. Аналогичные результаты Дюбуа получил и при эксперименте со светящимися двустворчатыми моллюсками Pholas dactylus . Такое поведение типично для систем фермент — субстрат , поэтому Дюбуа назвал субстратную фракцию люциферином, а белковую — люциферазой и постулировал ферментативную природу реакций, вызывающих биолюминесценцию .
Работы Дюбуа положили основу для дальнейших работ в исследовании биолюминесценции, оказалось, что у различных групп организмов существует множество систем люциферин — люцифераза.
в Принстонском университете начал работы по изучению биолюминесценции ракообразных. Харви показал (1920) различие люциферазных субстрат-ферментных систем различных таксонов : люциферин моллюсков Pholas не светился под действием люциферазы ракообразных Cypridina и наоборот, люцифераза Pholas была неактивна по отношению к люциферину Cypridina .
В 1957 был выделен и охарактеризован люциферин светляков, оказавшийся производным тиазола .

В конце 1950-х — начале 1960-х Осаму Симомура в университете Нагоя исследовал механизм свечения остракод Cypridina hilgendorfii , которые использовались во время Второй Мировой Войны японцами как природный люминофор: высушенные рачки при смачивании снова начинали светиться. Ему удалось выделить из них в чистом кристаллическом состоянии новый люциферин, отличающийся от люциферина светляков . В качестве объекта дальнейших исследований биолюминесценции в Принстоне он избрал медузу , фотофоры которой излучают зелёный свет. Симомура выделил из медуз экворин — белок, содержащий имидазопиразин целентеразин и показал, что биолюминесценция экворина инициируется ионами кальция, при этом, в отличие от классической биолюминесценции, для излучения света экворином кислород не требовался. Это стало открытием нового класса биолюминесцентных систем — , в которых светоизлучающий фрагмент является не свободным субстратом — люциферином, а простетической группой , прочно связанной с белком.
Симомура также обнаружил, что выделенный из медузы и очищенный экворин in vitro излучает синий свет, в то время как живая медуза светится зелёным. Дальнейшие исследования показали, что за зелёное свечение ответственен другой белок — GFP ( англ. green fluorescent protein — зелёный флуоресцирующий белок), излучающий зелёный свет под действием голубого излучения экворина; и экворин, и GFP в дальнейшем вошли в лабораторную практику молекулярной биологии, первый — как индикатор присутствия ионов Ca 2+ , второй — в качестве флуоресцентной метки для изучения экспрессии клеточных белков. За работы по GFP Симомура был удостоен нобелевской премии по химии 2008 года .
Физико-химические механизмы биолюминесценции
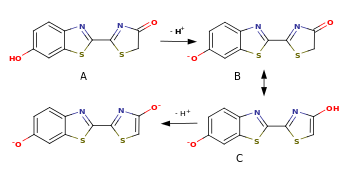
A — нейтральная кетоформа λ max = 618 нм
B — анион (фенолят) кетоформы
C — анион енольной формы, λ max = 587 нм
D — енолят-дианион, λ max = 556 нм
Хемилюминесценция возникает при многих химических реакциях — например, при рекомбинации свободных радикалов или в реакциях окисления (при свободнорадикальном окислении паров белого фосфора в газовой фазе, окислении люминола в полярных органических растворителях и т. п.). В этом случае, как и в реакциях биолюминесценции, выделяющаяся энергия не рассеивается в виде тепла, как это происходит в ходе большинства экзотермических химических реакций, а расходуется на образование одного из продуктов реакции в возбуждённом электронном состоянии. Для излучения света в ходе хемилюминесцентной реакции необходимо выполнение, как минимум, двух условий: во-первых, энергия, выделяющаяся в ходе реакции, должна превышать ~41-71,5 ккал/моль и, во-вторых, разница энергий основного и возбуждённого состояния продукта реакции должна быть ниже энтальпии химической реакции.

При соблюдении этих условий возможно образование с достаточно высоким выходом окисленной формы люциферина в возбуждённом состоянии и дальнейший переход в основное состояние с испусканием фотона видимого спектрального диапазона. Отношение числа излучённых фотонов к общему числу элементарных актов реакции называется квантовым выходом реакции, квантовые выходы биолюминесценции, в отличие от большинства хемилюминесцентных реакций, очень высоки и достигают значений 0,1-1. Такие квантовые выходы для реакций, протекающих в водных растворах при нейтральных значениях pH, необычны для хемилюминесцентных процессов и обусловлены специфичной ферментативной природой окислительных реакций биолюминесценции, катализируемых люциферазными комплексами.
Длина волны излучаемого при биолюминесцентных процессах света зависит от разности энергий основного и возбуждённого состояний окислённых форм люциферинов и связана с ней отношением , полуширина полосы излучения составляет обычно ~50 нм. Поскольку процесс перехода возбуждённое — основное состояние обратим, то спектры флуоресценции оксилюциферинов близки к спектрам биолюминесценции: в обоих случаях излучает молекула оксилюциферина, переведённая в возбуждённое состояние либо вследствие химической реакции (биолюминесценция), либо вследствие поглощения достаточно энергетичного фотона.
Вместе с тем, максимум в спектре излучения в биолюминесцентных процессах может изменяться в зависимости от условий протекания реакции. Например, несмотря на то, что химизм биолюминесценции жуков-светляков одинаков и структуры люциферина и оксилюциферина различных видов идентичны, цвет свечения может варьировать от голубого до красного, то есть максимум в спектре излучения может меняться от 490 до 622 нм. Более того, у личинок бразильских жуков- фенгонид рода Phrixothrix есть несколько органов-фотофоров, испускающих свет различных оттенков — красного фотофоров головы и жёлто-зелёного фотофоров брюшка . Такое изменение спектра излучения возможно, когда оксилюциферин может существовать в нескольких формах с различной энергией основного состояния, что, в свою очередь, соответствует различающимся энергиям перехода из возбуждённого состояния и, вследствие этого, к различным максимумам в спектре излучения при переходе из возбуждённого состояния в основное.

A — возбуждённая молекула оксилюциферина в микроокружении молекулы — предшественницы
R — релаксация сольватной оболочки и белкового окружения
B — возбуждённая молекула оксилюциферина в релаксировавшем микроокружении
P — протонирование или таутомеризация
C — таутомер оксилюциферина
Энергии S 1 > S 1 R > S 1 P , максимумы излучения λ A max < λ B max < λ C max
Оксилюциферин светляков способен к кето-енольной таутомерии и в растворах существует в виде смеси кетонной и енольной форм. Отношение количеств кето- и енольного таутомеров зависит от pH среды: в слабощелочных условиях (pH 7.5 — 7.8 и выше) преобладает енольная форма, при этом максимум в спектре биолюминесценции приходится на 587 нм, то есть на жёлтую область, при закислении среды (pH < 6) преобладающей становится кетонная форма и максимум в спектре излучения сдвигается в длинноволновую область до 618 нм, то есть в красную область. При подщелачивании среды образуется енолят-анион оксилюциферина, и максимум в спектре смещается в коротковолновую область до 556 нм (зелёный свет). При промежуточных значениях pH в растворе присутствует смесь обеих форм и спектр излучения оказывается бимодальным, воспринимаемый глазом промежуточный оттенок получается вследствие аддитивного смещения жёлто-зелёного и красного света .
Другим фактором, влияющим на спектр биолюминесценции, является микроокружение молекулы оксилюциферина в основном и возбуждённом состояниях. На значения энергетических уровней основного и возбуждённого состояний молекулы оксилюциферина в среде оказывает влияние и энергия их взаимодействия как с люциферазой , так и с растворителем (энергия сольватации ), и образование водородных связей : чем сильнее возбуждённая молекула ассоциирована с микроокружением и чем выше его поляризуемость, тем ниже энергия возбуждённого состояния, тем меньше энергия испускаемого фотона и тем сильнее сдвиг максимума спектра излучения в длинноволновую область.
Третьим фактором, влияющим на энергию возбуждённого состояния оксилюциферина и, соответственно, спектральный максимум, являются релаксационные процессы микроокружения. При отщеплении CO 2 от 1,2-диоксетанового предшественника оксилюциферина светляков происходит очень быстрая перестройка электронной структуры молекулы и резкое изменение её дипольного момента , при этом возбуждённая молекула оказывается в сольватной оболочке молекулы — предшественницы. Время жизни молекулы осилюциферина в возбуждённом синглетном состоянии составляет ~ 10 −9 −10 −8 секунды, и если за это время молекулы растворителя или окружающие активный центр белковые цепи люциферазы не успевают переориентироваться в новое равновесное состояние, то энергия возбуждённого состояния оксилюциферина оказывается максимальной, а максимум спектра сдвинут в коротковолновую область, то есть длина волны излучаемого света оказывается зависимой от скорости релаксации микроокружения — и в том числе от подвижности белковых цепей люциферазы .
Вероятно, наиболее экстремальным примером влияния микроокружения на спектральный максимум биолюминесценции являются люциферазы жуков Phrixothrix . У личинок и неотеничных самок этих жуков фотофоры, расположенные в головном сегменте светятся красным, а фотофоры остальных сегментов — жёлто-зелёным, при этом в фотофорах обоих типов окисляется один и тот же люциферин тиазольный насекомых, но окисление катализируется различными люциферазами, отличающимися по размеру и аминокислотной последовательности «кармана связывания» люциферина «зелёной» и «красной» люцифераз: размер полости «красной» люциферазы больше, чем «зелёной». Предполагается, что большая полость активного центра менее жёстко связывает молекулу возбуждённого оксилюциферин-аниона, а её конфигурация — к его лёгкому протонированию, что приводит к сдвигу максимума излучения в красную область .
И, наконец, особым случаем, ведущим к изменению спектра биолюминесценции, является переизлучение энергии, выделяемой при окислении люциферинов, флуоресцентными белками — такой механизм наблюдается у некоторых люминесцирующх бактерий и медуз и приводит к смещению спектрального максимума в длинноволновую область. У бактерий, в клетках которых присутствует жёлтый флуоресцентный белок (YFP, англ. yellow fluorescent protein ) предполагается индуктивно-резонансный межмолекулярный перенос энергии (механизм Фёрстера) от люциферин-люциферазного комплекса к флуоресцентному белку. Этот механизм может играть весьма существенную роль и становиться основным механизмом биолюминесценции: было показано, что in vitro при добавлении к целентеразиновой люциферин-люциферазной системе полипов-альционарий Renilla reniformis , излучающей с максимумом 480 нм, зелёного флуоресцентного белка Renilla квантовый выход люминесценции на длине волны GFP 510 нм повышается в три раза .
Типы люциферин-люциферазных систем
Как уже упоминалось, необходимым условием биолюминесценции является высокая энтальпия реакции окисления люциферина: энергия, выделяющаяся в ходе реакции должна превышать ~41-71.5 ккал/моль, — что соответствует энергиям электромагнитного излучения в видимом диапазоне ~400-700 нм, эта энергия соизмерима с энергией связи C-C в алканах (~79 ккал/моль). Такой энергетический эффект значительно превышает энергетические эффекты большинства биохимических реакций — в том числе и с участием макроэргических соединений — носителей энергии в живых системах; так, например, энергия, высвобождающаяся при гидролизе АТФ до АМФ составляет 10.9 ккал/моль.

Энергия, соответствующая энергиям видимого спектра, в живых системах может быть получена только в реакциях одностадийного окисления с участием молекулярного кислорода (или активных форм кислорода ), поэтому большинство люцифераз относятся к классу ферментов — оксигеназ , катализирующих реакции, в которых происходит присоединение кислорода к субстрату-люциферину (за немногими исключениями люцифераз кольчатых червей, обладающих активностью) и, соответственно, все светящиеся организмы являются аэробами .
Многие люциферины при окислении образуют циклические напряжённые промежуточные пероксиды — диоксетаноны, в которых валентные углы в четырёхчленном цикле существенно отличаются от нормальных валентных углов, такие соединения далее распадаются с выделением молекулы углекислого газа и образованием возбуждённого кетона -люциферина. Такой механизм реакции характерен для окисления люциферина насекомых и целентеразинов — люциферинов многих морских организмов.
В настоящее время известно шесть основных классов люциферинов различной химической природы, распространённые в различных группах живых организмов: альдегид - флавиновая система бактерий и некоторых грибов, альдегидные люциферины морских червей и пресноводных моллюсков, тетрапирролы динофлагеллят и некоторых ракообразных, имидазопиразолы различных морских организмов и люциферин насекомых — производное тиазола и пираноновая система грибов .
Альдегид-флавиновая система бактерий
Биолюминесцирующие бактерии широко распространены в морских экосистемах, и среди них присутствуют как свободноживущие в морской воде виды, так и фотобактерии-симбионты, обитающие в фотофорах светящихся организмов (рыб, головоногих) и обуславливающих их свечение. Эти фотобактерии принадлежат родам Alteromonas ( Shewanella ), Beneckea , Photobacterium и Vibrio , причём представители рода Photobacterium преимущественно являются симбионтами, обитающими в светящихся органах морских организмов — головоногих и рыб. На суше фотобактериями представлены родами Vibrio и Xenorhabdus ( Xenorhabdus Luminescens ) являются симбионтами нематод-паразитов гусениц) .
До середины XX века механизм бактериальной биолюминесценции оставался неизвестным — трудность заключалась в том, что провести классическую люциферин-люциферазную реакцию с экстрактами бактерий по Дюбуа не удавалось. В 1953 г. Стрелер обнаружил, что восстановленная форма никотинамидадениндинуклеотида (NADH) вызывает свечение бактериального экстракта — однако это свечение имеет весьма невысокую интенсивность, которая, однако, существенно возрастает при добавлении прокипячённого бактериального экстракта. Предположив, что носителем активирующего фактора являются фрагменты бактериальных клеток, присутствующие в экстракте, Стрелер совместно с Милтоном Кормье предприняли систематическое тестирование экстрактов различных тканей животных на стимулирующую свечение активность. В итоге, они обнаружили, что экстракты печени и коркового вещества почек свиньи активируют люминесценцию бактериального экстракта в присутствии NADH и кислорода, экстракцией хлороформом коркового вещества почек свиньи и дальнейшей очисткой экстракта им удалось выделить активирующий люминесценцию фактор в чистом виде — им оказался алифатический альдегид гексадеканаль. Стрелер и Кормье также обнаружили что и альдегиды-гомологи, в частности деканаль и додеканаль, также активируют люминесценцию , . В течение 20 лет роль альдегида и природа соединения-эмиттера, ответственного за излучение света, оставались неизвестными.
Дальнейшим шагом стали работы Мак Элроя и Грина (1955 г.), продемонстрировавших, что для реакции люминесценции, катализируемой бактериальным люциферазным комплексом, кроме NADH, алифатического альдегида и кислорода, необходимо и производное рибофлавина — флавинмононуклеотид , являющийся коферментом многих оксидоредуктаз и встречающийся во всех живых организмах. Сопряжённое окисление восстановленого флавинмононуклеотида и альдегида приводит к образованию возбуждённого флавинового фрагмента, испускающего голубой свет с λ max 490 нм:
- RCHO + FMNH 2 + O 2 = RCOOH + FMN + H 2 O + hν ,
процесс катализируется бактериальной люциферазой — ФМН-зависимая алканальмонооксигеназа ( англ. alkanal monooxygenase (FMN-linked) , КФ 1.14.14.3):
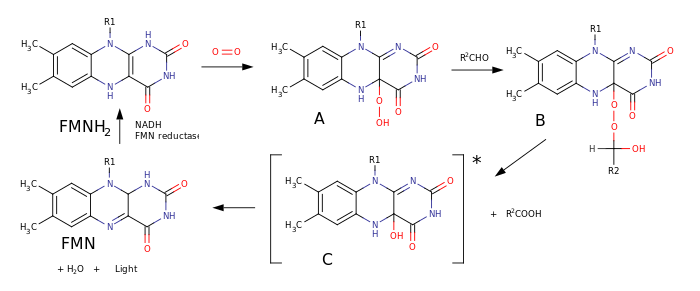
-
Механизм биолюминесценции бактерий:
1. К молекуле FMNH 2 присоединяется молекула кислорода с образованием гидропероксида A
2. Гидропероксид A реагирует с альдегидом, образуя пероксиполуацеталь B
3. Пероксиполуацеталь B претерпевает перегруппировку Байера-Вилигера с образованием карбоновой кислоты и эмиттера C - 4а-гидрокси-5-гидрофлавинмононуклеотида в возбуждённом состоянии
4. Эмиттер C испускает квант света и отщепляет молекулу воды, образуя флавинмононуклеотид
5. Флавинмононуклеотид FMN восстанавливается NADH до исходного FMN при катализе NAD(F) H: FMN-оксидоредуктазой
Таким образом, люминесцентный комплекс бактерий, в отличие от люциферин-люциферазных систем большинства многоклеточных организмов, обладает рядом замечательных особенностей. Во-первых, поскольку при окислении расходуется альдегид, то, формально, он является люциферином — но, в отличие от люциферинов динофлагеллят, кишечнополостных и членистоногих, не является эмиттером света. Во-вторых, в качестве двух ключевых компонентов люминесцентной цепи выступают NAD и FMN — нуклеотиды-коферменты оксидоредуктаз, встречающиеся во всех организмах, производное последнего является эмиттером. В третьих, в клетках многих светящихся бактерий присутствуют флуоресцентные белки, переизлучающие испускаемый возбуждённым 4а-гидроксифлавин-люциферазным комплексом сине-зелёный свет в длинноволновой жёлто-зелёной области.
В настоящее время известно два типа таких флуоресцентных белков — «люмазиновые белки» (LumP), содержащие в качестве флуорофора производное 2,4-диоксо птеридина (люмазина) — 6,7-диметил-8-(1’-D- рибитил)люмазин, присутствующие в бактериях P. Phosphoreum и P. Fisheri , и жёлтый флуоресцентный белок ( англ. yellow fluorescent protein , YFP) штамма Y-1 бактерии P. Fisheri , содержащий в качестве флуорофора флавинмононуклеотид или рибофлавин. В присутствии LumP максимум излучения сдвигается до 475 нм, в присутствии YFP — до 540 нм.
Структура бактериальной люцифразы сходна со структурой нефлуоресцирующего бактериального флавопротеида — предполагается, что оба этих белка в ходе эволюции произошли от одного предшественника. По данным рентгеноструктурного анализа люцифераза является гетеродимером, состоящим из двух субъединиц, причём предполагается, что FMH в бактериальной люциферазе играет роль не кофактора, а субстрата .
Флавиновая система грибов Lampteromyces
Другим примером биолюминесции, в которой эмиттером является рибофлавин, является люминесценция японских грибов Lampteromyces japonicus . Детально механизмы биолюминесценции этих грибов пока неизвестны — в настоящее время надёжно не идентифицированы ни люциферин, ни люцифераза, однако было показано, что свет испускается — рабофлавинил-α-рибофуранозидом и in vitro люминесценция гомогената, содержащего ламптерофлавин, индуцируется добавлением L- тирозина .
Пироновая система грибов
Бимолюминесценция — зелёное свечение с максимумом в 520—530 нм — характерна для многих родов высших грибов ( Mycena , Omphalotus , Armillarea и др.) и изучается уже более 100 лет, однако её механизмы — в том числе попытки выделить и идентифицировать люциферин — долгое время оставались безуспешными. В качестве кандидатов на роль предшественников люциферинов грибов предлагался ряд алициклических и ароматических альдегидов — в том числе альдегид кофейной кислоты .
По крайней мере один из люциферинов грибов был идентифицирован в начале XXI века — им оказался 3-гидроксигиспидин, производное α-пирона, предшественником которого, хотя и не непосредственным, является кофейная кислота .
При биосинтезе 3-гидроксигиспидина кофейная кислота конденсируется с малонил- коферментом-А (Malonyl-CoA), образуя широко распространённый в составе грибов . В свою очередь, гиспидин окисляется при катализе NAD - с образованием люциферина — 3-гидроксигиспидина.
Присоединение к α-пироновому фрагменту 3-гидроксигиспидина кислорода, катализируемое люциферазой гриба, приводит к образованию мостикового пероксида , который разлагается, испуская свет, с образованием кофеилпировиноградной кислоты, последняя гидролизуется с образованием исходной кофейной кислоты :

Тетрапирролы динофлагеллят и ракообразных
Ещё одним примером люциферин-люциферазных систем, в которых участвуют люциферины, структурно близкие с веществами, вовлечёнными в основные метаболические процессы, являются тетрапиррольные люциферины одноклеточных водорослей — динофлагеллят и эвфаузиевых ракообразных. Окисление этих люциферинов ведёт к голубому свечению, свечение динофлагеллят при их массовом размножении обуславливает свечение моря .
Структура этих люциферинов ( A ) содержит четыре пиррольных ядра и очень близка к структуре хлорофилла C1 ( B ), однако, в отличие от хлорофиллов тетрапиррольные люциферины незамкнуты; люциферин эфваузид представляет собой гидроксипроизводное люциферина динофлагеллят .
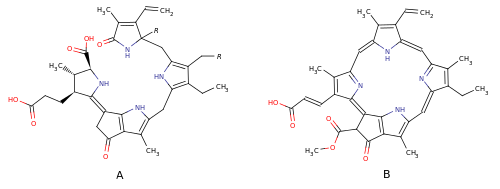
В настоящее время окончательно не выяснено, синтезируют ли эфваузиды люциферин самостоятельно или получают его при питании динофлагеллятами.
Имидазопиразины морских беспозвоночных

В биолюминесцентных системах морских организмов самых различных таксонов — от кишечнополостных до ракообразных — широко распространны люциферины, в основе структуры которых лежит имидазопиразиновое ядро . Вместе с тем, такое таксономическе разнообразие ведёт и к разнообразию имидазопиридазиновых биолюминесцентных систем ведёт к тому, что в качестве люциферина выступают, по меньшей мере, пять форм имидазопиразинов:
- ракушковых ракообразных ( Ostracoda );
- книдарий и щетинкочелюстных ;
- дисульфат целентеразина, являющийся люциферином кальмаров-светлячков Watasenia scintillans ;
- пероксид целентеразина, выступающий в роли функциональной группы белков экворина и обелий
- дегидроформа в составе — фотопротеина кальмаров.
Альдегидные люциферины червей

Среди кольчатых червей биолюминесцентные виды встречаются у двух классов — морских полихет и у обитающих на суше олигохет .
Природа биолюминесцентных комплексов полихет в настоящее время остаётся неизвестной, в случае олигохет Diplocardia Longa в качестве люциферина был идентифицирован простой алифатический аминоальдегид — N-изоварелил-3-амино-1- пропаналь. Реакция начинается с присоединения перекиси водорода к альдегидной группе люциферина с образованием пероксиполуацеталя, который под действием люциферазы распадается с излучением света . Люцифераза Diplocardia представляет собой металлофермент с молекулярной массой ~300 КДа, содержащий одновалентную медь. Особенностью химизма биолюминесценции Diplocardia , отличающего его от большинства биолюминесцентных механизмов, является участие в роли окислителя не кислорода, а перекиси водорода — то есть в данном случае люцифераза обладает пероксидазоподобной активностью. Подобный пероксидазный механизм биолюминесценции предполагается и у полухордовых — в частности, желудевых червей Balanoglossus bimiensis in vitro люцифераза может быть заменена пероксидазой хрена .
Альдегидные люциферины моллюсков

Новозеландские брюхоногие моллюски Latia neritoides , выделяющие светящуюся зелёным светом слизь, примечательны тем, что в настоящее время (2009 г.) являются единственным известным видом пресноводных моллюсков, способных к биолюминесценции. Люциферином является формиат енольной формы терпенового альдегида, который окисляется до дигидро-β-ионона, муравьиной кислоты и углекислого газа. Было синтезировано несколько аналогов, содержащих енолформиатную и енолацетатную группу и было показано, что триметилциклогексановое кольцо люциферина является необходимым структурным фрагментом для люминесценции при окислении . Люцифераза ( Latia -люциферин-2-монооксигеназа (деметилирующая), КФ 1.14.99.21) представляет собой белок с молекулярной массой ~170 КДа, в реакции также участвует «пурпурный белок» с молекулярной массой ~40 КДа (Shimom. p. 187). Роль «пурпурного белка» пока неясна, он участвует в реакции не в стехиометрических, а каталитических количествах и может быть заменён аскорбатом + NADH, предполагается, что он участвует в регенерации одного из субстратов люциферин-люциферазной системы. Первоначально предполагалось, что «пурпурный белок» может являться эмиттером в процессе люминесценции Latia , однако это предположение не подтвердилось .
Биологические функции

Биолюминесценция выполняет следующие биологические функции:
- привлечение добычи или партнёров
- коммуникация
- предупреждение или угроза
- отпугивание или отвлечение
- маскировка на фоне естественных источников света
Во многих случаях функция биолюминесценции в жизни отдельных светящихся организмов выяснена не до конца, либо вообще не изучена.
См. также
Примечания
- C. Plinius Secundus . Naturalis Historia, Liber IX, XLIII (de pisce qui noctibus lucet)
- Dubois. Note sur las physiologie des pyrophores. C. R. Seances Soc. Biol.2:559-562 (1885)
- R. Dubois. Note sur la fonction photogenique chez la Phpolas Dactilus . C. R. Seances Soc. Biol. 39:564-566 (1887)
- B. Bilter, W. D. McElroy. Preparation and properties of crystalline firefly luciferin. Arch. Biochem. Biophys. 72:358-368 (1957)
- Shimomura, Osamu; Toshio Goto, Yoshimasa Hirata. (англ.) // : journal. — 1957. — Vol. 30 , no. 8 . — P. 929—933 . — ISSN . — doi : . (недоступная ссылка)
- (недоступная ссылка)
- Viviani, Vadim R.; Etelvino J. H. Bechara, Yoshihiro Ohmiya. (англ.) // Biochemistry : journal. — 1999. — Vol. 38 , no. 26 . — P. 8271—8279 . — doi : .
- ↑ Ugarova, N. N.; L. G. Maloshenok, I. V. Uporov, M. I. Koksharov. (англ.) // : journal. — 2005. — Vol. 70 , no. 11 . — P. 1262—1267 . — ISSN . — doi : .
- . Дата обращения: 21 августа 2020. 11 августа 2020 года.
- Bevilaqua, V. R.; Matsuhashi, T.; Oliveira, G.; Oliveira, P. S. L.; Hirano, T.; Viviani, V. R. Phrixotrix luciferase and 6′-aminoluciferins reveal a larger luciferin phenolate binding site and provide novel far-red combinations for bioimaging purposes (англ.) // : journal. — 2019. — Vol. 9 , no. 1 . — ISSN . — doi : .
- H Morise, O Shimomura, FH Johnson, J Winant: Intermolecular Energy Transfer in Bioluminescent systems of aequorea. Biochemistry 13 (1974) 2656-62.
- ↑ Aubin Fleiss and Karen S. Sarkisyan. от 27 декабря 2020 на Wayback Machine . Curr Genet. 2019; 65(4): 877—882. PMID
- E. A. Meighen, P. V. Dunlap. Physiological, Biochemical and Genetic Control of Bacterial Bioluminescence // Rose, Anthony H. Advances in Microbial Physiology, Vol. 34. — Academic Press, 1993-01-01. — ISBN 0120277344 , 9780120277346.
- Strehler B.L., Cormier M.J. Arch. Biochem. and Biophys., 1953, v.17, № 1, p.16-33
- Cormier M.J., Strehler B.L. J. Amer. Chem. Soc., 1953, v.75, № 5, p. 4864-4865
- Fisher, Andrew J.; Thomas B. Thompson; James B. Thoden; Thomas O. Baldwin; Ivan Rayment (1996). . Journal of Biological Chemistry . 271 (36): 21956—21968. doi : . Дата обращения: 1 мая 2010 .
- Uyakul, Duangchan; Minoru Isobe; Toshio Goto (1989). . Bioorganic Chemistry . 17 (4): 454—460. doi : . ISSN . Дата обращения: 11 мая 2011 .
- . Дата обращения: 21 августа 2020. 24 января 2022 года.
- ↑ от 15 августа 2020 на Wayback Machine . PNAS December 11, 2018. 115 (50). 12728-12732; doi :
- ;
- . Дата обращения: 21 августа 2020. 28 января 2007 года.
- Ohtsuka, Hiroko; Noel G. Rudie; John E. Wampler (1976). . Biochemistry . 15 (5): 1001—1004. doi : . Дата обращения: 6 января 2010 .
- Nakamura, Mitsuhiro; Masashi Mamino; Mizuki Masaki; Shojiro Maki; Ryo Matsui; Satoshi Kojima; Takashi Hirano; Yoshihiro Ohmiya; Haruki Niwa (2005). . Tetrahedron Letters . 46 (1): 53—56. doi : . ISSN . Дата обращения: 3 мая 2010 .
- Мецлер. Биохимия живой клетки, т.3, стр. 73. М.: Мир, 1980
Литература
- Книги
- Shimomura, Osamu. (англ.) . — World Scientific , 2006. — ISBN 9812568018 , 9789812568014.
- Гительзон И. И. Живой свет океана. — М. : Наука , 1976. — (серия «Проблемы науки и технического прогресса» АН СССР ). — 45 000 экз.
- Статьи
- Борис Юдин. Живой свет в природе // Глобус,1977 : географический сборник для детей. — Л. : Детская литература , 1977. — С. 324—329 .
Ссылки
- С.Б. Ланда, Петербургский институт ядерной физики им. Б. П. Константинова РАН 188350 Гатчина, Орлова роща . Дата обращения: 25 декабря 2009.
- 2021-09-21
- 1
