Interested Article - Коллаген
- 2021-07-28
- 2
Коллаге́н — гликопротеин, фибриллярный белок , составляющий основу соединительной ткани организма ( сухожилие , кость , хрящ , дерма , фасция и т. п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у животных ; отсутствует у растений , бактерий , вирусов , простейших и грибов . Коллаген — основной компонент соединительной ткани и самый распространённый белок у млекопитающих , составляющий от 25 % до 45 % белков во всём теле. Синтез коллагена очень энергозатратен и происходит только у животных, которые используют кислород . Появление коллагена позволило создать скелет, как внешний, так и внутренний, и резко увеличить размеры животных во время кембрийского взрыва .
История исследования
Учёные десятилетиями не могли понять молекулярное строение коллагена. Первое доказательство того, что коллаген имеет постоянное строение на молекулярном уровне, было представлено в середине 1930-х годов. С того времени много выдающихся учёных, включая нобелевских лауреатов, таких как Фрэнсис Крик , Лайнус Полинг , Александр Рич , Ада Йонат , Хелен Берман, Вилеайнур Рамачандран , работали над строением мономера коллагена.
Несколько противоречащих друг другу моделей (несмотря на известное строение каждой отдельной пептидной цепи) дали дорогу для создания троично-спиральной модели, объяснившей четвертичное строение молекулы коллагена.
Свойства
Продуктом денатурации коллагена является желатин . Температура денатурации макромолекулы коллагена близка к температуре фибриллогенеза. Это свойство молекулы коллагена делает её максимально чувствительной к мутационным заменам.
Фибриллогенез — образование коллагеновых волокон в соединительной ткани путём сборки или объединения в пучки фибрилл — тонких белковых нитевидных структур внутри клетки и тканей человеческого организма. Фибриллогенез имеет важное значение в процессе приживления имплантата и создания на его основе прочной, правильно функционирующей жевательной системы. Чем прочнее созданные в процессе фибриллогенеза коллагеновые волокна, тем прочнее соединительная ткань.
Структура
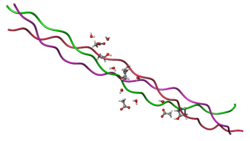
Молекула коллагена представляет собой левозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген . Один виток спирали α-цепи содержит три аминокислотных остатка . Молекулярная масса коллагена около 300 к Да , длина 300 нм , толщина 1,5 нм.
Для первичной структуры белка характерно высокое содержание глицина , низкое содержание серосодержащих аминокислот и отсутствие триптофана . Коллаген относится к тем немногим белкам животного происхождения, которые содержат остатки нестандартных аминокислот : около 21 % от общего числа остатков приходится на 3-гидроксипролин , 4-гидроксипролин и 5-гидроксилизин . Каждая из α-цепей состоит из триад аминокислот. В триадах третья аминокислота всегда глицин, вторая — пролин или лизин , первая — любая другая аминокислота, кроме трёх перечисленных .
Коллаген существует в нескольких формах. Основа строения всех видов коллагена является схожей. Коллагеновые волокна образуются путём агрегации микрофибрилл, имеют розовый цвет при окраске гематоксилином и эозином и голубой или зелёный при различных трёххромных окрасках, при импрегнации серебром окрашиваются в буро-жёлтый цвет.
Фибриллярная структура
Тропоколлагены (структурные единицы коллагена) спонтанно объединяются, прикрепляясь друг к другу смещёнными на определённое расстояние концами, образуя в межклеточном веществе более крупные структуры. В фибриллярных коллагенах молекулы смещены относительно друг друга примерно на 67 нм (единица, которая обозначается буквой «D» и меняется в зависимости от состояния гидратации вещества). В целом каждый D-период содержит четыре целых и часть пятой молекулы коллагена. Величина 300 нм, поделённая на 67 нм (300:67), не даёт целого числа, и длина молекулы коллагена разделена на непостоянные по величине отрезки D. Следовательно, в разрезе каждого повтора D-периода микрофибриллы есть часть, состоящая из пяти молекул, называемая «перекрытие», и часть, состоящая из четырёх молекул — «разрыв». Тропоколлагены к тому же скомпонованы в шестиугольную или псевдошестиугольную (в поперечном разрезе) конструкцию, в каждой области «перекрытия» и «разрыва».
Внутри тропоколлагенов существует ковалентная связь между цепями, а также некоторое непостоянное количество данных связей между самими тропоколлагеновыми спиралями, образующими хорошо организованные структуры (например, фибриллы ). Более толстые пучки фибрилл формируются с помощью белков нескольких других классов, включая другие типы коллагенов, гликопротеины , протеогликаны , использующихся для формирования различных типов тканей из разных комбинаций одних и тех же основных белков. Нерастворимость коллагена была препятствием к изучению мономера коллагена, до того момента как было обнаружено, что возможно извлечь тропоколлаген молодого животного, поскольку он ещё не образовал сильных связей с другими субъединицами фибриллы. Тем не менее, усовершенствование микроскопов и рентгеновских аппаратов облегчили исследования, появлялось всё больше подробных изображений структуры молекулы коллагена. Эти поздние открытия очень важны для лучшего понимания того, как структура коллагена влияет на связи между клетками и межклеточным веществом , как ткани меняются во время роста и регенерации , как они меняются во время эмбрионального развития и при патологии .
Коллагеновая фибрилла — это полукристаллическая структурная единица коллагена. Коллагеновые волокна — это пучки фибрилл.
Использование
Пищевая промышленность
С точки зрения питания, гидролизат коллагена и желатин являются белками низкого качества, так как они не содержат всех незаменимых аминокислот , необходимых человеку — это неполноценные белки. Относительно дешёвые, часто предлагаемые сегодня на рынке под видом источника свободных аминокислот гидролизаты коллагена не всегда способны удовлетворить потребности человека в свободных аминокислотах, так как эти продукты не содержат готовые к усвоению аминокислоты.
Например, гидролизаты коллагена почти полностью лишены аминокислоты L- глютамина , (не является незаменимой аминокислотой) не отличающейся стойкостью к термическому воздействию и долгому хранению сырья, большая часть глютамина разрушается уже на первых этапах хранения и переработки сырья, имеющийся небольшой остаток практически полностью распадается во время термической экстракции хрящевой ткани.
Косметические средства
Коллаген входит в состав косметических средств для:
- Образования воздухопроницаемого, влагоудерживающего слоя на поверхности кожи, обладающего пластифицирующими (разглаживающими) свойствами, со свойствами влажного компресса;
- Продления действия экстрактов, масел и др. в составе косметических композиций;
- Придания блеска волосам, создания коллагенового (защитного) слоя на поверхности волос.
Научные исследования
В 2005 году учёным удалось выделить коллаген из сохранившихся мягких тканей тираннозавра [ нет в источнике ] и использовать его химический состав как ещё одно доказательство родства динозавров с современными птицами .
Научные исследования в медицине
Синтез коллагена — сложный ферментативный многостадийный процесс, который должен быть обеспечен достаточным количеством витаминов и минеральных элементов. Синтез протекает в фибробласте и ряд стадий вне фибробласта . Важный момент в синтезе — реакции гидроксилирования, которые открывают путь дальнейшим модификациям, необходимым для созревания коллагена. Катализируют реакции гидроксилирования специфические ферменты. Так, образование катализирует , в активном центре которой находится железо. Фермент активен в том случае, если железо находится в двухвалентной форме, что обеспечивается аскорбиновой кислотой (витамин C). Дефицит аскорбиновой кислоты нарушает процесс гидроксилирования, что влияет на дальнейшие стадии синтеза коллагена: гликозилирование , отщепление N- и С-концевых пептидов и др. В результате синтезируется аномальный коллаген, более рыхлый. Эти изменения лежат в основе развития цинги . Коллаген и эластин формируют своеобразную «основу» кожи, которая предотвращает её обвисание, обеспечивает её эластичность и упругость. Также важнейшим компонентом соединительной ткани является кератин — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину . В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога, перья и др.
Фотография
Белок является основой для фотографического желатина , которая вместе с микрокристаллами галогенидов серебра образует фотографическую эмульсию . При получении фотографического желатина коллаген денатурируют кислотой или щёлочью . Фотографическая эмульсия, нанесённая тонким слоем на целлулоидную плёнку, стекло или бумагу, а затем высушенная, — это и есть светочувствительный слой фотоматериала (например, фотоплёнки).
Типы коллагена
В настоящее время описано 28 типов коллагена, которые кодируются более чем 40 генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации — интенсивности гидроксилирования или гликозилирования. Общим для всех коллагенов является существование 1 или более доменов , содержащих тройную спираль и присутствие их во внеклеточном матриксе . Более 90 % всего коллагена высших организмов приходится на коллагены I, II,III и IV типов.
| Разновидности коллагена | Типы |
|---|---|
| Фибриллярные коллагены | I, II, III, V, XI, XXIV, XXVII |
| Фибрилл-ассоциированные коллагены (FACIT) | IX, XII, XIV, XVI, XIX, XX, XXI, XXII |
| Коллагены, формирующие филаменты- бусины (beaded filament forming) | VI |
| Сетеобразующие коллагены | IV, VIII, X |
| Коллаген, формирующий якорные фибриллы | VII |
| Трансмембранные коллагены | XIII, XVII, XXIII, XXV/CLAC-P |
| Другие коллагены | XXVIII, XV, XVIII |
Кроме коллагеновых белков существует множество других белков, содержащих в своей структуре домен с тройной коллагеновой спиралью . И, тем не менее, их не причисляют к коллагенам, а только к «коллагеноподобным». К большой группе коллагеноподобных белков относятся подкомпонент C1q-комплемента, C1q-подобный фактор, адипонектин, колектины и фиколины, концевая структура ацетилхолинестаразы, три макрофаговых рецептора, эктодисплазин и EMILIN. Эти белки, так же как и коллагены, играют структурную и регуляторную роль.
Коллаген первого типа, самый архетипичный, является тримерным белком, собирающимся в тройные спирали без разрывов, самособирающимся в фибриллы и обладающим наибольшей механической прочностью. Между тем, все остальные коллагены отличаются от него в одном или нескольких аспектах. Некоторые коллагены имеют разрывы в тройной спирали и не обязательно собираются в фибриллы.
| Тип коллагена | Гены | Молекулы | Органы | Ассоциированные болезни |
|---|---|---|---|---|
| I | COL1A1 COL1A2 | α1(I) 2 α2(I), α1(I) 3 | Повсеместно в мягких и твёрдых тканях, в коже, костях, роговице глаза, в склере, в стенке артерий и др. | Синдром Элерса-Данлоса, остеогенез, ревматизм, синдром Марфана, дисплазии |
| II | COL2A1 | α1(II) 3 + см тип XI | Гиалиновые и фиброзные хрящи, стекловидное тело, роговица | Коллагенопатия II и XI типа, синдром Стиклера, ахондрогенез |
| III | COL3A1 | α1(III) 3 | Дерма кожи плода, стенки крупных кровеносных сосудов, ретикулярные волокна органов кроветворения | Синдром Элерса-Данлоса, фибромышечная дисплазия, аневризма аорты |
| IV | COL4A1 COL4A2 COL4A3 COL4A4 COL4A5 COL4A6 | α1(IV) 2 α2(IV), другие непонятно | Базальные мембраны, капсула хрусталика | Синдром Альпорта, синдроме Гудпасчера |
| V | COL5A1 COL5A2 COL5A3 | α1(V) 2 α2(V), α1(V)α2(V)α3(V) + см тип XI | Мягкие ткани, плацента, сосуды, хорион | Синдром Элерса-Данлоса |
| VI | COL6A1 COL6A2 COL6A3 COL6A4 COL6A5 COL6A6 | α1(VI)α2(VI)α3(VI) | Микрофибриллы в мягких тканях и хрящах | Миопатия Ульриха, миопатия Бэтлема, атопический дерматит |
| VII | COL7A1 | α1(VII) 3 | Якорные фибриллы в связке кожи и эпидермиса | Буллёзный эпидермолиз |
| VIII | COL8A1 COL8A2 | α1(VIII)α2(VIII) | Роговица, эндотелий | Дистрофия роговицы |
| IX | COL9A1 COL9A2 COL9A3 | α1(IX)α2(IX)α3(IX) | Хрящи, стекловидное тело | Синдром Стиклера, остеоартрит, эпифизарная дисплазия |
| X | COL10A1 | α1(X) 3 | Гипертрофическая зона области роста | Метафизарная дисплазия Шмида |
| XI | COL11A1 COL11A2 | α1(XI)α2(XI)α1(II), α1(XI)α2(V)α1(II) | Хрящи, стекловидное тело | Коллагенопатия II и XI типов, остеопороз |
| XII | COL12A1 | α1(XII) 3 | Мягкие ткани | Повреждения сухожилий |
| XIII | COL13A1 | α1(XIII) 3 | Поверхность клеток, эпителиальные клетки | |
| XIV | COL14A1 | α1(IV) 3 | Мягкие ткани | |
| XV | COL15A1 | α1(XV) 3 | Эндотелиальные клетки | Карцинома |
| XVI | COL16A1 | α1(XVI) 3 | Повсеместно | |
| XVII | COL17A1 | α1(XVII) 3 | Поверхность эпидермальных клеток | Буллёзный эпидермиолиз, пузырчатка |
| XVIII | COL18A1 | α1(XVIII) 3 | Эндотелиальные клетки | |
| XIX | COL19A1 | α1(XIX) 3 | Повсеместно | Меланома, карцинома |
| XX | COL20A1 | α1(XX) 3 | Выделен из куриного эмбриона | |
| XXI | COL21A1 | α1(XXI) 3 | Кровеносные сосуды | |
| XXII | COL22A1 | α1(XXII) 3 | Только в местах мышечно-сухожильных соединений | |
| XXIII | COL23A1 | α1(XXIII) 3 | Опухолевые клетки | |
| XXIV | COL24A1 | α1(XXIV) 3 | Формирующиеся кости | Остеохондроз |
| XXV | COL25A1 | α1(XXV) 3 | Атеросклеротические бляшки | Болезнь Альцгеймера |
| XXVI | COL26A1=EMID2 | α1(XXVI) 3 | Половые органы | |
| XXVII | COL27A1 | α1(XXVII) 3 | Мягкие ткани | |
| XXVIII | COL28A1 | α1(XXVIII) 3 | Нервная система |
Медицинские аспекты
Нарушения синтеза коллагена в организме лежат в основе таких наследственных заболеваний , как у животных, латиризм (характерна разболтанность суставов , привычные вывихи ), синдром Элерса-Данлоса (до 14 типов проявлений), несовершенный остеогенез (болезнь «стеклянного человека», врождённый рахит , врождённая ломкость костей ), болезнь Марфана , муковисцидоз .
Характерным проявлением этих заболеваний является повреждение , хрящей , костной системы , наличие .
Болезни, вызванные дефектами при биосинтезе коллагена, в том числе так называемые коллагенозы, возникают из-за множества причин. Это может быть из-за мутации в гене, кодирующем аминокислотную последовательность ферментов, продуцирующих коллаген, приводящей к изменению формы коллагеновой молекулы, или ошибки в посттрансляционной модификации коллагена. Также болезни могут быть вызваны недостатком или «неправильной работой» ферментов, вовлечённых в биосинтез коллагена — дефицит ферментов гидроксилирования ( -, ), гликозилтрансфераз , N-проколлагеновой и С-проколлагеновой пептидаз , с последующим нарушением поперечных сшивок, дефицит меди, витаминов B 6 , B 13 ( оротовая кислота ), C . При приобретённых болезнях, таких как цинга, восстановление баланса ферментов до нормального может привести к полному излечению.
Практически любая генная мутация ведёт к утрате или изменению функций коллагена, что, в свою очередь, отражается на свойствах тканей и органов. Генные мутации в коллагеновом домене могут привести к изменению формы тройной спирали путём вставки/выпадения аминокислоты из полипептидной цепочки или замены Gly на другое основание. Мутации в неколлагеновых доменах могут привести к неправильной пространственной сборке α-цепей в надмолекулярные структуры (фибриллы или сети), что также ведёт к утрате функций. Мутантные α-цепи способны образовывать трёхспиральный комплекс с нормальными α-цепями. В большинстве случаев, такие комплексы нестабильны и быстро разрушаются, однако, такая молекула может и нормально выполнять свою роль, если не затронуты функционально важные области. Большинство болезней, вызванных мутациями в «коллагеновых» генах, являются доминантными .
Примечания
- Fibrillar collagen: the key to vertebrate evolution? A tale of molecular incest. Boot-Handford RP, Tuckwell DS. Bioessays. 2003 Feb;25(2):142-51.
- Di Lullo, Gloria A.; Sweeney, Shawn M.; Körkkö, Jarmo; Ala-Kokko, Leena; San Antonio, James D. Mapping the Ligand-binding Sites and Disease-associated Mutations on the Most Abundant Protein in the Human, Type I Collagen (англ.) // J. Biol. Chem. : journal. — 2002. — Vol. 277 , no. 6 . — P. 4223—4231 . — doi : . — .
- ↑ Тропоколлаген (Tropocollagen) // Медицинские термины . — 2000. в словаре dic.academic.ru
- Химическая энциклопедия / под ред. И. Л. Кнунянца. — М. : Советская энциклопедия, 1988.
- от 18 января 2008 на Wayback Machine — 25 марта 2005 г.
- от 18 мая 2008 на Wayback Machine . — 20.04.07
- Franzke CW, Bruckner P, Bruckner-Tuderman L. Collagenous transmembrane proteins: recent insights into biology and pathology. J Biol Chem. 2005 Feb 11;280(6):4005-8.
- Hoppe HJ, Reid KB. Collectins--soluble proteins containing collagenous regions and lectin domains--and their roles in innate immunity. Protein Sci. 1994 Aug;3(8):1143-58
Литература
- Коллаген // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров . — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- 2021-07-28
- 2
