Interested Article - Лиганд-зависимые ионные каналы

- 2020-12-31
- 1
Лиганд-зависимые ионные каналы , лиганд-управляемые или лиганд-активируемые ионные каналы — также обычно называемые ионотропными рецепторами , представляют собой группу трансмембранных белков ионных каналов , которые позволяют ионам , например, Na + , K + , Ca 2+ и/или Cl - , проходить через биологическую мембрану , посредством изменения конформации (открытия) в ответ на связывание химического мессенджера (то есть лиганда ), такого как, например, молекулы нейромедиатора .
Ионные каналы с цистеиновой петлёй
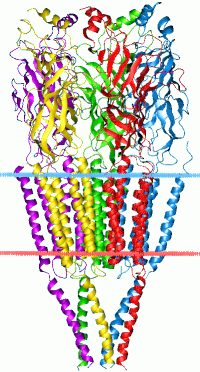
Цис-петлевые рецепторы названы в честь характерного цикла, который образован дисульфидной связью между двумя остатками молекул цистеина в N-концевом внеклеточном домене. Они являются частью большого семейства пентамерных лиганд-ионных каналов, которые обычно не имеют данной дисульфидной связи, поэтому их условное название «рецепторы Pro-loop» .
Структура
Цис-петлевые рецепторы имеют структурные элементы, которые высококонсервативны, причём большой внешнеклеточный домен (ECD) содержит альфу-спираль и 10 бета-тяжей. Следующие за ECD четыре трансмембранных сегмента (TMS) связаны внутриклеточными и внешнеклеточными структурами петли . За исключением петли TMS 3-4, их длина составляет всего 7-14 остатков. Петля TMS 3-4 образует наибольшую часть внутриклеточного домена (ICD), при этом она является наиболее вариабельной (изменчивой) областью между всеми этими гомологичными рецепторами. ICD определяется петлёй TMS 3-4 вместе с петлей TMS 1-2, предшествующей поре ионного канала . Кристаллизация рецепторов выявила структуры для некоторых членов семейства, но для обеспечения возможности кристаллизации внутриклеточную петлю обычно заменяли коротким линкером, присутствующим в прокариотических цис-петлевых рецепторах, поэтому их структуры не известны. Тем не менее, эта внутриклеточная петля, по-видимому, функционирует при десенсибилизации, модуляции физиологии канала лекарственными веществами и посттрансляционных модификациях . В нём присутствуют мотивы важные для движения, и ICD взаимодействует с белками каркаса, обеспечивая ингибирующее образование синапсов .
Прототипный лиганд-зависимый ионный канал представляет собой никотиновый ацетилхолиновый рецептор . Он состоит из пентамерных белковых субъединиц (обычно ααβγδ), включая два сайта связывания ацетилхолина (по одному на границе раздела каждой альфа-субъединицы). В нормальных физиологических условиях рецептору нужно ровно две молекулы ацетилхолина, чтобы открыть канал . Открытие канала позволяет положительно заряженным ионам перемещаться по нему; в частности, ионы натрия (Na + ) входят во внутрь клетки, а ионы калия выходят (К + ).
Глициновые рецепторы
Глициновый рецептор (сокращенно GlyR или GLR) является рецептором аминокислоты-нейромедиатора — глицина . GlyR является цис-петлевым ионотропным рецептором, который оказывает своё действие посредством потока ионов хлора (Cl - ). Он является одним из наиболее широко распространённых ингибиторных (тормозных) рецепторов в центральной нервной системе и играет важную роль в различных физиологических процессах, особенно в обеспечении торможения нейротрансмиссии в спинном мозге и стволе мозга .
Рецептор может активироваться рядом простых аминокислот, включая глицин, и таурин , и может избирательно блокироваться конкурентным антагонистом с высоким сродством — стрихнином . Кофеин является конкурентным антагонистом GlyR .
Рецепторы этого семейства расположены в виде пяти субъединиц (пентамеров), окружающих центральную пору, причём каждая субъединица состоит из четырёх α-спиральных трансмембранных сегментов . В настоящее время известно четыре изоформы α-субъединицы (α1-4) GlyR, которые необходимы для связывания лигандов (GLRA1, GLRA2, GLRA3, GLRA4) и одной β-субъединицы (GLRB).
Типы катионных цис-петлевых рецепторов
| Тип | Класс | Название белков согласно рекомендации ИЮФАР | Ген | Предыдущие названия |
|---|---|---|---|---|
|
Серотониновые рецепторы
(5-HT) |
5-HT 3 |
|
|
5-HT
3A
5-HT 3B 5-HT 3C 5-HT 3D 5-HT 3E |
|
Никотиновый ацетилхолиновый рецептор
(nAChR) |
альфа |
|
|
ACHRA, ACHRD, CHRNA, CMS2A, FCCMS, SCCMS
|
| бета |
|
|
CMS2A, SCCMS, ACHRB, CHRNB, CMS1D
EFNL3, nAChRB2 |
|
| гамма | ACHRG | |||
| дельта | ACHRD, CMS2A, FCCMS, SCCMS | |||
| эпсилон | ACHRE, CMS1D, CMS1E, CMS2A, FCCMS, SCCMS | |||
|
Цинк-активируемые ионные каналы
(ZAC) |
ZAC | ZAC1, L2m LICZ, LICZ1 |
Типы анионных цис-петлевых рецепторов
| Тип | Класс | Название белков согласно рекомендации ИЮФАР | Ген | Предыдущие названия |
|---|---|---|---|---|
| ГАМК A | альфа |
|
|
EJM, ECA4
|
| бета |
β2 |
|
ECA5 |
|
| гамма |
|
|
CAE2, ECA2, GEFSP3 | |
| дельта | ||||
| эпсилон | ||||
| пи | ||||
| тета | ||||
| ро |
|
|
ГАМК C | |
|
Глициновый рецептор
(GlyR) |
альфа |
|
|
STHE
|
| бета |
Глутаматные ионотропные рецепторы
Ионотропные глутаматные рецепторы связывают молекулы нейромедиатора — глутамат . Они образуют тетрамеры с каждой субъединицей, состоящей из внешнеклеточного амино-концевого домена (ATD, в котором происходит тетрамерная сборка), внешнеклеточный лиганд-связывающий домен (LBD, который связывает глутамат) и трансмембранный домен (TMD, который образует ионный канал). Трансмембранный домен каждой субъединицы содержит три трансмембранные спирали, а также полумембранную спираль с реентерабельной петлёй. Структура белка начинается с ATD на N-конце, за которым следует первая половина LBD, которая прерывается спиралями 1,2 и 3 TMD перед продолжением второй половины LBD, а затем заканчивается спиралью 4 TMD на C-конце . Это означает, что между TMD и внеклеточными доменами существует три связи. Каждая субъединица тетрамера имеет сайт связывания для глутамата, образованного двумя секциями LBD, образующими форму с раскладушкой. Только два из этих сайтов в тетрамере должны быть заняты, чтобы открыть ионный канал. Пора в основном образована половинной спиралью 2, которая по структуре напоминает перевернутый калиевый канал .
| Тип | Класс | Название белков согласно рекомендации ИЮФАР | Ген | Предыдущее название |
|---|---|---|---|---|
| AMPA-рецептор | GluA |
|
|
GLU
A1
, GluR1, GluRA, GluR-A, GluR-K1, HBGR1
GLU A2 , GluR2, GluRB, GluR-B, GluR-K2, HBGR2 GLU A3 , GluR3, GluRC, GluR-C, GluR-K3 GLU A4 , GluR4, GluRD, GluR-D |
| Каинатный рецептор | GluK |
GluK4 |
|
GLU
K5
, GluR5, GluR-5, EAA3
GLU K6 , GluR6, GluR-6, EAA4 GLU K7 , GluR7, GluR-7, EAA5 GLU K1 , KA1, KA-1, EAA1 GLU K2 , KA2, KA-2, EAA2 |
| NMDA-рецептор | GluN |
|
|
GLU
N1
, NMDA-R1, NR1, GluRξ1
|
|
GluN2B |
|
GLU
N2A
, NMDA-R2A, NR2A, GluRε1
GLU N2B , NMDA-R2B, NR2B, hNR3, GluRε2 GLU N2C , NMDA-R2C, NR2C, GluRε3 GLU N2D , NMDA-R2D, NR2D, GluRε4 |
||
|
|
|
GLU
N3A
, NMDA-R3A, NMDAR-L, chi-1
GLU 3B , NMDA-R3B |
||
| ‘Орфанный’ (рецептор-сирота) | (GluD) |
|
|
GluRδ1
GluRδ2 |
АМРА-рецептор

Рецептор α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (также известный как рецептор AMPA или рецептор квисквалята) представляет собой ионотропный трансмембранный рецептор глутамата не-NMDA-типа, который опосредует быструю синаптическую передачу в центральной нервной системе (ЦНС). AMPA-рецепторы обнаружены во многих частях мозга и являются наиболее часто встречаемым рецепторами в нервной системе. Тетрамер AMPA-рецептора GluA2 (GluR-2) был первым из ионных каналов глутаматного рецептора, который удалось кристаллизовать .
Лиганды
- Агонисты: глутамат, AMPA, 5-фторвиллардин, домоевая кислота , квискваловая кислота и др.
- Антагонисты: CNQX, Кинуреновая кислота , NBQX, перампанель, пирацетам и др.
- Положительные аллостерические модуляторы: анирацетам , циклотиазид, CX-516, CX-614 и др.
- Отрицательные аллостерические модуляторы: этанол , перампанель, талампанель, GYKI-52,466 и др.
Рецепторы NMDA

1. Клеточная мембрана
2. Канал, который блокируется магнием Mg 2+ (3)
3. Участок блокировки Mg 2+
4. Участок связывания галлюциногенов
5. Участок связывания цинка Zn 2+
6. Участок связывания агонистов ( глутамат ) и антагонистов (APV)
7. Участки гликозилирования
8. Участки связывания протонов
9. Участки связывания глицина
10. Участок связывания полиаминов
11. Внеклеточное пространство
12. Внутриклеточное пространство
13. Комплексная (сложная) субъединица
N-метил-D-аспартатный рецептор ( NMDA-рецептор ) — один из типов ионотропного глутаматного рецептора, является потенциал-зависимым лиганд-ионным каналом, который активируется одновременным связыванием глутамата и коагониста (им являются молекулы D- серина или глицина ) . Исследования показывают, что NMDA-рецептор участвует в регулировании синаптической пластичности и памяти .
Когда NMDA-рецептор активируется одновременным связыванием двух коагонистов, открывается катионный канал, позволяя ионам Na + и Ca 2+ проникать в клетку, в свою очередь происходит повышение трансмембранного потенциала клетки. Таким образом, NMDA-рецептор является возбуждающим рецептором. При потенциалах покоя связывание двухвалентных ионов Mg 2+ или Zn 2+ происходит на внеклеточных сайтах связывания рецептора, это приводит к блокированию потока ионов, который протекает через ионный канал NMDA-рецептора. Однако, когда нейроны деполяризуются, например, путём интенсивной активации колокализованных постсинаптических AMPA-рецепторов, потенциал-зависимый блок Mg 2+ частично ослабляется, что позволяет увеличить приток ионов через активированные NMDA-рецепторы. Результирующий приток ионов Ca 2+ может запускать различные внутриклеточные сигнальные каскады, которые могут в конечном итоге изменить функции нейронов посредством активации различных киназ и фосфатаз .
Лиганды
- Первичные эндогенные коагонисты: глутамат и D-серин или глицин
- Другие агонисты: аминоциклопропанкарбоновая кислота; Д-циклосерин; L-аспартат; хинолинат и др.
- Частичные агонисты: N-метил-D-аспарагиновая кислота (NMDA); NRX-1074; 3,5-дибром-L-фенилаланин, и др .
- Антагонисты: кетамин , фенциклидин , декстропропоксифен, кетобемидон , трамадол , кинуреновая кислота (эндогенная) и др.
Каинатные рецепторы
Каинатные рецепторы , или рецепторы каиновой кислоты (KAR), представляют собой ионотропные рецепторы, которые могут активироваться под действием молекул нейромедиатора глутамата. Изначально они были идентифицированы как особый тип рецептора посредством их селективной активации агонистом каината , лекарственного средства, выделенного из клеток красной водоросли Digenea simplex . Они традиционно классифицируются как рецептор не-NMDA-типа, наряду с рецептором AMPA. KAR недостаточно изучены, вследствие меньшего распространения в головном мозге, чем AMPA и NMDA-рецепторы, или другие ионотропные глутаматные рецепторы. Постсинаптические каинатные рецепторы участвуют в возбуждающей нейротрансмиссии . Пресинаптические каинатные рецепторы участвуют в ингибирующей нейротрансмиссии путём модулирования высвобождения тормозного нейромедиатора ГАМК посредством пресинаптического механизма (пресинаптическое торможение).
Каинатный рецептор состоит из четырёх субъединиц, сходных с субъединицами AMPA- и NMDA-рецепторов. Всего известно 5 типов этих субъединиц: GluR5, GluR6, GluR7, KA1 и KA2 .
Ионный канал, образованный каинатными рецепторами, проницаем для ионов натрия и калия. Проводимость каналов каинатного рецептора по одному каналу аналогична проводимости каналов AMPA, около 20 пикосименс (2*10 -11 См). Тем не менее, нарастание и спад постсинаптических потенциалов порожденных каинатным рецептором происходит медленнее, чем для АМРА-рецептора. Проницаемость для кальция обычно очень небольшая, но варьируеться в зависимости от особенностей сегмента М2 .
Лиганды
Агонисты:
- 5-Йодовилардин
- Домоевая кислота
- Глутаминовая кислота (глутамат) — эндогенный агонист
- Каиновая кислота — синтетический агонист, в честь которого назван рецептор
- LY-339434
- SYM-2081
Антагонисты:
- CNQX
- DNQX
- Этанол — неселективный
- NS102
- Кинуреновая кислота — эндогенный лиганд
- — также антагонист AMPA-рецептора
- UBP-302
- Теанин
Рецепторы ГАМК
ГАМК-рецепторы — группа клеточных рецепторов, эндогенным агонистом которых является γ-аминомасляная кислота (ГАМК), основной тормозной нейромедиатор в нервной системе позвоночных, экспрессируются в интернейронах коры головного мозга животных и человека. Существует 3 типа ГАМК-рецепторов, два из которых являются ионотропными — ГАМК А и ГАМК С , а один метаботропный — ГАМК B . Быстро реагирующие ГАМК-рецепторы являются членами семейства лиганд-управляемых ионных каналов с цистеиновой петлёй .
ГАМК А -рецептор
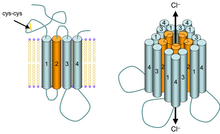
ГАМК А -рецепторы представляют собой лиганд-управляемые анионные каналы. ГАМК (гамма-аминомасляная кислота), эндогенный лиганд для данного типа рецепторов, является основным ингибирующим нейромедиатором в центральной нервной системе. При активации он опосредует поступление ионов хлора Cl – в нейрон , при этом происходит гиперполяризация мембраны клетки. ГАМК А -рецепторы встречаются во всех организмах, имеющих нервную систему. Благодаря их широкому распространению в нервной системе млекопитающих, они играют роль практически во всех функциях, выполняемых головным мозгом .
Различные лиганды могут специфически связываться с ГАМК А -рецепторами, активируя или ингибируя хлоридный канал Cl – .
Лиганды:
- Агонисты: ГАМК , мускимол, прогабид , габоксадол
- Антагонисты: бикукулин, габазин
- Частичный агонист: пиперидин-4-сульфокислота.
ГАМК C -рецептор
Рецептор ГАМК A -ро (ранее известный как рецептор ГАМК C ) представляет собой подкласс ГАМК А -рецепторов, состоящий полностью из субъединиц ро (ρ). Рецептор ГАМК A -ро, как и другие рецепторы ГАМК A , экспрессируется во многих областях мозга, но, в отличие от других рецепторов ГАМК А , данный рецептор обладает особенно высокой экспрессией в сетчатке глаза .
Серотониновые рецепторы
Среди большого числа суперсемейств серотониновых рецепторов только одно принадлежит к суперсемейству цис-петлевых лиганд-зависимых ионных каналов —
5-HT
3
и поэтому структурно и функционально отличается от всех других рецепторов 5-HT-рецепторов (5-гидрокситриптамина или серотонина), которые являются рецепторами, сопряжённые с G-белком (
GPCR
)
. 5-HT
3
представляет собой селективный катионный канал, он обеспечивает деполяризацию и возбуждение нейронов в центральной и периферической нервной системе
. Как и в случае других лиганд-управляемых ионных каналов, рецептор 5-HT
3
состоит из пяти субъединиц, расположенных вокруг центральной ионопроводящей поры, которая проницаема для ионов натрия (Na
+
), калия (K
+
) и кальция (Ca
2+
). Связывание
нейромедиатора
5-гидрокситриптамина
(серотонина) с рецептором 5-HT
3
открывает канал, что, в свою очередь, приводит к возбуждающему ответу в нейронах (
потенциалу действия
). 5-HT
3
-рецепторы имеют незначительную проницаемость для
анионов
. По структуре они наиболее гомологичны с никотиновыми рецепторами ацетилхолина.
Проявляемые эффекты
При активации рецептора агонистами происходит открытие катионного канала, что приводит к следующим эффектам:
- В ЦНС : возбуждение центра тошноты и рвоты в стволе головного мозга, тревожность , склонность к судорогам , преноцицепция .
- В ПНС : возбуждение нейронов (происходит в вегетативных, ноцицептивных нейронах), рвота .
АТФ-зависимые ионные каналы

АТФ-зависимые ионные каналы открываются в ответ на связывание молекул нуклеотида АТФ . Они образованы из тримеров с двумя трансмембранными спиралями на субъединицу и обоих терминалей (С и N-концов), расположенных на внутриклеточной стороне. К такому типу ионотропных рецепторов относится семейство P2X-пуринорецепторов. P2X-рецепторы присутствуют в разнообразных организмах, включая человека, позвоночных (млекопитающие, птицы, земноводные, рыбы итд.), беспозвоночных (трематоды) и простейших (амёбы) .
| Тип | Класс | Название белков согласно рекомендации ИЮФАР | Ген | Предыдущее название |
|---|---|---|---|---|
| P2X-рецептор | N/A |
|
|
P2X
1
P2X 2 P2X 3 P2X 4 P2X 5 P2X 6 P2X 7 |
PIP 2 -лиганд зависимые ионные каналы
Фосфатидилинозитол-4,5-бисфосфат (PIP 2 ) связывается и непосредственно активирует калиевые каналы внутреннего выпрямления (K ir или IRK) . PIP 2 является липидом клеточной мембраны , и его роль в качестве лиганда ионных каналов представляет новую роль для данной молекулы . Калиевые каналы внутреннего выпрямления обнаружены также у растений и бактерий .
Клиническое значение
Лиганд-управляемые ионные каналы, вероятно, являются основным местом действия анестетиков и этанола , хотя однозначные доказательства, данного воздействия ещё предстоит установить . В частности, анестетики воздействуют на ГАМК- и NMDA-рецепторы в концентрациях, аналогичных тем, которые используются в клинической анестезии .
Мемантин одобрен USFDA и Европейским агентством лекарственных средств для лечения болезни Альцгеймера средней и тяжёлой степени , и в настоящее время получил ограниченную рекомендацию Национального института здравоохранения и медицинского обслуживания Великобритании для пациентов, не прошедших другие варианты лечения .
- Лечение антидепрессантами
Агомелатин , является типом лекарственного средства, действующего по двойному мелатонергическому-серотонинергическому пути, он показал свою эффективность в лечении тревожной депрессии во время клинических испытаний , исследование также предполагает эффективность в лечении атипичных и меланхоличных типов депрессии .
Примечания
- . HUGO Gene Nomenclature Committee. Дата обращения: 2 апреля 2018. 14 ноября 2017 года.
- " " at
- Purves, Dale, George J. Augustine, David Fitzpatrick, William C. Hall, Anthony-Samuel LaMantia, James O. McNamara, and Leonard E. White. (неопр.) . — , 2008. — С. —157. — ISBN 978-0-87893-697-7 .
- Tasneem A., Iyer L., Jakobsson E., Aravind L. Identification of the prokaryotic ligand-gated ion channels and their implications for the mechanisms and origins of animal Cys-loop ion channels (англ.) // : journal. — 2004. — Vol. 6 , no. 1 . — P. R4 . — doi : . — . — PMC .
- Jaiteh M., Taly A., Hénin J. Evolution of Pentameric Ligand-Gated Ion Channels: Pro-Loop Receptors (англ.) // PLOS ONE : journal. — 2016. — Vol. 11 , no. 3 . — P. e0151934 . — doi : . — . — PMC .
- ↑ Langlhofer, Georg; Villmann, Carmen. The Intracellular Loop of the Glycine Receptor: It's not all about the Size (англ.) // Frontiers in Molecular Neuroscience : journal. — 2016. — 1 January ( vol. 9 ). — P. 41 . — ISSN . — doi : . — . — PMC .
- J., Aidley, David. The physiology of excitable cells (неопр.) . — 4th. — Cambridge, UK: Cambridge University Press , 1998. — ISBN 978-0521574150 .
- Lynch J. W. Molecular structure and function of the glycine receptor chloride channel (англ.) // : journal. — 2004. — October ( vol. 84 , no. 4 ). — P. 1051—1095 . — doi : . — .
- Rajendra, Sundran; Lynch, Joseph W.; Schofield, Peter R. (англ.) // Pharmacology & Therapeutics : journal. — 1997. — Vol. 73 , no. 2 . — P. 121—146 . — doi : .
- Duan L., Yang J., Slaughter M. M. Caffeine inhibition of ionotropic glycine receptors (англ.) // : journal. — 2009. — August ( vol. 587 , no. Pt 16 ). — P. 4063—4075 . — doi : . — . — PMC .
- Miyazawa A., Fujiyoshi Y., Unwin N. Structure and gating mechanism of the acetylcholine receptor pore (англ.) // Nature : journal. — 2003. — June ( vol. 423 , no. 6943 ). — P. 949—955 . — doi : . — .
- ↑ Collingridge G. L., Olsen R. W., Peters J., Spedding M. A nomenclature for ligand-gated ion channels (неопр.) // Neuropharmacology. — 2009. — January ( т. 56 , № 1 ). — С. 2—5 . — doi : . — . — PMC .
- Olsen R. W., Sieghart W. International Union of Pharmacology. LXX. Subtypes of gamma-aminobutyric acid(A) receptors: classification on the basis of subunit composition, pharmacology, and function. Update (англ.) // : journal. — 2008. — September ( vol. 60 , no. 3 ). — P. 243—260 . — doi : . — . — PMC .
- Traynelis S. F., Wollmuth L. P., McBain C. J., Menniti F. S., Vance K. M., Ogden K. K., Hansen K. B., Yuan H., Myers S. J., Dingledine R. Glutamate receptor ion channels: structure, regulation, and function (англ.) // : journal. — 2010. — September ( vol. 62 , no. 3 ). — P. 405—496 . — doi : . — . — PMC .
- Sobolevsky AI; Rosconi M. P., and Gouaux E. X-ray structure, symmetry and mechanism of an AMPA-subtype glutamate receptor (англ.) // Nature : journal. — 2009. — Vol. 462 . — P. 745—756 . — doi : .
- Malenka R. C., Nestler E. J., Hyman S. E. Chapter 5: Excitatory and Inhibitory Amino Acids // Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (англ.) / Sydor A., Brown R. Y.. — 2nd. — New York, USA: McGraw-Hill Medical, 2009. — P. 124—125. — ISBN 9780071481274 . . — «At membrane potentials more negative than approximately −50 mV, the Mg 2+ in the extracellular fluid of the brain virtually abolishes ion flux through NMDA receptor channels, even in the presence of glutamate. ... The NMDA receptor is unique among all neurotransmitter receptors in that its activation requires the simultaneous binding of two different agonists. In addition to the binding of glutamate at the conventional agonist-binding site, the binding of glycine appears to be required for receptor activation. Because neither of these agonists alone can open this ion channel, glutamate and glycine are referred to as coagonists of the NMDA receptor. The physiologic significance of the glycine binding site is unclear because the normal extracellular concentration of glycine is believed to be saturating. However, recent evidence suggests that D-serine may be the endogenous agonist for this site.».
- Li F., Tsien J. Z. Memory and the NMDA receptors (англ.) // The New England Journal of Medicine : journal. — 2009. — July ( vol. 361 , no. 3 ). — P. 302—303 . — doi : . — . — PMC .
- Cao X., Cui Z., Feng R., Tang Y. P., Qin Z., Mei B., Tsien J. Z. Maintenance of superior learning and memory function in NR2B transgenic mice during ageing (англ.) // : journal. — 2007. — March ( vol. 25 , no. 6 ). — P. 1815—1822 . — doi : . — .
- Dingledine R., Borges K., Bowie D., Traynelis S. F. The glutamate receptor ion channels (англ.) // : journal. — 1999. — March ( vol. 51 , no. 1 ). — P. 7—61 . — .
- Yarotskyy V., Glushakov A. V., Sumners C., Gravenstein N., Dennis D. M., Seubert C. N., Martynyuk A. E. Differential modulation of glutamatergic transmission by 3,5-dibromo-L-phenylalanine (англ.) // : journal. — 2005. — May ( vol. 67 , no. 5 ). — P. 1648—1654 . — doi : . — .
- Dingledine R., Borges K., Bowie D., Traynelis S. F. (англ.) // : journal. — 1999. — Vol. 51 , no. 1 . — P. 7—61 . — . 13 февраля 2009 года.
- Huettner J. E. Kainate receptors and synaptic transmission (англ.) // Prog. Neurobiol. : journal. — 2003. — Vol. 70 , no. 5 . — P. 387—407 . — doi : . — .
- Barnard E. A., Skolnick P., Olsen R. W., Mohler H., Sieghart W., Biggio G., Braestrup C., Bateson A. N., Langer S. Z. (англ.) // : journal. — 1998. — June ( vol. 50 , no. 2 ). — P. 291—313 . — . 6 августа 2009 года.
- Hevers W., Lüddens H. The diversity of GABAA receptors. Pharmapoo and electrophysiological properties of GABAA channel subtypes (англ.) // : journal. — 1998. — August ( vol. 18 , no. 1 ). — P. 35—86 . — doi : . — .
- Sieghart W., Sperk G. Subunit composition, distribution and function of GABA(A) receptor subtypes (англ.) // : journal. — 2002. — August ( vol. 2 , no. 8 ). — P. 795—816 . — doi : . — .
- Wu C., Sun D. GABA receptors in brain development, function, and injury (англ.) // : journal. — 2015. — April ( vol. 30 , no. 2 ). — P. 367—379 . — doi : . — . — PMC .
- Qian H. 2000. от 31 декабря 2010 на Wayback Machine . Retrieved on February 14, 2007.
- ↑ Barnes N. M., Hales T. G., Lummis S. C., Peters J. A. The 5-HT3 receptor--the relationship between structure and function (англ.) // Neuropharmacology : journal. — 2009. — January ( vol. 56 , no. 1 ). — P. 273—284 . — doi : . — . — PMC .
- Thompson A. J., Lummis S. C. 5-HT3 Receptors (англ.) // : journal. — 2006. — Vol. 12 , no. 28 . — P. 3615—3630 . — doi : . — . — PMC .
- Reeves D. C., Lummis S. C. The molecular basis of the structure and function of the 5-HT3 receptor: a model ligand-gated ion channel (review) (англ.) // : journal. — 2002. — Vol. 19 , no. 1 . — P. 11—26 . — doi : . — .
- ↑ Rang, H. P. (неопр.) . — Edinburgh: , 2003. — ISBN 0-443-07145-4 . , page 187.
- Gholipour T., Ghasemi M., Riazi K., Ghaffarpour M., Dehpour A. R. Seizure susceptibility alteration through 5-HT(3) receptor: modulation by nitric oxide (англ.) // Seizure : journal. — 2010. — January ( vol. 19 , no. 1 ). — P. 17—22 . — doi : . — .
- Patel, Ryan; Dickenson, Anthony H. Modality selective roles of pro-nociceptive spinal 5-HT2A and 5-HT3 receptors in normal and neuropathic states (англ.) // Neuropharmacology : journal. — 2018. — September ( vol. 143 ). — P. 29—37 . — ISSN . — doi : . — . — PMC .
- Suzuki, Rie; Rahman, Wahida; Rygh, Lars J; Webber, Mark; Hunt, Stephen P; Dickenson, Anthony H. (англ.) // Pain : journal. — 2005. — October ( vol. 117 , no. 3 ). — P. 292—303 . — ISSN . — doi : . — .
- Сергей Козловский от 7 октября 2021 на Wayback Machine // Наука и жизнь , 2021, № 10. — с. 20-30
- North R. A. Molecular physiology of P2X receptors (англ.) // : journal. — 2002. — Vol. 82 , no. 4 . — P. 1013—1067 . — doi : . — .
- Hansen S. B., Tao X., MacKinnon R. Structural basis of PIP2 activation of the classical inward rectifier K+ channel Kir2.2 (англ.) // Nature : journal. — 2011. — August ( vol. 477 , no. 7365 ). — P. 495—498 . — doi : . — . — . — PMC .
- Hansen S. B. Lipid agonism: The PIP2 paradigm of ligand-gated ion channels (англ.) // : journal. — 2015. — May ( vol. 1851 , no. 5 ). — P. 620—628 . — doi : . — . — PMC .
- Gao Y., Cao E., Julius D., Cheng Y. TRPV1 structures in nanodiscs reveal mechanisms of ligand and lipid action (англ.) // Nature : journal. — 2016. — June ( vol. 534 , no. 7607 ). — P. 347—351 . — doi : . — . — . — PMC .
- Hedrich R. et al. (англ.) // European Biophysics Journal. — 1995-10-01. — Vol. 24 , no. 2 . — P. 107—115 . — ISSN . — doi : . — . 18 июня 2018 года.
- Choi S. B. et al. (англ.) // Journal of Microbiology (Seoul, Korea). — 2010. — 1 June ( vol. 48 , iss. 3 ). — P. 325—330 . — ISSN . — doi : . 1 сентября 2019 года.
- Krasowski M. D., Harrison N. L. General anaesthetic actions on ligand-gated ion channels (англ.) // Cellular and Molecular Life Sciences : journal. — 1999. — August ( vol. 55 , no. 10 ). — P. 1278—1303 . — doi : . — . — PMC .
- Dilger J. P. The effects of general anaesthetics on ligand-gated ion channels (англ.) // : journal. — 2002. — July ( vol. 89 , no. 1 ). — P. 41—51 . — doi : . — .
- Harris R. A., Mihic S. J., Dildy-Mayfield J. E., Machu T. K. (англ.) // : journal. — , 1995. — November ( vol. 9 , no. 14 ). — P. 1454—1462 . — . 6 июля 2008 года.
- Mount C., Downton C. Alzheimer disease: progress or profit? (англ.) // Nature Medicine : journal. — 2006. — July ( vol. 12 , no. 7 ). — P. 780—784 . — doi : . — .
- NICE technology appraisal January 18, 2011 от 17 декабря 2013 на Wayback Machine
- Heun, R; Coral, RM; Ahokas, A; Nicolini, H; Teixeira, JM; Dehelean, P. 1643 – Efficacy of agomelatine in more anxious elderly depressed patients. A randomized, double-blind study vs placebo (англ.) // : journal. — 2013. — Vol. 28 , no. Suppl 1 . — P. 1 . — doi : .
- Brunton, L; Chabner, B; Knollman, B (2010). Goodman and Gilman's The Pharmacological Basis of Therapeutics (12th ed.). New York: McGraw-Hill Professional. ISBN 978-0-07-162442-8 .
- Avedisova, A; Marachev, M. 2639 – The effectiveness of agomelatine (valdoxan) in the treatment of atypical depression (англ.) // : journal. — 2013. — Vol. 28 , no. Suppl 1 . — P. 1 . — doi : .
Внешние ссылки
- at . Verified availability April 11, 2007.
- . IUPHAR Database of Receptors and Ion Channels . International Union of Basic and Clinical Pharmacology.
- 2020-12-31
- 1
