Регуляторные пептиды
- 1 year ago
- 0
- 0
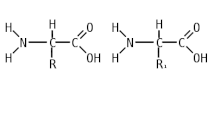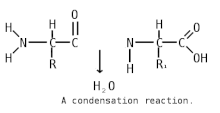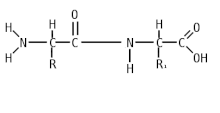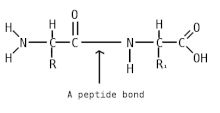


Пепти́ды ( др.-греч. πεπτός «питательный») — семейство веществ, молекулы которых построены из двух и более остатков аминокислот , соединённых в цепь пептидными (амидными) связями −C(O)NH− . Обычно подразумеваются пептиды, состоящие из -аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот .
Пептиды, последовательность которых короче примерно 10—20 аминокислотных остатков, могут также называться олигопепти́дами (от др.-греч. ὀλίγος «малочисленный»); при большей длине последовательности они называются полипепти́дами (от греч. πολυ- «много»); полипептиды могут иметь в молекуле неаминокислотные фрагменты, например углеводные остатки. Белка́ми обычно называют полипептиды, содержащие, примерно, от 50 аминокислотных остатков с молекулярной массой более 5000 , 6000 или 10000 дальтон .
В 1900 году немецкий химик-органик Герман Эмиль Фишер выдвинул гипотезу о том, что пептиды состоят из цепочки аминокислот, образованных определёнными связями, и в 1902 году он получил неопровержимые доказательства существования пептидной связи, а к 1905 году разработал общий метод, при помощи которого стало возможным синтезировать пептиды в лабораторных условиях. Постепенно учёные изучали строение различных соединений, разрабатывали методы разделения полимерных молекул на мономеры , синтезировали всё больше и больше пептидов .
Грань между олигопептидами и полипептидами (тот минимальный размер, при котором молекула пептида перестаёт считаться олигопептидом и становится полипептидом) достаточно условна. Источники, разграничивающие олиго- и полипептиды, как правило, определяют границу между олигопептидами и полипептидами как 10 (согласно Химической Энциклопедии ) или 10—20 (согласно определению ИЮПАК ) аминокислотных остатков. Иногда четкая грань не проводится вообще (так, например, согласно учебнику Ленинжера , размер олигопептидов — несколько , а полипептидов — много аминокислотных остатков), и формально олигопептидная молекула окситоцин , состоящая из 9 аминокислотных остатков, может упоминаться как полипептид.
Белками можно считать пептиды, масса которых превышает 5000—10 000, и(или) длина превышает 50—90 аминокислотных остатка. Эта граница тоже условна, однако в основных источниках справочной информации, где эта граница обозначена (включая ИЮПАК), она лежит в указанных пределах. Диапазон масс согласуется с диапазоном размеров подстановкой средней массы аминокислотного остатка (110 Да).
Пептиды впервые были выделены из гидролизатов белков, полученных с помощью ферментирования.
В 1953 году В. дю Виньо синтезировал окситоцин , первый полипептидный гормон . В 1963 году, на основе концепции твердофазного пептидного синтеза ( Р. Меррифилд ) были созданы автоматические синтезаторы пептидов.
Использование методов синтеза полипептидов позволило получить синтетический инсулин и некоторые ферменты .
На 2023 известно более 1500 видов пептидов, определены их свойства и разработаны методы синтеза.
Пептиды постоянно синтезируются во всех живых организмах для регулирования физиологических процессов. Свойства пептидов зависят, главным образом, от их первичной структуры — последовательности аминокислот, а также от строения молекулы и её конфигурации в пространстве ( вторичная структура ).
Молекула пептида — это последовательность аминокислот: два и более аминокислотных остатка, соединённых между собой амидной связью, составляют пептид. Количество аминокислот в пептиде может сильно варьировать. И в соответствии с их количеством различают:
Соединения, содержащие более ста аминокислотных остатков, обычно называются белками. Однако это деление условно, некоторые молекулы, например, гормон глюкагон, содержащий лишь двадцать девять аминокислот, называют белковым гормоном. По качественному составу различают:
Пептиды также делятся по способу связи аминокислот между собой:
Цепочка повторяющихся атомов называется пептидным остовом: (−NH−CH−OC−). Участок (−CH−) с аминокислотным радикалом образует соединение (−NH−C(R1)H−OC−), называемое аминокислотным остатком. N-концевой аминокислотный остаток имеет свободную α-аминогруппу (−NH), в то время как у C-концевого аминокислотного остатка свободной является -карбоксильная группа (OC−). Пептиды различаются не только по аминокислотному составу, но и по количеству, а также расположению и соединению аминокислотных остатков в полипептидную цепочку. Пример: Про-Сер-Про-Ала-Гис и Гис-Ала-Про-Сер-Про — несмотря на одинаковый количественный и качественный состав, эти пептиды имеют совершенно разные свойства [ источник не указан 1795 дней ] .

Пептидная (амидная) связь — это вид химической связи, которая возникает вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты. Амидная связь очень прочная, и в нормальных клеточных условиях (37 °C, нейтральный pH ) самопроизвольно не разрывается. Пептидная связь разрушается при действии на неё специальных протеолитических ферментов (протеаз, пептидгидролаз) .
Пептидные гормоны и нейропептиды , например, регулируют большинство процессов организма человека, в том числе принимают участие в процессах регенерации клеток. Пептиды иммунологического действия защищают организм от попавших в него токсинов. Для правильной работы клеток и тканей необходимо адекватное количество пептидов. Однако с возрастом и при патологии возникает дефицит пептидов, который существенно ускоряет износ тканей, что приводит к старению всего организма. Сегодня проблему недостаточности пептидов в организме научились решать. Пептидный пул клетки восполняют синтезированными в лабораторных условиях короткими пептидами.
Образование пептидов в организме происходит в течение нескольких минут, химический же синтез в условиях лаборатории — достаточно длительный процесс, который может занимать несколько дней, а разработка технологии синтеза — несколько лет. Однако, несмотря на это, существуют довольно весомые аргументы в пользу проведения работ по синтезу аналогов природных пептидов.
Во-первых , путём химической модификации пептидов возможно подтвердить гипотезу первичной структуры. Аминокислотные последовательности некоторых гормонов стали известны именно благодаря синтезу их аналогов в лаборатории.
Во-вторых , синтетические пептиды позволяют подробнее изучить связь между структурой аминокислотной последовательности и её активностью. Для выяснения связи между конкретной структурой пептида и его биологической активностью была проведена огромная работа по синтезу не одной тысячи аналогов. В результате удалось выяснить, что замена лишь одной аминокислоты в структуре пептида способна в несколько раз увеличить его биологическую активность или изменить её направленность. А изменение длины аминокислотной последовательности помогает определить расположение активных центров пептида и участка рецепторного взаимодействия.
В-третьих , благодаря модификации исходной аминокислотной последовательности, появилась возможность получать фармакологические препараты. Создание аналогов природных пептидов позволяет выявить более «эффективные» конфигурации молекул, которые усиливают биологическое действие или делают его более продолжительным.
В-четвёртых , химический синтез пептидов экономически выгоден. Большинство терапевтических препаратов стоили бы в десятки раз больше, если бы были сделаны на основе природного продукта.
Зачастую активные пептиды в природе обнаруживаются лишь в нанограммовых количествах. Плюс к этому, методы очистки и выделения пептидов из природных источников не могут полностью разделить искомую аминокислотную последовательность с пептидами противоположного или же иного действия. А в случае специфических пептидов, синтезируемых организмом человека, получить их возможно лишь путём синтеза в лабораторных условиях.
|
|
В разделе
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
Пептиды, обладая высокой физиологической активностью, регулируют различные биологические процессы. По биорегуляторному действию пептиды принято делить на несколько групп:
Однако такое деление условно, так как действие многих пептидов не ограничивается каким-либо одним направлением. Так, например, вазопрессин , помимо сосудосуживающего и антидиуретического действия, улучшает память.
Пептидные гормоны — это многочисленный и наиболее разнообразный по составу класс гормональных соединений, представляющий собой биологически активные вещества. Их образование происходит в специализированных клетках железистых органов, после чего активные соединения поступают в кровеносную систему для транспортировки к органам-мишеням. По достижении цели гормоны специфически воздействуют на определённые клетки, взаимодействуя с соответствующим рецептором .
Нейропептиды — соединения, синтезируемые в нейронах , обладающие сигнальными свойствами. Действие нейропептидов на ЦНС очень разнообразно. Они воздействуют непосредственно на мозг и контролируют сон, влияют на память, поведение, процесс обучения, обладают обезболивающим действием.
Наиболее изученные пептиды, участвующие в иммунном ответе — тафцин , II и 1. Их синтез в клетках организма человека обеспечивает функционирование иммунной системы .