Interested Article - ДНК-метилтрансфераза
- 2020-02-14
- 1
ДНК-метилтрансфера́зы ( ДНК-метилазы, англ. DNA methyltransferase, DNA MTase, DNMT ) — группа ферментов , катализирующих метилирование нуклеотидных остатков в составе ДНК . Активность метилтрансфераз, заключающаяся в переносе метильных (CH 3 —) групп на азотистое основание цитозин в составе ДНК, ведет к изменению свойств ДНК, при этом изменяется активность, функции соответствующих генов, а также пространственная структура нуклеиновой кислоты ( конформация ).
ДНК-метилтрансферазной активностью обладают несколько групп ферментов [ источник не указан 4791 день ] :
- цитозин(C5)-ДНК-метилтрансферазы ( КФ от 25 мая 2011 на Wayback Machine ) — ферменты, ответственные за поддержание картины метилирования генома клетки;
- ферменты системы рестрикции-модификации , проявляющие КФ от 25 мая 2011 на Wayback Machine (аденин(N6)-ДНК-метилтрансферазная) и КФ от 25 мая 2011 на Wayback Machine (цитозин(N4)-ДНК-метилтрансферазная) активности (которые, в сущности, не являются основными для этих ферментов); примерами могут служить ферменты PvuII и TaqI.
Все известные ДНК-метилтрансферазы используют в качестве донора метильной группы S-аденозил-метионин .
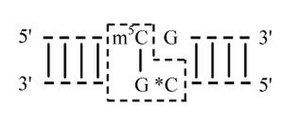
Цитозин(C5)-ДНК-метилтрансферазы катализируют перенос метильной группы от S-аденозил-метионина на остаток цитозина , находящегося в специфической последовательности в двухцепочечной ДНК , с образованием и S- . Эта реакция необратима. Сравнение структуры прокариотических и эукариотических ДНК-метилтрансфераз позволяет отнести их к одному классу ферментов . Все эти ферменты представляют собой мономерные белки, содержащие консервативные гомологичные участки ( мотивы ), ответственные за ферментативные функции. У большинства цитозин(C5)-ДНК-метилтрансфераз насчитывают до 10-ти таких участков. Среди них различают 4 умеренногомологичных мотива (II, III, V, VII), которые могут отсутствовать у некоторых ферментов, и 6 высокогомологичных мотивов (I, IV, VI, VIII, IX, X). Между участками VIII и IX расположен домен TRD ( target-recognizing domen , мишень-распознающий домен), длина и аминокислотный состав которого вариабельны.
После репликации ДНК эукариотические ДНК-метилазы метилируют цитозин по сайтам CpG и CpNpG во вновь синтезированных цепях. Далее эукариотические ДНК-метилазы выполняют функцию поддержания метилирования [ источник не указан 4791 день ] метилирование ДНК de novo по уже отмеченным сайтам.

ДНК-метилтрансферазы млекопитающих
У млекопитающих обнаружены четыре активных ДНК-метилтрансферазы: DNMT1, DNMT2 (TRDMT1), DNMT3a и DNMT3b [ источник не указан 4791 день ] . Также обнаружен белок, структурно схожий с семейством DNMT3, но не проявляющий метилтрансферазной активности — DNMT3L (DNMT3- like ).
Семейство DNMT1
ДНК-метилтрансфераза семейства DNMT1 мыши представляет собой белок с молекулярной массой 190 кДа, содержащий 1620 аминокислотных остатков . Основная активность этого фермента заключается в метилировании полуметилированных сайтов CpG. Молекула ДНК-метилтрансферазы DNMT1 значительно больше прокариотического фермента за счёт наличия N-концевого регуляторного участка, составляющего ²/ 3 от всей длины полипептидной цепи. Именно этот участок отвечает за «предпочтение» ферментом полуметилированных сайтов перед неметилированными. Регуляторный N-концевой участок соединён с каталитическим C-концевым при помощи Gly - Lys -повторов. Считается, что ген dnmt1 образовался путём слияния гена прокариотической ДНК-метилазы с одним или двумя генами .
|
ДНК-метил-
трансфераза |
Ассоциированный
белок |
Функция
ассоциированного белка |
|---|---|---|
| DNMT1 | DNMT3a |
метилирование ДНК
de novo |
| DNMT3b | та же | |
| HDAC1 | деацетилаза гистонов | |
| HDAC2 | та же | |
| SUV39H1 |
метилтрансфераза
гистона H3 (Lys9) |
|
| Rb | опухолевый супрессор | |
| PML-RAR |
онкогенный
транскрипционный фактор |
|
| DMAP1 |
транскрипционный
корепрессор |
|
| hSNF2H |
белок, задействованный
в перестройках хроматина |
|
| PCNA |
фактор
репликации ДНК |
|
| MBD2 |
связывание с
метилированными CpG сайтами |
|
| MBD3 | та же | |
| MeCP2 | та же | |
| HP1β |
белок
гетеро хроматина |
|
| РНК-полимераза II | РНК-полимераза II | |
| DNMT3a | DNMT1 |
поддерживающее
метилирование ДНК |
| DNMT3L | репрессор транскрипции | |
| HDAC1 | деацетилаза гистонов | |
| SUV39H1 |
метилтрансфераза
гистона H3 (Lys9) |
|
| PML-RAR |
онкогенный
транскрипционный фактор |
|
| RP58 |
транскрипционный
корепрессор |
|
| HP1β |
белок
гетеро хроматина |
|
| SUMO-1 |
убиквитинподобный
белок |
|
| DNMT3b | DNMT1 |
поддерживающее
метилирование ДНК |
| DNMT3L | репрессор транскрипции | |
| HDAC1 | деацетилаза гистонов | |
| SUMO-1 |
убиквитинподобный
белок |
|
| DNMT3L | DNMT3a |
метилирование ДНК
de novo |
| DNMT3b | та же | |
| HDAC1 | деацетилаза гистонов | |
| CMT3 | гомолог HP1 |
белок
гетеро хроматина |
N-концевой домен содержит различные специфические последовательности, такие как сигнал ядерной локализации (NLS, nuclear localization signal ), цистеин-богатый Zn-связывающий мотив и специальная последовательность, направляющая метилазу в область репликации ДНК (TRF, protein targeting to DNA replication foci ). Фермент локализуется в областях репликации ДНК в течение S-фазы клеточного цикла , а после её завершения диффундирует в нуклеоплазму . Также N-концевой домен фермента DNMT1 содержит последовательность, гомологичную репрессору транскрипции HRX, с помощью которой ДНК-метилаза in vivo способна ассоциироваться с деацетилазой гистонов.
Человеческий фермент DNMT1 принципиально не отличается от мышиного.
Фермент DNMT1 имеет несколько изоформ: соматический DNMT1, промежуточный вариант (DNMT1b) и изоформа, характерная для ооцитов (DNMT1o). DNMT1o синтезируется и накапливается в цитоплазме ооцитов , а затем, во время раннего эмбрионального развития , транспортируется в клеточное ядро (соматический же DNMT1 постоянно локализуется в ядре).
Фермент может проявлять аномальную метилирующую активность, в частности, метилируя CpG-пары в области петли одноцепочечной ДНК, уже содержащей метилированные сайты CpG [ источник не указан 4791 день ] .
Инактивация мышиного фермента DNMT1 приводит к значительному (до 70 %) уменьшению метилирования генома и к гибели развивающихся эмбрионов на 10-11 день развития. Оставшийся уровень в 30 % и способность стволовых клеток к метилированию ретровирусной ДНК de novo обеспечиваются другими ДНК-метилтрансферазами.
Семейство DNMT2 (TRDMT1)
ДНК-метилтрансфераза DNMT2 состоит из 415-ти аминокислотных остатков и не содержит N-концевого регуляторного домена. Инактивация гена dnmt2 у стволовых клеток мышей не влияло на их способности к поддержанию картины метилирования генома и к метилированию de novo . Аминокислотная последовательность фермента сходна с последовательностями коротких ДНК-метилаз растений, грибов, прокариот. В 2006 году Goll и соавт. показали, что фермент производит метилирование тРНК Asp по цитозину-38 как in vivo , так и in vitro , и не метилирует ДНК. Чтобы отразить функцию фермента в названии, было решено переименовать его в TRDMT1 ( tRNA aspartic acid methyltransferase 1 , метилтрансфераза тРНК , транспортирующей аспарагиновую кислоту ).
Семейство DNMT3
ДНК-метилтрансферазы DNMT3a и DNMT3b производят метилирование полуметилированных и неметилированных сайтов CpG с одинаковой скоростью. Человеческие DNMT3a и DNMT3b содержат 908 и 859 аминокислотных остатков, соответственно; ген dnmt3b может кодировать и меньшие полипептиды вследствие альтернативного сплайсинга . Гены dnmt3a и dnmt3b активно экспрессируются в недифференцированных эмбриональных стволовых клетках, тогда как в дифференцированных клетках уровень их экспрессии очень низкий. Инактивация этих генов у мышей приводила к гибели особей, в среднем, к четырёхнедельному возрасту.
DNMT3a активнее метилирует сайты CpG, чем CpA, CpT, и CpC. DNMT3a метилирует сайты CpG намного медленнее, чем DNMT1, но быстрее, чем DNMT3b. Несмотря на то, что функции ферментов DNMT3a и DNMT3b во многом перекрываются, имеются также и различия. Так, DNMT3b отвечает за метилирование сателлитных повторов в области центромерного линкера, а мутация гена dnmt3b у человека приводит к ( immunodeficiency cenromeric instability , иммунодефицитная нестабильность центромер, аномалии лица). ICF-синдром — это редкое аутосомальное рецессивное генетическое заболевание, которое характеризуется дефектами иммунной системы и нарушением нормального строения лица. Синдром связан с нестабильностью центромерного гетерохроматина. При этом основные компоненты гетерохроматина, сателлитные участки DNA II и DNA III, оказываются недостаточно метилированы.
DNMT3L содержит DNA-метилтрансферазный мотив и является необходимым для эффекта материнского геномного импринтинга , оставаясь при этом каталитически неактивным (вследствие отсутствия некоторых ключевых участков, необходимых для осуществления катализа ). DNMT3L экспрессируется при гаметогенезе , когда и происходит геномный импринтинг. Отсутствие DNMT3L ведет к биаллельной экспрессии генов, для которых в норме не характерна экспрессия материнского аллеля . DNMT3L взаимодействует с DNMT3a и DNMT3b в клеточном ядре. Хотя DNMT3L неспособен проводить метилирование, белок может принимать участие в репрессии транскрипции (в ассоциации с гистоновой деацетилазой).
ДНК-метилтрансферазы растений

У растений обнаружено три семейства ДНК-метилтрансфераз.
Семейство Met1
ДНК-метилазы этого семейства сходны с ферментами семейства DNMT1 млекопитающих. У Arabidopsis thaliana ( Резуховидка Таля ) найдены 2 такие ДНК-метилтрасферазы: METI и METII. Эти белки отличаются от мышиного DNMT1 строением N-концевого домена. Метилазы, гомологичные METI Arabidopsis thaliana найдены у моркови и риса .
В это семейство входит и ген NtMETI табака (кодирует белок в 175 кДА, 1556 аминокислотных остатков), ген ДНК-метилтрансферазы гороха (кодирует белок с массой 174 кДа, 1554 аминокислотных остатков). Наиболее активны данные ферменты в клетках меристем растений.
Семейство хромометилаз (CMT)
Семейству принадлежат полиморфные ДНК-метилазы. Впервые открыты у Arabidopsis thaliana . Молекулы данных ферментов содержат между I и IV участками хромодомен в 80 аминокислотных остатков, отвечающий за взаимодействие со специфическими белками хроматина и с ядерной мембраной . Белки CMT3 Arabidopsis thaliana и Zmet2 кукурузы осуществляют поддерживающее метилирование ДНК по CpNpG и асимметричным сайтам. Выключение их активности ведёт к реактивации эндогенных транспозонов .
Хромометилазы характерны только для растений.
Семейство DRM
Семейство ДНК-метилаз, у которых консервативные мотивы переставлены местами и составлены в следующем порядке: VI—IX — X—I — II—III — IV—V. Отсюда и название семейства: domain rearranged methylases , DRM. Гены этих ферментов были найдены у Arabidopsis thaliana , кукурузы, сои . Несмотря на то, что функциональные мотивы перемешены, молекула формирует трёхмерную структуру, подобную прокариотической ДНК-метилтрансферазе HhaI. N-концевой домен содержит убиквитинсвязывающий участок, что создаёт возможность убиквитинирования этих ферментов. По функции эти ДНК-метилтрансферазы сходны с семейством DNMT3 млекопитающих, в частности, они также способны эффективно осуществлять метилирование ДНК de novo по асимметричным сайтам.
Другие ДНК-метилтрансферазы растений
Существуют и другие ДНК-метилтрансферазы растений, такие как METIII Arabidopsis thaliana , лишённая N-концевого домена.
Во отличие от животных, инактивация ДНК-метилтрансфераз у растений не ведёт к летальному эффекту, однако также приводит к аномалиям развития.
ДНК-метилтрансферазы грибов
ДНК-метилтрансферазы Ascobolus
У аскомицета Ascobolus обнаружены 2 гена: MASCI и MASK2 . Первый кодирует белок с молекулярной массой 61,5 кДА, состоящий из 537 аминокислотных остатков [ источник не указан 4791 день ] . Он содержит 10 консервативных мотивов, характерных для цитозин(С5)-метилтрасфераз, но отличается более коротким TRD между VIII и IX мотивом и N-концевым доменом, негомологичным таковому у DNMT1. Мутация в гене MASCI не влияет на поддерживающее метилирование ДНК, но нарушает метилирование de novo повторов в ДНК и приводит к стерильности штаммов, гомозиготных по данной мутации. Ген MASK2 Ascobolus принадлежит семейству DNMT1.
Выключение обоих генов не приводит к нарушению поддерживающего метилирования ДНК Ascobolus , что говорит о наличии ещё как минимум одного гена ДНК-метилтрансферазы [ источник не указан 4791 день ] .
ДНК-метилтрансфераза Neurospora crassa
У Neurospora crassa имеется один ген ДНК-метилтрансферазы — DIM-2 . Белок DIM-2 отвечает за метилирование всего генома, его инактивация ведет к полному деметилированию ДНК Neurospora crassa . Белок состоит из 1454 аминокислотных остатков и принадлежит к семейству DNMT1. Нарушения экспрессии DIM-2 не приводят к заметным аномалиям в развитии гриба.
См. также
Литература
- Bestor T.H. The DNA methyltransferases of mammals. // Human Molecular Genetics, 2000, Vol. 9, No. 16 Review, pp. 2395–2402.
- Buryanov Ya.I., Shevchuk T.V. DNA Methyltransferases and Structural-Functional Specificity of Eukaryotic DNA Modification. // Biochemistry (Moscow), Vol. 70, No. 7, 2005, pp. 730, translated from Biokhimiya, Vol. 70, No. 7, 2005, pp. 885.
- Goll M.G., Kirpekar F., Maggert K.A., Yoder J.A., Hsieh C-L., Zhang X., Golic K.G., Jacobsen S.E., Bestor T.H. Methylation of tRNA Asp by the DNA Methyltransferase Homolog Dnmt2. // Science 311 (5759), 2006, pp. 395–398.
Ссылки
- от 28 сентября 2007 на Wayback Machine
- 2020-02-14
- 1