Interested Article - Химерный рецептор антигена
- 2021-11-07
- 1
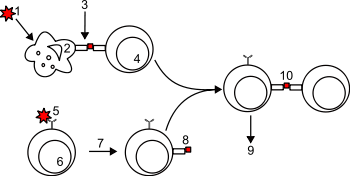
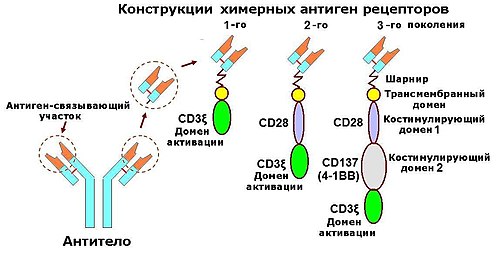
Химерный рецептор антигена ( англ. Chimeric antigen receptor , CAR ) — это рекомбинантный гибридный белок , сочетающий фрагмент антитела, обладающий способностью очень избирательно связываться с конкретными антигенами , с сигнализирующими доменами, способными активировать Т-клетки . Поскольку такой гибридный белок состоит из частей, полученных из разных источников, его называют химерным . Иммунные эффекторные клетки, имеющие сконструированные таким образом CAR, приобретают высокую селективность за счёт добавленного извне рецептора от моноклонального антитела .
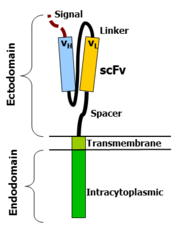
Технология CAR позволяет перепрограммировать собственные иммунные клетки пациента за пределами его тела, с тем чтобы создать CAR, позволяющий охотиться на раковые клетки и эффективно разрушать опухоли у пациента. Полученные клетки CAR затем используют для так называемой — разновидности иммунотерапии рака . Обычно CAR состоят из внеклеточного антигенраспознающего фрагмента, который связан, с помощью спейсера-шарнира и трансмембранного домена, со внутриклеточным доменом сигнализации, который может состоять из костимулирующего домена и участка Т-клеточной активации.
CARs опознают антигены не только по основным антигенам гистосовместимости , что и отличает их от физиологических Т-клеточных рецепторов (ТКР). Поэтому CAR-Т-клетки могут преодолеть некоторые из основных механизмов, посредством которых опухолям удаётся избежать опознания их Т-клеткой по антигенам гистосовместимости
Ещё одной особенностью CARs является их способность связывать не только белки, но и углеводы , ганглиозиды , протеогликаны , а также гликозилированные белки , тем самым расширяя спектр потенциальных целей.
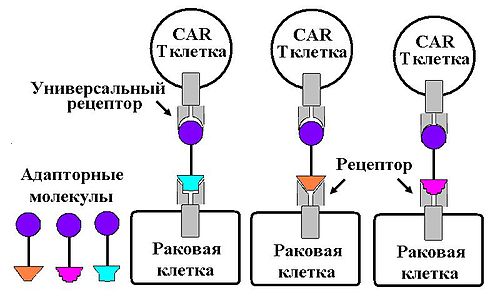
В дополнение к антиген-специфическому связыванию, разработаны так называемые «универсальные системы CAR». Так например, разработаны CAR, связывающие авидин , что позволило использовать единожды полученный CAR не против одного антигена, ассоциированного с опухолью, а против бесчисленного множества различных антигенов, распознаваемых с помощью различных антител, модифицированных биотином , что позволяет выявлять их авидином ( ). Аналогичным образом устроена универсальная система CAR, связывающая (FITC) Универсальная система CAR названная «Supra CAR» состоит из двух модулей: универсального рецептора (zipCAR) и адаптерного модуля scFv распознающего антиген опухоли (zipFv). Универсальный рецептор zipCAR образуется в результате слияния внутриклеточных сигнальных доменов и лейциновой «застёжки-молнии» (zipper) в качестве внеклеточного домена. Молекула адаптера zipFv состоит из домена узнающего и соединяющегося с лейциновой «застёжкой-молнией» и домена scFv. ScFv молекулы zipFv связывается с опухолевым антигеном, а лейциновая молния связывает и активирует zipCAR на иммунных клетках . Модуль универсального рецептора zipCAR может быть расположен на различных типах клеток: на T-лимфоцитах с CD4 + и CD8 + корецепторами Т-клеточных рецепторов ; на регуляторных Т-клетках , а также на NK-клетках . Множество различных zipFv молекул позволяет легко и быстро перенастраивать систему на новые антигены без необходимости заново конструировать CAR-Т-клетки.
При терапии с помощью CAR-Т-клеток возможны осложнения в виде синдрома высвобождения цитокинов, в частности повышение уровня интерлейкина 6 и интерлейкина 2 . Система SUPRA CAR даёт возможность быстро остановить развитие синдрома высвобождения цитокинов так как позволяет добавить при необходимости конкурентные zipFv, что защитит zipCAR от активации
Использование CAR-модифицированных клеток для терапии рака
В течение многих десятилетий большинство видов рака лечили по стандартному набору терапевтических подходов, в числе которых были хирургия, радиационная терапия и химиотерапия. Теперь этот список дополнила иммунотерапия — тип лечения, который для борьбы с заболеванием использует иммунную систему пациента. Повышению значимости иммунотерапии для лечения рака способствовала разработка CAR-модифицированных T-клеток, нацеленных на раковые антигены. Так например, были разработаны CAR, направленные против подопланина (PDPN), белка, который, как правило, в изобилии содержится в солидных опухолях, в том числе в клетках глиобластомы наряду с, вызванной делецией , мутантной формой рецептора эпидермального фактора роста (EGFR) — белком , а также против эпитопа Tn муцина MUC1 опухолевого антигена , обнаруженного при различных карциномах , что позволило (пока в опытах на мышах) успешно лечить эти заболевания.
В случае, когда здоровые ткани имеют те же целевые антигены, что и опухолевые клетки, терапия с помощью CAR, направленная на подобный антиген, может вызвать значительный токсический эффект. Кроме того, CD4 + -Treg-клетки подавляют эффективность клеточной терапии CAR-Т. Поэтому нужно тщательно подбирать клоны CAR-Т .
CAR-Т-клеточные продукты, полученные из хорошо подобранных клонов Т-клеток, имеют значительно более высокую эффективность по сравнению с продуктами, полученными из неотобранных Т-клеток, которые различаются по фенотипическому составу. Поэтому селекция и отбраковка имеют важное значение для разработки CAR-Т, где синергично сочетается противоопухолевое действие самых мощных фенотипов CD4 + - и CD8 + -клонов ..
Снизить токсический эффект CAR на здоровые ткани можно также с помощью CAR, сконструированных так, что синтетический рецептор Notch для одного антигена индуцирует экспрессию CAR для второго антигена. Такие Т клетки с двухрецепторным «замком-затвором» способны активироваться только в отношении опухолевых клеток, имеющих оба антигена, что повышает их избирательность в отношении именно опухолевых клеток .
С середины 2010-х годов Т-клетки CAR были применены для лечения более тысячи пациентов с поздними стадиями лейкозов и лимфом. Большинство из них до сих пор живы, а сотни полностью излечились .
Терапия твердых (солидных) опухолей
В солидной опухоли часто формируется отклоняющаяся от нормы сосудистая сеть, которая может препятствовать инфильтрации Т-клеток и формировать иммуносупрессивное микроокружение опухоли. В частности усиленное отложение компонентов внеклеточного матрикса может служить физическим барьером для проникновения CAR-T-клеток и прямого их контакта с раковыми клетками. Кроме того необходимо преодолевать иммуносупрессивное микроокружение, которое выделяя различные цитокины ингибирует функцию CAR-T-клеток. Все это надо иметь ввиду при разработке и коструировании CAR-T-клеток направленных против солидных опухолей.
Поскольку характерной особенностью примерно 50 % твёрдых опухолей является гипоксическая среда , были спроектированы Т-клетки CAR, которые реагируют на гипоксическую среду — они неэффективны, если не находятся в гипоксической среде. С этой целью к ним добавлен субдомен HIF1α (hypoxia-inducible factor 1-alpha). Введение «датчика опухолевого микроокружения» обеспечивает дополнительный уровень безопасности за счёт сведения к минимуму внецелевого действия Т-клетки CAR . Другой способ сведения к минимуму внецелевого действия Т-клетки CAR, (называемый CytomX Probody-технология), заключается в «маскировании» (блокировке) распознающего мишень участка антитела до тех пор пока Т-клетка CAR не попадёт в опухоль, где её маскировка будет удалена протеазой, уникальной для микроокружения опухоли .
Эффективность Т-клеточной иммунотерапии CAR против солидных опухолей зависит от накопления, пролиферации и продолжительности наличия Т-клеток в месте опухоли. Чтобы эффективно использовать Т-клетки, экспрессирующие CAR, в иммунотерапии солидных опухолей, крайне важно, чтобы внутривенно вводимые CAR-T-клетки накапливались и размножались в месте опухоли, а главное чтобы они непрерывно работали на протяжении достаточно долгого времени, находя и устраняя вредные раковые клетки. Чтобы противостоять дисфункции Т-клеток в микроокружении опухоли, CAR Т-клетки, были изменены так, чтобы они секретировали интерлейкин 10 (IL-10), что способствовало пролиферации и повышению эффективности функционирования CAR T-клеток, благодаря чему удалось достигнуть полной регрессии солидных опухолей и метастазов рака у мышей, включая рак толстой кишки, рак молочной железы, меланому и рак поджелудочной железы. Т-клетки IL-10 CAR также индуцировали в лимфоидных тканях надежную защиту от повторного заражения опухолью. В опытах на мышиной модели солидной опухоли, была разработана технология селекции клонов ИПСК несущих клетки обеспечивающие наиболее эффективную иммунотерапию после их дифференцировки в CAR-T-клетки. При этом клетки, с целью усилить их пролиферацию и персистенцию в опухолях, подвергали ещё двум дополнительным генетическим манипуляциям:
- генетическому нокауту киназы называемой , которая ингибирует передачу сигналов антиген-рецептор ;
- трансдукции клеток генами , кодирующими мембраносвязанный интерлейкин 15 (IL-15) и его .
Использование CAR-модифицированных клеток для предотвращения аутоиммунных реакций
Предотвращение реакции отторжения трансплантата
Использование терапии химерными анти- CD40 -антителами, предотвращая активацию гуморальных механизмов отторжения и дисрегуляцию путей регуляции свёртывания крови, позволило ксенотрансплантату сердца свиньи проработать в теле у примата ( бабуина ) 945 дней. Подобные подходы в конечном счёте могут быть использованы и для трансплантации органов в организм человека, что очень актуально, учитывая острую нехватку пригодных для трансплантации органов .
Регуляторные Т-клетки (Tregs) играют существенную роль в предотвращении аутоиммунитета , и в частности в профилактике реакции отторжения трансплантата , препятствующей успешной трансплантации органов .
Применение регуляторных Т-клеток в клинической практике было ограничено крайне низким количеством этих клеток в периферийной крови и поликлональности — отсутствия у их популяции узкой направленности (из-за чего можно было вызвать нежелательное общее понижение иммунитета человека). Был разработан метод трансдукции регуляторных Т-клеток человека с помощью CAR, который нацелен на молекулу А2 человеческого лейкоцитарного антигена класса I. Использование химерных антигенных рецепторов HLA-A2 -CAR, в которых регуляторные Т-клетки, генетически сконструированы для экспрессии внеклеточных одноцепочечных Ab (ScFv — ) антиген-связывающих доменов, поможет защитить пересаженные ткани и органы от отторжения иммунной системой пациента .
Терапия аутоиммунных заболеваний
Разработана стратегия лечения аутоиммунных заболеваний с помощью химерного рецептора аутоантител CAAR ( англ. chimeric autoantibody receptor ), который нацеливает T-клетки на уничтожение аутореактивных В-клеток. Так, например, спроектированы человеческие Т-клетки, синтезирующие CAAR, состоящий из аутоантигена (в данном случае десмоглеина Dsg3), слитого с сигнальным доменом CD137-CD3ζ, который активирует T-клетки. Такие Dsg3-CAAR-T-клетки проявляют избирательную цитотоксичность против В-клеток, экспрессирующих анти-Dsg3 и поэтому способны избирательно устранить Dsg3-специфические В-клетки in vivo, не затрагивая при этом другие В-клетки .
Технология ускоренного выращивания CAR
Внедрение последовательности Strep-tag II (пептидной последовательности из восьми остатков (Trp-Ser-His-Pro-Gln-Phe-Glu-Lys), которая проявляет сродство к стрептавидину ) в определённом участке CAR позволило использовать эту последовательность в качестве маркера для идентификации и быстрого выделения. С помощью специального антитела, которое связывается с Strep-tag, сконструированные клетки можно быстро размножить в 200 раз. При этом 95 % клеток содержат CAR (тогда как обычно число таких клеток не превышало 43 %)
CAR T-клетки секретирующие IL-18
Провоспалительный цитокин интерлейкин 18 (IL-18) обладает способностью увеличивать активность клеток ЕК в селезёнке , индуцировать экспрессию интерферона -γ (IFN-γ), а также активировать лимфоциты и моноциты , не вызывая при этом сильную дозозависимую токсичность . Поэтому были созданы IL-18-секретирующие T клетки с химерным рецептором антигена (IL-18-CAR T), что позволило значительно увеличить пролиферацию CAR T клеток и противоопухолевую активность организма .
Универсальные CAR T-клетки, устойчивые к ингибированию PD1
С помощью тройного редактирования генома удалось создать CAR-T-клетки, у которых снижена « аллореактивность » — они не вызывают болезни « трансплантат против хозяина» и имеют повышенную противоопухолевую активность, так как устойчивы к ингибированию воздействием опухоли на PD1 (programmed cell death protein 1) . Как известно, опухоли, воздействуя на ген PD1, способны предотвращать атаку на них иммунных клеток, поэтому, если иммунным клеткам не хватает PD1, то раковые клетки не могут ими манипулировать. Есть, однако, риск того, что такие иммунные клетки «без тормозов» могут начать атаковать и здоровые клетки. Эта разработка будет способствовать широкому внедрению в клинику технологии CAR, поскольку если до сих пор CAR-T-клетки создавали для каждого пациента персонально, что было очень дорого, сложно и требовало много времени, то со внедрением новой технологии процесс подбора CAR-T-клеток станет значительно проще.
Разработана также технология, использующая полимерные наночастицы для переноса в ядра Т-клеток ДНК с генами, нацеливающими CAR. Эти полимерные наночастицы просты в изготовлении и достаточно стабильны, что упрощает их хранение и снижает их стоимость . Имея заранее заготовленную «библиотеку» таких наночастиц, можно быстро перепрограммировать специализацию CAR. Более того, авторы утверждают, что их технология позволяет проводить перепрограммирование in situ , просто вводя наночастицы, нацеленные на Т-клетки в кровотоке .
CAR-T-NKR-2-клетки
Фирма Celyad CAR-T создала принципиально новые CAR-T-NKR-2-клетки. В отличие от метода scFv-антител, используемого «классическим» CAR-T, Celyad CAR-T использует, как первичный рецептор в Т-клетках, для распознавания опухолевого антигена рецептор, состоящий из продукта полноразмерного нативного человеческого NKG2D-гена, слитого с цитоплазматическим сигнальным доменом нативного человеческого CD3ζ.
NKG2D является нормальным человеческим белком, который играет важную роль в защите человеческого организма от инфекций и рака. Лиганды к рецепторному белку NKG2D в норме не синтезируются. Они появляются на поверхности клетки лишь в случае стрессовых ситуаций, таких как вирусная инфекция, окислительный стресс, генотоксические препараты, повреждение тканей, тепловой шок, действие воспалительных цитокинов и главным образом при злокачественной трансформации. Важно отметить что этот рецептор распознаёт порядка 80 % всех раковых клеток (как солидные опухоли, так и различные виды рака крови), что значительно расширяет диапазон его использования. Клинические испытания в фазе 1а показали что препарат безопасен для человека
«Готовый» ресурс для лечения рака представляют собой, полученные из ИПСК человека оптимизированные NK-клетки с трансмембранным доменом NKG2D (NK-CAR-iPSC-NK cells). Отмечается что они менее токсичны чем обычные CAR-T и при этом дольше живут в организме
CAR-макрофаги
Известно что макрофаги могут поглощать и убивать клетки в процессе фагоцитоза . Новым подходом к терапии солидных (лат. solidus — твёрдый) опухолей, которые плохо поддавались терапии CAR-T-клетками, является попытка использовать макрофаги, генетически модифицированные добавлением химерного рецептора антигена, чтобы специально направлять их к опухолевым клеткам. Предполагается, что CARMA (Chimeric antigen receptor macrophages — CAR-макрофаги) помогут лечить метастатические солидные опухоли.
Неиммунные клетки, перепрограммированные в аналоги Т-клеток
С целью упрощения и удешевления технологии получения Т-клеток, исследователи создали синтетические клетки, имитирующие Т-клетки. Для этого они перепрограммировали клетки человеческих почек (которые можно извлечь из мочи ) и стволовые клетки, получаемые липосакцией . Эти синтетические клетки оснащены сигнальным механизмом, который состоит из молекулярных антенн и антител которые могут распознавать целевые структуры раковой клетки, а также имеют генетический механизм, который генерирует ферментный комплекс, разрушающий мембрану клетки-мишени, и фермент который преобразует противораковое вещество проникшее во внутреннюю часть опухолевой клетки из неактивного предшественника (препарата, который должен быть добавлен в организм извне) в активное состояние. В результате раковые клетки разрываются, активное вещество высвобождается и разрушает другие опухолевые клетки в «зоне смерти» вокруг синтетической Т-клетки.
Появилась технология позволяющая производить CAR Т клетки в промышленных масштабах из генетически модифицированных индуцированных плюрипотентных стволовых клеток ( ИПСК ). Готовые линии таких клеток можно бесконечно долго размножать в качестве не дорогого лекарственного препарата. Перед употреблением такие модифицированные ИПСК клетки превращают в зрелые CAR Т клетки с помощью искусственного органоида тимуса , который работает, имитируя среду тимуса, органа, в котором Т-клетки развиваются из стволовых клеток крови .
См. также
Примечания
- ↑ Gross G. , Eshhar Z. (англ.) // Annual review of pharmacology and toxicology. — 2016. — Vol. 56. — P. 59—83. — doi : . — .
- Sadelain M. , Brentjens R. , Rivière I. (англ.) // Cancer discovery. — 2013. — Vol. 3, no. 4 . — P. 388—398. — doi : . — .
- ↑ Liu L., Qu Y., Cheng L. et al. (2022). Engineering chimeric antigen receptor T cells for solid tumour therapy. Clinical and Translational Medicine, 12(12), e1141. PMID PMC doi :
- Liu L. , Qu Y. , Cheng L. , Yoon C. W. , He P. , Monther A. , Guo T. , Chittle S. , Wang Y. (англ.) // Clinical And Translational Medicine. — 2022. — December ( vol. 12 , no. 12 ). — P. e1141—1141 . — doi : . — .
- Haji-Fatahaliha M. , Hosseini M. , Akbarian A. , Sadreddini S. , Jadidi-Niaragh F. , Yousefi M. (англ.) // Artificial cells, nanomedicine, and biotechnology. — 2015. — P. 1—11. — doi : . — .
- Rosenberg S. A. , Restifo N. P. (англ.) // Science (New York, N.Y.). — 2015. — Vol. 348, no. 6230 . — P. 62—68. — doi : . — .
- Kochenderfer J. N. , Dudley M. E. , Kassim S. H. , Somerville R. P. , Carpenter R. O. , Stetler-Stevenson M. , Yang J. C. , Phan G. Q. , Hughes M. S. , Sherry R. M. , Raffeld M. , Feldman S. , Lu L. , Li Y. F. , Ngo L. T. , Goy A. , Feldman T. , Spaner D. E. , Wang M. L. , Chen C. C. , Kranick S. M. , Nath A. , Nathan D. A. , Morton K. E. , Toomey M. A. , Rosenberg S. A. (англ.) // Journal of clinical oncology : official journal of the American Society of Clinical Oncology. — 2015. — Vol. 33, no. 6 . — P. 540—549. — doi : . — .
- Dai H. , Wang Y. , Lu X. , Han W. (англ.) // Journal of the National Cancer Institute. — 2016. — Vol. 108, no. 7 . — doi : . — .
- Longwei Liu, Yunjia Qu, Leonardo Cheng, Chi Woo Yoon, Peixiang He, Abdula Monther, Tianze Guo, Sarah Chittle, Yingxiao Wang. (англ.) // Clinical and Translational Medicine. — 2022-12. — Vol. 12 , iss. 12 . — ISSN . — doi : . 9 марта 2023 года.
- Abken H. (англ.) // Immunity. — 2016. — Vol. 44, no. 2 . — P. 214—216. — doi : . — .
- Kawalekar O. U. , O'Connor R. S. , Fraietta J. A. , Guo L. , McGettigan S. E. , Posey A. D. Jr. , Patel P. R. , Guedan S. , Scholler J. , Keith B. , Snyder N. , Blair I. , Milone M. C. , June C. H. (англ.) // Immunity. — 2016. — Vol. 44, no. 2 . — P. 380—390. — doi : . — .
- Vago L. , Perna S. K. , Zanussi M. , Mazzi B. , Barlassina C. , Stanghellini M. T. , Perrelli N. F. , Cosentino C. , Torri F. , Angius A. , Forno B. , Casucci M. , Bernardi M. , Peccatori J. , Corti C. , Bondanza A. , Ferrari M. , Rossini S. , Roncarolo M. G. , Bordignon C. , Bonini C. , Ciceri F. , Fleischhauer K. (англ.) // The New England journal of medicine. — 2009. — Vol. 361, no. 5 . — P. 478—488. — doi : . — .
- Haile Samuel , Conner Joe , Mackall Crystal. // Cancer Immunology Research. — 2016. — Январь ( т. 4 , № 1 Supplement ). — С. B049—B049 . — ISSN . — doi : .
- Long Adrienne H. , Lee Daniel W. , Mackall Crystal L. // Current Stem Cell Reports. — 2015. — 7 октября ( т. 1 , № 4 ). — С. 187—196 . — ISSN . — doi : .
- Rota Christopher M. , Tschernia Nicholas , Feldman Steven , Mackall Crystal , Lee Daniel W. // Cancer Research. — 2015. — 1 августа ( т. 75 , № 15 Supplement ). — С. 3151—3151 . — ISSN . — doi : .
- Zhu X. , Niedermann G. (англ.) // Oncoscience. — 2015. — Vol. 2, no. 5 . — P. 476—482. — .
- Jackson H. J. , Rafiq S. , Brentjens R. J. (англ.) // Nature reviews. Clinical oncology. — 2016. — Vol. 13, no. 6 . — P. 370—383. — doi : . — .
- ↑ Urbanska K. , Lanitis E. , Poussin M. , Lynn R. C. , Gavin B. P. , Kelderman S. , Yu J. , Scholler N. , Powell D. J. Jr. (англ.) // Cancer research. — 2012. — Vol. 72, no. 7 . — P. 1844—1852. — doi : . — .
- Ma J. S. , Kim J. Y. , Kazane S. A. , Choi S. H. , Yun H. Y. , Kim M. S. , Rodgers D. T. , Pugh H. M. , Singer O. , Sun S. B. , Fonslow B. R. , Kochenderfer J. N. , Wright T. M. , Schultz P. G. , Young T. S. , Kim C. H. , Cao Y. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2016. — Vol. 113, no. 4 . — P. 450—458. — doi : . — .
- от 22 апреля 2016 на Wayback Machine . MedicalXpress
- ↑ Jang Hwan Cho, James J. Collins, Wilson W. Wong (2018). . Cell, 173(6), 1426—1438.e11, doi :
- Kalos M. (англ.) // Journal for immunotherapy of cancer. — 2016. — Vol. 4. — P. 5. — doi : . — .
- BHATTACHARYA, S. & TELANG, A. (2023). от 6 мая 2023 на Wayback Machine . от 6 мая 2023 на Wayback Machine .
- Shiina S. , Ohno M. , Ohka F. , Kuramitsu S. , Yamamichi A. , Kato A. , Motomura K. , Tanahashi K. , Yamamoto T. , Watanabe R. , Ito I. , Senga T. , Hamaguchi M. , Wakabayashi T. , Kaneko M. K. , Kato Y. , Chandramohan V. , Bigner D. D. , Natsume A. (англ.) // Cancer immunology research. — 2016. — Vol. 4, no. 3 . — P. 259—268. — doi : . — .
- O’Rourke, D. M., Nasrallah, M. P., Desai, A. et al. (2017). от 24 июля 2017 на Wayback Machine . Science Translational Medicine, 9(399), eaaa0984. doi :
- Дата обращения: 25 июля 2017. 27 июля 2017 года.
- Posey Avery D. , Schwab Robert D. , Boesteanu Alina C. , Steentoft Catharina , Mandel Ulla , Engels Boris , Stone Jennifer D. , Madsen Thomas D. , Schreiber Karin , Haines Kathleen M. , Cogdill Alexandria P. , Chen Taylor J. , Song Decheng , Scholler John , Kranz David M. , Feldman Michael D. , Young Regina , Keith Brian , Schreiber Hans , Clausen Henrik , Johnson Laura A. , June Carl H. // Immunity. — 2016. — Июнь ( т. 44 , № 6 ). — С. 1444—1454 . — ISSN . — doi : .
- Golubovskaya V. , Wu L. (англ.) // Cancers. — 2016. — Vol. 8, no. 3 . — doi : . — .
- Sommermeyer D. , Hudecek M. , Kosasih P. L. , Gogishvili T. , Maloney D. G. , Turtle C. J. , Riddell S. R. (англ.) // Leukemia. — 2016. — Vol. 30, no. 2 . — P. 492—500. — doi : . — .
- Roybal K. T. , Rupp L. J. , Morsut L. , Walker W. J. , McNally K. A. , Park J. S. , Lim W. A. (англ.) // Cell. — 2016. — Vol. 164, no. 4 . — P. 770—779. — doi : . — .
- Джун К., Левин Б., Пози Э. от 10 июля 2023 на Wayback Machine // В мире науки. — 2017. — № 5—6. — С. 32—37.
- Juillerat A. , Marechal A. , Filhol J. M. , Valogne Y. , Valton J. , Duclert A. , Duchateau P. , Poirot L. (англ.) // Scientific reports. — 2017. — Vol. 7. — P. 39833. — doi : . — .
- Han X. , Bryson P. D. , Zhao Y. , Cinay G. E. , Li S. , Guo Y. , Siriwon N. , Wang P. (англ.) // Molecular therapy : the journal of the American Society of Gene Therapy. — 2017. — Vol. 25, no. 1 . — P. 274—284. — doi : . — .
- ↑ Zhao, Y., Chen, J., Andreatta, M., Feng, B., Xie, Y. Q., Wenes, M., ... & Tang, L. (2024). IL-10-expressing CAR T cells resist dysfunction and mediate durable clearance of solid tumors and metastases. Nature Biotechnology, 1-12. PMID doi :
- Ueda T., Shiina S., Iriguchi S. et al. (2022). Optimization of the proliferation and persistency of CAR T cells derived from human induced pluripotent stem cells. Nat. Biomed. Eng
- Mohiuddin M. M. , Singh A. K. , Corcoran P. C. , Thomas Iii M. L. , Clark T. , Lewis B. G. , Hoyt R. F. , Eckhaus M. , Pierson Iii R. N. , Belli A. J. , Wolf E. , Klymiuk N. , Phelps C. , Reimann K. A. , Ayares D. , Horvath K. A. (англ.) // Nature communications. — 2016. — Vol. 7. — P. 11138. — doi : . — .
- Trenado A. , Sudres M. , Tang Q. , Maury S. , Charlotte F. , Grégoire S. , Bonyhadi M. , Klatzmann D. , Salomon B. L. , Cohen J. L. (англ.) // Journal of immunology (Baltimore, Md. : 1950). — 2006. — Vol. 176, no. 2 . — P. 1266—1273. — .
- Putnam A. L. , Safinia N. , Medvec A. , Laszkowska M. , Wray M. , Mintz M. A. , Trotta E. , Szot G. L. , Liu W. , Lares A. , Lee K. , Laing A. , Lechler R. I. , Riley J. L. , Bluestone J. A. , Lombardi G. , Tang Q. (англ.) // American journal of transplantation : official journal of the American Society of Transplantation and the American Society of Transplant Surgeons. — 2013. — Vol. 13, no. 11 . — P. 3010—3020. — doi : . — .
- MacDonald K. G. , Hoeppli R. E. , Huang Q. , Gillies J. , Luciani D. S. , Orban P. C. , Broady R. , Levings M. K. (англ.) // The Journal of clinical investigation. — 2016. — Vol. 126, no. 4 . — P. 1413—1424. — doi : . — .
- Edinger M. (англ.) // The Journal of clinical investigation. — 2016. — Vol. 126, no. 4 . — P. 1248—1250. — doi : . — .
- от 26 апреля 2016 на Wayback Machine . ScienceDaily, April 2016
- Ellebrecht C. T. , Bhoj V. G. , Nace A. , Choi E. J. , Mao X. , Cho M. J. , Di Zenzo G. , Lanzavecchia A. , Seykora J. T. , Cotsarelis G. , Milone M. C. , Payne A. S. (англ.) // Science (New York, N.Y.). — 2016. — Vol. 353, no. 6295 . — P. 179—184. — doi : . — .
- Schmidt T. G. , Skerra A. (англ.) // Nature protocols. — 2007. — Vol. 2, no. 6 . — P. 1528—1535. — doi : . — .
- Liu L. , Sommermeyer D. , Cabanov A. , Kosasih P. , Hill T. , Riddell S. R. (англ.) // Nature biotechnology. — 2016. — Vol. 34, no. 4 . — P. 430—434. — doi : . — .
- Robertson M. J. , Mier J. W. , Logan T. , Atkins M. , Koon H. , Koch K. M. , Kathman S. , Pandite L. N. , Oei C. , Kirby L. C. , Jewell R. C. , Bell W. N. , Thurmond L. M. , Weisenbach J. , Roberts S. , Dar M. M. (англ.) // Clinical cancer research : an official journal of the American Association for Cancer Research. — 2006. — Vol. 12, no. 14 Pt 1 . — P. 4265—4273. — doi : . — .
- Hu Biliang , Ren Jiangtao , Luo Yanping , Keith Brian , Young Regina M. , Scholler John , Zhao Yangbing , June Carl H. . — 2017. — 26 февраля. — doi : .
- Hu B. , Ren J. , Luo Y. , Keith B. , Young R. M. , Scholler J. , Zhao Y. , June C. H. (англ.) // Cell reports. — 2017. — Vol. 20, no. 13 . — P. 3025—3033. — doi : . — .
- Ren J. , Liu X. , Fang C. , Jiang S. , June C. H. , Zhao Y. (англ.) // Clinical cancer research : an official journal of the American Association for Cancer Research. — 2017. — Vol. 23, no. 9 . — P. 2255—2266. — doi : . — .
- Ren J. , Zhang X. , Liu X. , Fang C. , Jiang S. , June C. H. , Zhao Y. (англ.) // Oncotarget. — 2017. — Vol. 8, no. 10 . — P. 17002—17011. — doi : . — .
- Rupp L. J. , Schumann K. , Roybal K. T. , Gate R. E. , Ye C. J. , Lim W. A. , Marson A. (англ.) // Scientific reports. — 2017. — Vol. 7, no. 1 . — P. 737. — doi : . — .
- Miller M. A. (англ.) // Science translational medicine. — 2017. — Vol. 9, no. 387 . — doi : . — .
- ↑ Smith T. T. , Stephan S. B. , Moffett H. F. , McKnight L. E. , Ji W. , Reiman D. , Bonagofski E. , Wohlfahrt M. E. , Pillai S. P. S. , Stephan M. T. (англ.) // Nature nanotechnology. — 2017. — doi : . — .
- . Дата обращения: 6 июля 2017. 11 июля 2017 года.
- Li Y., Hermanson D. L., Moriarity B. S., Kaufman D. S. (2018). от 15 сентября 2022 на Wayback Machine // Cell Stem Cell. doi :
- . Дата обращения: 13 июня 2017. 12 июня 2017 года.
- от 15 ноября 2017 на Wayback Machine // ScienceDaily, 13 November 2017
- Kojima R., Scheller L., Fussenegger M. (2017). от 1 декабря 2017 на Wayback Machine . Nature Chemical Biology, doi :
- от 15 ноября 2017 на Wayback Machine // GEN. Nov. 14, 2017
- Montel-Hagen A., Seet C. S., Li S. et al. (2019). Organoid-induced differentiation of conventional T cells from human pluripotent stem cells // Cell stem cell, 24(3), 376—389. doi : PMC
- . Дата обращения: 21 сентября 2019. 21 сентября 2019 года.
Литература
- Павлова А. А., Масчан М. А., Пономарёв В. Б. (2017). . Онкогематология; 12(1), 17—32. doi :
- Lu, J., & Jiang, G. (2022). . Molecular Cancer, 21(1), 1—15. PMID PMC doi :
- Catherine Offord (2017). . The Scientist
- Brudno, J. N., & Kochenderfer, J. N. (2017). Chimeric antigen receptor T-cell therapies for lymphoma. Nature Reviews Clinical Oncology. {{doi:10.1038/nrclinonc.2017.128}}
- Dai, H., Wang, Y., Lu, X., & Han, W. (2016). . Journal of the National Cancer Institute, 108(7), djv439. doi :
- Rodgers, D. T. et al. and Travis S. Young (2016). . Proc. Natl. Acad. Sci. USA 113, E459-E468, doi :
- Claire Maldarelli (2017). . Popular Science
- Ma, J. S. Y. et al. and Yu Cao (2016). . Proc. Natl. Acad. Sci. USA 113, E450—E458 doi :
- Roybal K. T. et al. & Wendell A. Lim (2016). . Cell 164, 770—779 DOI:
- Davila, E., & Tamada, K. (2016). . U.S. Patent № 9 233 125.
- ZeNan L. Chang, Yvonne Y. Chen (2017). . Trends in Molecular Medicine DOI:
- Ren, J., & Zhao, Y. (2017). . Protein & Cell, 1—10. doi :
- Li, H., & Zhao, Y. (2017). . Protein & Cell, 1—17. doi :
- Zhenguang WangYelei GuoWeidong Han (2017). . Protein & Cell, 1—30, doi :
- Eyquem J., Mansilla-Soto J., Giavridis T. et al. (2017). . Nature, 543(7643), 113—117. doi :
- Stoiber, S., Cadilha, B. L., Benmebarek, M. R., Lesch, S., Endres, S., & Kobold, S. (2019). . Cells, 8(5), 472.
- Dai, X., Park, J. J., Du, Y., Kim, H. R., Wang, G., Errami, Y., & Chen, S. (2019). . Nature methods, 16(3), 247—254. doi :
- Morris, E. C. (2018). . Blood, 131(3), 272—273.
- Stock S., Schmitt M., Sellner L. (2019). Optimizing Manufacturing Protocols of Chimeric Antigen Receptor T Cells for Improved Anticancer Immunotherapy. Int. J. Mol. Sci. 20, 6223
- Han J., Gao F., Geng S. et al. (2020). Minicircle DNA-Engineered CAR T Cells Suppressed Tumor Growth in Mice. Molecular cancer therapeutics, 19(1), 178—186. doi :
- Sutherland, A. R., Owens, M. N., & Geyer, C. R. (2020). Modular Chimeric Antigen Receptor Systems for Universal CAR T Cell Retargeting. International Journal of Molecular Sciences, 21(19), 7222. PMID doi :
- Iriguchi, S., Yasui, Y., Kawai, Y. et al. (2021). A clinically applicable and scalable method to regenerate T-cells from iPSCs for off-the-shelf T-cell immunotherapy. Nat Commun 12, 430
- Weber E. W., Parker K. R., Sotillo E. et al. (2021). Transient rest restores functionality in exhausted CAR-T cells through epigenetic remodeling. Science, 372(6537). PMID doi :
- Portillo A. L., Hogg R., Poznanski S. M. et al. (2021). Expanded human NK cells armed with CAR uncouple potent anti-tumor activity from off-tumor toxicity against solid tumors. iScience, 102619. doi :
- Wu Y., Liu Y., Huang Z. et al. (2021). Control of the activity of CAR-T cells within tumours via focused ultrasound. Nature Biomedical Engineering, 1—12. PMID doi :
- Miller I. C., Zamat A., Sun L. K. et al. (2021). Enhanced intratumoural activity of CAR T cells engineered to produce immunomodulators under photothermal control. Nature Biomedical Engineering, 1—12. PMID doi :
- Aoyama S., Yasuda S., Li H. et al. (2022). A novel chimeric antigen receptor (CAR) system using an exogenous protease, in which activation of T cells is controlled by expression patterns of cell‑surface proteins on target cells. International Journal of Molecular Medicine, 49(4), 42—53. PMID doi :
- Wang Z., McWilliams-Koeppen H. P., Reza H. et al. (2022). 3D-organoid culture supports differentiation of human CAR+ iPSCs into highly functional CAR T cells. Cell Stem Cell. 29(4), P515—527.E8 PMID doi :
- Ling, X., Chang, L., Chen, H., & Liu, T. (2022). Efficient generation of locus-specific human CAR-T cells with CRISPR/cCas12a. STAR protocols, 3(2), 101321. PMID PMC doi :
- Jing R., Scarfo I., Najia M. A. et al. (2022). . Cell Stem Cell, 29(8), 1181—1196. doi :
- M. Khang, S. Suryaprakash, M. Kotrappa, W. Mulyasasmita, S. Topp (2023). Manufacturing innovation to drive down cell therapy costs. Trends in Biotechnology doi :
- Wu J., Wu W., Zhou B., Li B. (2023). Chimeric antigen receptor therapy meets mRNA technology. Trends in Biotechnology. doi :
- Zhao, Y., Chen, J., Andreatta, M., Feng, B., Xie, Y. Q., Wenes, M., ... & Tang, L. (2024). IL-10-expressing CAR T cells resist dysfunction and mediate durable clearance of solid tumors and metastases. Nature Biotechnology, 1-12. PMID doi :
- 2021-11-07
- 1