Секвенирование древней ДНК
- 1 year ago
- 0
- 0
Нанопо́ровое секвени́рование — семейство высокоэффективных методов секвенирования ДНК или РНК третьего поколения . Метод основан на использовании белковых, твердотельных или иных пор диаметром в несколько нанометров , чувствительных к нуклеиновым кислотам.
Нанопоровое секвенирование позволяет избежать стадий ПЦР - амплификации и химического мечения образца ДНК или РНК . Это является существенным преимуществом по сравнению с другими методами секвенирования, которые используют хотя бы одну из этих стадий. Возможности метода включают относительно дешёвое генотипирование , высокую мобильность, быстрый анализ и отображение результатов в реальном времени. Было описано использование метода в быстром выявлении вирусных патогенов , отслеживании бактериальной резистентности , секвенировании генома человека и растений , гаплотипировании , отслеживании вируса эболы и других областях.
|
|
|
В 1989 году было продемонстрировано создание альфа-токсином, синтезируемым золотистым стафилококком , каналов ( нанопор ) в искусственной фосфолипидной мембране . В 1995 году впервые была предложена идея нанопорового секвенирования — определение свойств линейного полимера при его протаскивании через пору в мембране. При прохождении через пору полимер определённым образом с ней взаимодействует, что позволяет определить его свойства . Спустя год — в 1996 году — появилась первая работа, описывающая возможность применения нанопор (в качестве нанопоры был использован альфа-гемолизин ) для определения характеристик нуклеиновых кислот .
В 1999—2000 годах была показано, что, используя в качестве нанопоры альфа-гемолизин стафилококка , можно отличить одноцепочечную РНК от одноцепочечной ДНК .
В 2001 году впервые была проведена работа, в которой с помощью нанопор определяли наличие коротких последовательностей ДНК . Только к 2009 году удалось показать необходимую для создания методов секвенирования возможность различать нанопорами все основания в последовательности ДНК .
В 2012 году компанией были продемонстрированы первые нанопоровые секвенаторы : GridION и MinION .
Тогда же была показана принципиальная возможность применения данного метода — был секвенирован геном бактериофага phiX длиной 5,4 тысячи пар оснований (п. о.) .
В 2023 найден белок для нанопорового секвенирования белков .
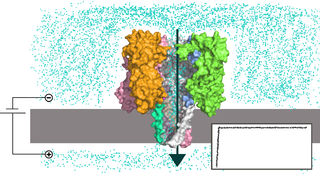
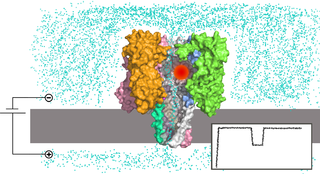
Нанопоровая система представляет собой реакционную камеру, разделённую на две части мембраной, содержащей отверстие нанометрового размера — нанопору. К частям камеры прикладывают напряжение , вследствие чего исследуемые молекулы проходят через пору по направлению действия электрического поля . При прохождении молекулы нуклеиновой кислоты через пору отдельные нуклеотиды влияют на тот или иной измеряемый параметр системы, что позволяет определить последовательность нуклеотидов . В практически используемом варианте нанопорового секвенирования камера заполнена электролитическим раствором, и измеряют силу тока ионов , протекающего через пору под действием поля; при прохождении нуклеотидов через пору они уменьшают сечение, доступное для ионов, и сила тока падает .
В зависимости от того, сохраняют ли секвенируемые молекулы нуклеиновых кислот свою химическую целостность, выделяют два варианта — секвенирование целых цепочек и экзонуклеазное секвенирование .
В данном методе цепи нуклеиновых кислот не расщепляются. Перенос целых молекул ДНК и РНК через пору может осуществляться следующими способами:
В данном методе цепь нуклеиновой кислоты нарезается на единичные нуклеотиды экзонуклеазой, расположенной в непосредственной близости от поры. Под действием поля отрицательно заряженные нуклеотиды самостоятельно попадают в пору, где происходит определение оснований .

Для секвенирования используют белковые нанопоры и синтетические твердотельные нанопоры .
Альфа-гемолизин Staphylococcus aureus — это водорастворимый мономер , который в мембране самопроизвольно образует гептамер . Трансмембранный домен состоит из ствола и головки поры. Головка поры содержит полость диаметром около 4,5 нм. В месте соединения ствола и головки находится сужение канала шириной 1,5 нм. Ствол поры состоит из 14 антипараллельных бета-тяжей , формирующих сквозной канал шириной около 2 нм. При нейтральном pH многие аминокислотные остатки в поре заряжены (например, положительно заряженный остаток лизина K147 и отрицательно заряженный остаток глутамата E111). В 1 М растворе KCl на поре держится потенциал в 120 мВ (от ствола к головке), что обуславливает ток 120 пА . Внутри ствола находится три сайта распознавания нуклеотидов, что в теории делает возможным распознавание одного нуклеотида более чем одним сайтом (что увеличивает точность прочтения) .
Порин A Mycobacterium smegmatis ( англ. Mycobacterium smegmatis porin A, MspA ) — нанопора диаметром 1,2 нм. Обладает структурными особенностями (формой и диаметром поры), которые улучшают соотношение сигнал/шум при секвенировании ДНК по сравнению с альфа-гемолизином . Однако у MspA есть и существенный недостаток: отрицательно заряженное ядро мешает продвижению одноцепочечной ДНК внутри поры. Поэтому для секвенирования в изначальном белке три отрицательно заряженных остатка аспартата были заменены на нейтральные остатки аспарагина .
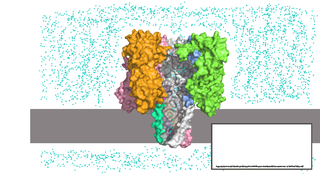
Моторный белок упаковки ДНК участвует в упаковке ДНК в капсид вирусов, а также в выходе ДНК из капсида при инфицировании. Ключевым отличием от вышеупомянутых белков является то, что имея больший диаметр канала (от 3,6 нм до 6 нм), он способен пропускать двухцепочечную ДНК. Из-за своей природы моторный белок phi29, в отличие от других пор, в своей исходной форме не встраивается в мембрану, однако эта проблема решается модификацией белка . Другие модификации позволяют белку пропускать одноцепочечную ДНК или одноцепочечную РНК .
Помимо белковых нанопор также используются твердотельные нанопоры небиологической природы. Для анализа нуклеиновых кислот используют нанопоры в подложках из кремния , нитрида кремния и . Обычно поры выжигаются пучками ионов или электронов, что позволяет легко варьировать их размер . Отдельно стоит выделить материалы, формирующие очень тонкие — «2D»-поры: графен , дисульфид молибдена и другие . Графен обладает и предельно маленькой толщиной, что способствует увеличению пространственного разрешения вдоль ДНК, и одновременно с этим прочностью, химической инертностью и электропроводимостью . Эти свойства способствуют применению данных материалом в нанопоровом секвенировании .
Являясь тонкой и ион-непроницаемая структурой, графен представляет собой хороший материал для секвенирования на основе нанопор. Так, было продемонстрировано, что нанопоры графена можно использовать в качестве электрода для измерения тока, протекающего через нанопоры между двумя камерами, содержащими ионные растворы .
В 2010 году был разработан метод твердотельного наносеквенирования, основанный на детекции флуоресцентного сигнала . Сначала нужная ДНК конвертируется в ДНК, в которой каждому изначальному основанию соответствует короткая последовательность. На эти короткие последовательности гибридизуются флуоресцентные зонды ( ), при этом конец одного зонда гасит флуоресценцию флуорофора на начале другого зонда. При этом для кодирования четырёх оснований нужно всего два типа зондов: каждому основанию (а точнее, соответствующей ему короткой последовательности) соответствует два флуоресцентных сигнала (00, 01, 10 или 11, где 0 соответствует одному цвету, а 1 — другому). При прохождении через пору получившаяся двухцепочечная ДНК расплетается, зонд отделяется, соответственно флуорофор на следующем зонде начинает светиться .
К преимуществам метода относится точность сигнала — камеры регистрирует сигнал гораздо точнее других имеющихся техник. Однако метод требует предварительной обработки образца: конвертации каждого нуклеотида в примерно 12 нуклеотидов (что также удлиняет саму ДНК) .
Твердотельные нанопоры лишены некоторых недостатков биологических нанопор: чувствительности к pH , температуре , концентрациям электролита , механическим воздействиям и т. д. Помимо этого, они стабильнее, дольше служат, получить разнообразие форм и размеров таких пор значительно проще, а технология производства сходна с производством полупроводников , что сильно облегчает процесс получения таких пор и делает потенциально возможным совмещение с другими наноустройствами. К преимуществам биологических нанопор можно отнести возможность химической или генетической модификации, химическую специфичность к ДНК или РНК и относительно низкую скорость прохождения ДНК или РНК сквозь пору .
Для получения нанопор может быть использована технология . Впервые такая возможность была продемонстрирована в 2012 году, когда с помощью ДНК-оригами была получена структура, похожая на альфа-гемолизин. Полученная структура самопроизвольно встраивалась в мембраны .
В 2010 году было показано, что однослойные углеродные нанотрубки также могут встраиваться в мембраны и пропускать ДНК .
На 2020 год твердотельные нанопоры не обладают химической специфичностью белков, поэтому активно изучается возможность интеграции белковых нанопор в твердотельных подложках .
Другим перспективным направлением является использование твердотельных нанопор с сенсорами (ёмкостными датчиками, туннельными электронными и другими детекторами) .
По сравнению с уже существовавшими методами секвенирования, применение такого метода секвенирования обладает преимуществами , такими как дешевизна и простота использования (за счёт отсутствия необходимости приготовления образца и использования реактивов), высокая чувствительность (вплоть до секвенирования без амплификации ДНК из крови и слюны ), высокая длина прочтений (вплоть до десятков тысяч оснований), высокая мобильность, быстрый анализ и отображение результатов в реальном времени .
К недостаткам можно отнести такие свойства, как низкое качество прочтений по сравнению с технологиями секвенирования с короткими прочтениями (однако данная ситуация меняется в лучшую сторону при появлении новых алгоритмов), потеря функциональных свойств биологических пор с течением времени (поры надёжно работают лишь в течение определённого количества прогонов) и влияние факторов среды на скорость прочтения последовательности и, следовательно, на его качество (моторный белок может работать только с достаточной скоростью в определенном диапазоне pH, при этом недостаточно быстро работая за пределами диапазона) .
В феврале 2012 года на конференции AGBT во Флориде компания Oxford Nanopore Technologies представила прототипы двух платформ для высокопроизводительного секвенирования длинных фрагментов, основанных на нанопоровом секвенировании целых цепочек: GridION и MinION. В качестве демонстрации был секвенирован геном бактериофага PhiX длиной 5386 п. о. На 2020 год компания выпускает несколько устройств. Все они позволяют анализировать данные в реальном времени
MinION — секвенатор небольшого размера с одноразовой ячейкой, спроектированный для использования в домашних или полевых условиях, с запланированной ценой около 900$. Секвенатор имеет разъём USB 3.0 для подключения к компьютеру. Содержит 512 нанопор со сходными характеристиками . Ячейка позволяет отсеквенировать до 30 миллионов п. о. ДНК (примерно за двое суток можно оцифровать 10—20 миллионов п. о. ДНК) . В 2019 году компания начала выпускать Flongle — адаптор к MinION или GridION, который позволяет работать с менее производительными (~1 Gb, 126 нанопор вместо 512), но существенно более дешёвыми ($90) ячейками .
GridION — устройство, спроектированное для полногеномного секвенирования (по сути своей — MinION с увеличенной производительностью). Прототип имел 2000 отдельных нанопор, каждая из которых способна получать прочтения длиной до 5100 п. о. со скоростью 150 миллионов п. о./ч в течение 6 часов . GridION Mk1 стоит $49,955 и содержит 5 независимых ячеек. С помощью него за один эксперимент можно отсеквенировать до 150 миллионов п. о. ДНК .
Самый высокопроизводительный секвенатор этой компании, позволяет секвенировать за один эксперимент несколько триллионов п. о. ДНК. PromethION 24 содержит 24 ячейки и способен за трое суток оцифровать 3,8 триллионов п. о. ДНК, PromethION 48 содержит 48 ячеек и способен за трое суток оцифровать 7,6 триллионов п. о. ДНК. Ячейки секвенатора содержат 3000 нанопор . Поток данных с такого количества нанопор не может анализироваться обычным компьютером, поэтому для использования этого секвенатора необходим суперкомпьютер (впрочем, если запускать только одну ячейку, то справится и обычный компьютер) .
Компания планирует выпустить ещё два устройства: SmidgION — секвенатор, который подключается к смартфону, и Plongle — секвенатор, который содержит 96 независимых, но малопроизводительных ячеек, и, соответственно, рассчитан на частые секвенирования большого объёма коротких ДНК .
После использования продукции Oxford Nanopore на выходе имеются сырые данные формата FAST5. Формат FAST5, используемый Oxford Nanopore, — это вариант стандарта HDF5 с иерархической внутренней структурой, предназначенной для хранения метаданных , связанных с последовательностью ДНК и событий (агрегированные измерения общего тока), предварительно обработанных рабочим устройством. Результаты обработки отображаются в реальном времени в графическом интерфейсе MinKNOW, а данные записываются в формате файлов FASTQ или .fast5 . Далее нужно произвести распознавание нуклеотидов ( англ. base calling ). Этот процесс обработает сырые данные формата FAST5 в формат FASTQ (в программе MinKNOW этот процесс можно запустить во время прочтения ридов). Также можно использовать такие программы, как poreTools , Guppy .
Далее нужно очистить полученные последовательности, чтобы избавиться от данных со слишком большим шумом. Для этой задачи используется, например, программа NanoFilt . Как только данные будут очищены, полученные данные дальше можно использовать для последующей сборки и анализа данных .
Программа ( )