Никотинамидадениндинуклеотид
- 1 year ago
- 0
- 0
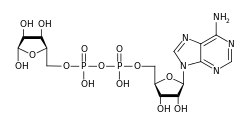
АДФ-рибозили́рование ( англ. ADP-ribosylation ) — химическая реакция присоединения одного или нескольких остатков АДФ-рибозы к белку . Это обратимая посттрансляционная модификация , которая играет важную роль во многих клеточных процессах, таких как передача сигнала , репарация ДНК , регуляция экспрессии генов и апоптоз . Неправильное АДФ-рибозилирование наблюдается при некоторых формах рака . Многие бактериальные токсины , такие как холерный токсин и , влияют на АДФ-рибозилирование .
Первые предположения о существовании такой посттрансляционной модификации белков, как АДФ-рибозилирование, появились в 1960-х. В это время Пьер Шамбон и сотрудники обнаружили, что АТФ поглощается экстрактом ядер курицы . Последующие исследования показали, что в реакцию вступала АДФ-рибоза — производное NAD + . Через несколько лет был идентифицирован фермент , который присоединяет АДФ-рибозу к белкам, его назвали поли(АДФ-рибоза)полимеразой . Поначалу думали, что поли-(АДФ-рибоза) представляет собой линейную цепочку из остатков АДФ-рибозы, соединённых гликозидными связями . Позднее было показано, что через каждые 20—30 остатков цепь может ветвиться .
Моно-АДФ-рибозилирование было описано несколько лет спустя, когда было обнаружено, что для того, чтобы дифтерийный токсин был активен, необходим NAD + . Токсин активируется при присоединении к нему одного остатка АДФ-рибозы ферментом моно-АДФ-рибозилтрансферазой. Первоначально считалось, что поли-АДФ-рибозилирование участвует только в регуляции экспрессии генов. Однако по мере того как находили новые ферменты, осуществляющие АДФ-рибозилирование, становилось очевидным разностороннее функциональное значение этой модификации. Хотя первый известный фермент млекопитающих , способный осуществлять поли-АДФ-рибозилирование, был открыт в конце 1980-х, следующие белки млекопитающих с такой активностью были описаны лишь спустя 15 лет . В конце 1980-х также были открыты ферменты АДФ-рибозилциклазы, которые катализируют присоединение к белкам циклической АДФ-рибозы. Оказалось, что белки семейства сиртуинов , которые могут катализировать NAD + -зависимое де , обладают также моно-АДФ-рибозилтрансферазной активностью .
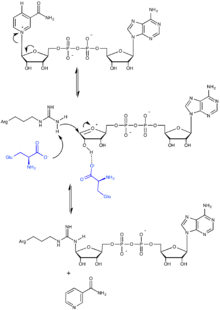
Как правило, источником остатков АДФ-рибозы служит NAD + . В этой реакции переноса N-гликозидная связь в NAD + , которая связывает АДФ-рибозу с никотинамидной группой, разрывается, после чего боковая группа модифицируемой аминокислоты осуществляет нуклеофильную атаку. АДФ-рибозилтрансферазы катализируют реакции двух видов: моно-АДФ-рибозилирование и поли-АДФ-рибозилирование.
Моно-АДФ-рибозилтрансферазы чаще всего катализируют присоединение одного остатка АДФ-рибозы к боковой цепи аргинина при помощи особого мотива (R-S-EXE). Сначала разрывается связь между АДФ-рибозой и никотинамидом с формированием . Затем боковая цепь аргинина модифицируемого белка выступает в роли нуклеофила и атакует электрофильный атом углерода рядом с ионом оксония. Перед нуклеофильной атакой аргинин остатком глутамата фермента. Другой консервативный остаток глутамата формирует водородную связь с одной из гидроксильных групп рибозы , что облегчает протекание нуклеофильной атаки. В результате разрыва связь никотинамид высвобождается. Модификацию могут убрать ферменты АДФ-рибозилгидролазы, которые разрывают N-гликозидную связь между аргинином и рибозой с высвобождением АДФ-рибозы и немодифицированного белка. Однако в обратной реакции NAD + не образуется .
Поли(АДФ-рибозо)полимеразы ( англ. Poly-(ADP-ribose) polymerases, PARP ) встречаются преимущественно у эукариот и катализируют присоединение нескольких остатков АДФ-рибозы к белку. Как и при моно-АДФ-рибозилировании, источником АДФ-рибозы служит NAD + . PARP используют каталитическую триаду His - Tyr -Glu для усиления связывания с NAD + и присоединения собранной цепочки поли-АДФ-рибозы к белку. Остаток глутамата облегчает формирование О-гликозидной связи между двумя остатками рибозы . Существует несколько других ферментов, которые распознают цепочки поли-АДФ-рибозы, гидролизуют их или формируют разветвления. Мотивы, которые с той или иной силой могут связываться с поли-АДФ-рибозой, найдены у более чем 800 белков. Поэтому поли-АДФ-рибозилирование не только меняет структуру и конформацию белка, но может также привлекать к нему другие белки .
В качестве акцепторов АДФ-рибозной группы могут выступать боковые цепи многих аминокислот. С химической точки зрения, поли-АДФ-рибозилирование представляет собой гликозилирование : нуклеофильную атаку, необходимую для формирования связи с рибозой в составе АДФ-рибозы, могут осуществлять атомы кислорода , азота или серы боковых цепей аминокислот . Первоначально считалось, что мишенями АДФ-гликозилирования выступают остатки глутамата и аспартата . Однако впоследствии было показано, что АДФ-рибозилированию могут подвергаться также остатки серина , аргинина , цистеина , лизина , дифтамида , и аспарагина .
PARP активируются при повреждении ДНК или клеточном стрессе, из-за чего увеличивается количество поли-АДФ-рибозы и снижается количество NAD + . Более 10 лет считалось, что единственной поли-АДФ-полимеразой в клетках млекопитающих является , поэтому из всех поли-АДФ-полимераз этот фермент изучен наиболее хорошо. При апоптозе активированные каспазы разрезают PARP1 на два фрагмента, полностью инактивируя фермент и ограничивая тем самым образование поли-АДФ-рибозы. Один из образовавшихся фрагментов перемещается из ядра в цитоплазму и, как принято считать, становится аутоантигеном . При другой форме программируемой клеточной гибели , , происходит накопление поли-АДФ-рибозы, вызванное активацией PARP или инактивацией — фермента, который гидролизует поли-АДФ-рибозу с образованием свободной АДФ-рибозы. При апоптозе поли-АДФ-рибоза вызывает перемещение в ядро белков, которые запускают . Гиперактивация PARP приводит к некротической гибели клетки, регулируемой фактором некроза опухоли . По пока не ясному механизму влияют на некроптоз .
АДФ-рибозилирование может оказывать влияние на экспрессию генов почти на каждом этапе, в том числе через организацию хроматина , связывание факторов транскрипции и процессинг мРНК . PARP1 может влиять на структуру хроматина за счёт внесения посттрансляционных модификаций на хвосты гистонов . PARP могут также влиять на структуру факторов транскрипции и их взаимодействия между собой и с промоторами . Например, моно-АДФ-рибозилтрансфераза PARP14 влияет на связывание с промотором транскрипционного фактора . Другие АДФ-рибозилтрансферазы модифицируют белки, взаимодействующие с мРНК, что может привести к сайленсингу соответствующих генов .
PARP могут принимать участие в репарации одно- и двуцепочечных разрывов в ДНК. Например, PARP1 связывается с ДНК в месте одноцепочечного разрыва и начинает синтезировать поли-АДФ-рибозу, с которой взаимодействует белок . Он привлекает к месту разрыва другие белки, участвующие в репарации: , которая обрабатывает концы ДНК при эксцизионной репарации оснований , и апратаксин , который участвует в репарации одноцепочечных разрывов и негомологичном соединении концов .
PARP1 задействована и в репарации двуцепочечных разрывов, например, в негомологичном соединении концов. Также, вероятно, она замедляет движение репликативной вилки после повреждения ДНК и способствует гомологичной рекомбинации . Возможно, PARP1 участвует в репарации двуцепочечных разрывов вместе с . Существует две гипотезы о характере их совместного действия. Во-первых, они могут функционально заменять друг друга при утрате второй поли-АДФ-рибозилтрансферазы. Согласно другой гипотезе, PARP3 осуществляет моно-АДФ-рибозилирование или синтезирует короткие цепочки из остатков поли-АДФ-рибозы, а также активирует PARP1, которая достраивает их до протяжённых цепей .
Главным молекулярным механизмом внутриклеточного разрушения дефектных белков является убиквитин - протеасомная система. АДФ-рибозилтрасфераза (TNKS) взаимодействует с регулятором протеасом . Как было показано на клетках дрозофилы и человека , анкириновый домен TNKS облегчает взаимодействие с N-концевым связывающим мотивом и C-концевым доменом HbYX белка PI31. Это взаимодействие способствует АДФ-рибозилированию PI31 PARP- доменом танкиразы. Кроме того, обработка клеток дрозофилы ингибитором TNKS, известным как XAV939, нарушает работу 26S- субъединицы протеасомы. Более того, поли-АДФ-рибозилированный PI31 не может больше ингибировать активность α-субъединиц 20S-субъединицы протеасомы. Таким образом, поли-АДФ-рибозилирование PI31, опосредуемое танкиразой, оказывает влияние на работу протеасомы .
Как обсуждалось выше, PARP1 принимает участие в репарации одно- и двуцепочечных разрывов ДНК, а также регулируют апоптоз. По этой причине клетки с пониженной активностью PARP1 имеют предрасположенность к злокачественному перерождению. Многие другие PARP также препятствуют образованию раковых клеток. участвует в репарации ДНК, PARP3 регулирует удвоение центросом , а танкираза задействована в регуляции длины теломер . При этом полное ингибирование PARP является одним из используемых в настоящее время подходов в лечении рака , поскольку клетки, лишённые хотя бы одной из PARP, быстро погибают. Например, ингибирование PARP1 в раковых клетках вызывает их гибель из-за многочисленных повреждений ДНК. PARP14, вероятно, связана со степенью агрессивности .
Бактериальные АДФ-рибозилирующие экзотоксины осуществляют ковалентное присоединение остатка АДФ-рибозы с NAD + на белок заражённого эукариотического организма. Например, холерный токсин и один из АДФ-рибозилируют α-субъединицу гетеротримерных G-белков . В АДФ-рибозилированном состоянии α-субъединица постоянно активна и связана с ГТФ , поэтому в клетке происходит постоянный синтез цАМФ , что стимулирует выход воды и ионов из клеток . Clostridium botulinum АДФ-рибозилирует ГТФ-связывающие белки Rho и Ras , также осуществляет АДФ-рибозилирование G-белков . При дифтерии АДФ-рибозилируется фактор элонгации трансляции EF-2 , что мешает синтезу белка . Кроме перечисленных бактерий, АДФ-рибозилирующие токсины выделяют клетки Pseudomonas aeruginosa ( ) .