Экономика метанола
- 1 year ago
- 0
- 0
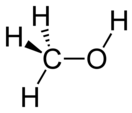
Метано́л (метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила, CH 3 OH) — органическое вещество , простейший представитель гомологического ряда одноатомных спиртов , бесцветная жидкость с запахом этилового спирта . Опасный для человека яд , контаминант .
Метанол смешивается в любых соотношениях с водой и с большинством органических растворителей .
Смеси метанола с воздухом в объёмных концентрациях 6,98–35,5 % метанола взрывоопасны, температура вспышки — 8 °C .
Метанол был впервые обнаружен [ как? ] Бойлем в 1661 году в продуктах сухой перегонки древесины . Через два столетия, в 1834 году, его выделили в чистом виде Ж. Б. Дюма и Э. М. Пелиго . Тогда же была установлена химическая формула метанола. В 1857 году Бертло получил метанол омылением метилхлорида.
|
|
В разделе
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
|
Предположительно, эта страница или раздел нарушает
авторские права
.
|
Метанол — бесцветная жидкость с резковатым запахом этилового спирта . Температура кипения +64,7 °C.
Удельный вес при 0°/0° = 0,8142 ( Копп ); при 15°/15° = 0,79726; при 25°/25° = 0,78941 (Перкин); при 64,8°/4° = 0,7476 (Шифф); при 0°/4° = 0,81015; при 15,56°/4° = 0,79589 (Диттмар и Фоусет). Капиллярная постоянная при температуре кипения a² = 5,107 (Шифф); Критическая температура 241,9° (Шмидт). Упругость паров при 15° = 72,4 мм; при 29,3° = 153,4 мм; при 43° = 292,4 мм; при 53° = 470,3 мм; при 65,4° = 756,6 мм (Д. Коновалов). Теплота горения равна 170,6, теплота образования 61,4 (Штоман, Клебер и Лангбейн).
Метанол смешивается во всех отношениях с водой, этиловым спиртом и эфиром; при смешении с водой происходит сжатие и разогревание. Горит синеватым пламенем. Подобно этиловому спирту — сильный растворитель, вследствие чего во многих случаях может заменять этиловый спирт . Безводный метанол, растворяя небольшое количество медного купороса, приобретает голубовато-зелёное окрашивание, поэтому безводным медным купоросом нельзя пользоваться для открытия следов воды в метаноле; но он не растворяет CuSO 4 ∙5H 2 O (Клепль).
Метанол (в отличие от этанола) с водой не образует азеотропной смеси, в результате чего смеси вода-метанол могут быть разделены ректификационной перегонкой.
| Молярная доля метанола % | Температура кипения при 760 мм рт. ст., °C |
|---|---|
| 0 | 100 |
| 5 | 92,8 |
| 10 | 88,3 |
| 15 | 84,8 |
| 20 | 82 |
| 25 | 80,1 |
| 30 | 78,2 |
| 35 | 76,8 |
| 40 | 75,6 |
| 45 | 74,5 |
| 50 | 73,5 |
| 55 | 72,4 |
| 60 | 71,6 |
| 65 | 70,7 |
| 70 | 69,8 |
| 75 | 68,9 |
| 80 | 68 |
| 85 | 67,1 |
| 90 | 66,3 |
| 95 | 65,4 |
| 100 | 64,6 |
|
|
В разделе
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
|
Предположительно, эта страница или раздел нарушает
авторские права
.
|
Метанол даёт со многими солями соединения, подобные кристаллогидратам ( сольваты ), например: CuSO 4 ∙ 2СН 3 ОН; LiCl ∙ 3СН 3 ОН; MgCl 2 ∙ 6СН 3 ОН; CaCl 2 ∙ 4СН 3 ОН представляет собой шестисторонние кристаллы, разлагаемые водой, но не разрушаемые нагреванием до 100° (Kane). Соединение ВаО ∙ 2СН 3 ОН ∙ 2Н 2 O получается в виде блестящих призм при растворении ВаО в водном метаноле и испарении на холоде полученной жидкости при комнатной температуре (Форкранд).
С едкими щелочами метанол образует соединения 5NaOH ∙ 6СН 3 ОН; 3KOH ∙ 5СН 3 OH (Геттиг). При действии металлических калия и натрия легко даёт алкоголяты , присоединяющие к себе кристаллизационный метанол и иногда воду.
При пропускании паров метанола через докрасна накалённую трубку получается C 2 H 2 и другие продукты ( Бертло ). При пропускании паров метанола над накалённым цинком получается окись углерода , водород и небольшие количества болотного газа (Jahn). Медленное окисление паров метанола при помощи раскалённой платиновой или медной проволоки представляет лучшее средство для получения больших количеств формальдегида: 2СН 3 ОН+О 2 =2НСНО+2Н 2 О. При действии хлористого цинка и высокой температуры метанол даёт воду и алканы, а также небольшие количества гексаметилбензола (Лебедь и Грин). Метанол, нагретый с нашатырём в запаянной трубке до 300°, даёт моно-, ди- и триметиламины (Бертло).
При пропускании паров метанола над KOH при высокой температуре выделяется водород и образуются последовательно формиат, ацетат и, наконец, карбонат калия.
Концентрированная серная кислота даёт метилсерную кислоту CH 3 HSO 4 , которая при дальнейшем нагревании с метанолом даёт метиловый эфир . При перегонке метанола с избытком серной кислоты в отгон переходит диметилсерная кислота (CH 3 ) 2 SO 4 . При действии серного ангидрида SO 3 получается CH(OH)(SO 3 H) 2 и CH 2 (SO 3 H) 2 (см. Метилен ).
Метанол при действии соляной кислоты , пятихлористого фосфора и хлористой серы даёт хлорметан СН 3 Cl. Действием HBr и H 2 SO 4 получают бромистый метил. Подкисленный 5%-й серной кислотой и подвергнутый электролизу, метанол даёт СО 2 , СО, муравьинометиловый эфир, метилсерную кислоту и метилаль СН 2 (ОСН 3 ) 2 (Ренар). При нагревании метанола с хлористо-водородными солями ароматических оснований (анилином, ксилидином, пиперидином) легко происходит замещение водорода в бензольном ядре метилом (Гофман, Ладенбург); реакция имеет большое техническое значение при приготовлении метилрозанилина и других искусственных пигментов.

Метиловый спирт — опасный яд. Действует преимущественно на нервную и сердечно-сосудистую систему, обладает выраженной способностью к кумуляции . LD50 для животных — от единиц до десятка г/кг . У человека приём внутрь 5—10 мл метанола и более может приводить к тяжёлому отравлению , 30 мл могут вызвать смертельный исход , попадание в организм более 80—150 миллилитров метанола (1—2 миллилитра чистого метанола на килограмм тела ) обычно смертельно . Токсический эффект метанола развивается на протяжении нескольких часов, и эффективные антидоты способны уменьшить наносимый вред .
Хотя наиболее опасен приём метанола внутрь, отравление возможно также при вдыхании его паров и при контакте метанола с неповреждённой кожей, в частности, при сильном загрязнении метанолом одежды. Характерным проявлением острого отравления метанолом является ухудшение зрения вплоть до слепоты . Хронические отравления поражают сосуды головного мозга и глаз, что приводит к дегенеративным изменениям этих органов и также сопровождается ухудшением зрения, в первую очередь цветного. Отравления метанолом приводят к дистрофическим изменениям клеток печени и как следствие — к функциональной недостаточности печени, сохраняющейся после клинического выздоровления .
В США максимальное допустимое суточное употребление метанола ( ), подразумевая несвязанное с какими-либо эффектами на здоровье, установлено в размере 2 мг на кг веса тела (с 1988 года) .
Предельно допустимая концентрация метанола в воздухе рабочей зоны равна 5 мг/м³ (рекомендуемая). Для сравнения, у изопропилового спирта : 10 мг/м³ , у этанола — 1000 мг/м³), ПДК в воздухе населённых мест равна 1,0 мг/м³ (у изопропилового спирта 0,6 мг/м³, у этанола — 5 мг/м³ . При этом порог восприятия запаха этого вещества у отдельных лиц может достигать 7800 мг/м³ .
Наиболее лёгкая форма отравления характеризуется наличием головной боли, общей слабостью, недомоганием, ознобом, тошнотой, рвотой, умеренными расстройствами зрения вплоть до временной слепоты. [ источник не указан 362 дня ]
Токсичность метанола состоит в том, что при попадании в организм он с течением времени окисляется до ядовитого формальдегида , который вызывает слепоту, вредно влияет на нервную систему, вступает в реакции с белками. Происходит так называемый летальный синтез . [ источник не указан 362 дня ]
Особая опасность метанола связана с тем, что по запаху и вкусу он неотличим от этилового спирта, из-за чего и происходят случаи его употребления внутрь. [ источник не указан 362 дня ]
При отравлении метанолом антидотом является этанол , который вводится внутривенно в форме 10 % раствора капельно или 30—40 % раствора перорально из расчёта 1—2 грамма раствора на 1 кг веса в сутки . Полезный эффект в этом случае обеспечивается отвлечением фермента АДГ I на окисление экзогенного этанола и, как следствие, снижением скорости окисления метанола до формальдегида . Однако при недостаточно точном диагнозе за отравление метанолом можно принять алкогольную интоксикацию, отравление 1,2-дихлорэтаном или четырёххлористым углеродом — в этом случае введение этилового спирта опасно .
Также антидотом метанола может выступать 4-метилпиразол , вводимый внутривенно. [ источник не указан 362 дня ]
Отравления метанолом довольно часты. Так, в США в течение 2013 года зафиксировано 1747 случаев .

|
|
Список примеров в этой статье
не основывается на
авторитетных источниках
, посвящённых непосредственно предмету статьи.
|
Известно множество массовых отравлений метанолом. Источником метанола могут быть фальсифицированные
незамерзающие жидкости
для автомобилей; контрафактный алкоголь; метанол, выдаваемый за этиловый спирт
[
источник не указан 362 дня
]
, вот лишь часть примеров:
С помощью денатурации возможно сделать метанол непригодным для питья. Применение горького вещества битрекс в метаноле применяется в некоторых штатах США. Предложения по денатурации метанола в Российской Федерации в 2006 году, 2017 году, в августе 2021 года не были законодательно приняты . После массового отравления в России в 2023 году рассматриваются механизмы государственного регулирования оборота метилового спирта .
В свободном состоянии метиловый спирт встречается в природе лишь изредка и в очень небольших количествах (например в эфирных маслах), но производные его распространены довольно широко . Так, например, многие растительные масла содержат сложные эфиры метилового спирта: масла гаултерии — метиловый эфир салициловой кислоты С 6 H 4 (OH)COOCH 3 , масло жасмина — метиловый эфир антраниловой кислоты С 6 H 4 (NH 2 )COOCH 3 . Простые эфиры метилового спирта чрезвычайно часто встречаются среди природных веществ, например среди природных красителей, алкалоидов и тому подобных. [ источник не указан 362 дня ]
В небольших количествах метанол вырабатывается в организме человека. Обнаружено 2 источника :
В промышленности метиловый спирт раньше получали исключительно путём сухой перегонки дерева. В жидких погонах, так называемом «древесном уксусе», наряду с уксусной кислотой (10 %), ацетоном (до 0,5 %), ацетальдегидом , аллиловым спиртом , метилацетатом , аммиаком и аминами содержится также 1,5—3 % метилового спирта. Для отделения уксусной кислоты продукты сухой перегонки пропускают через горячий раствор известкового молока , задерживающий её в виде уксуснокислого кальция . Значительно труднее отделить метиловый спирт от ацетона, так как температуры кипения их очень близки (ацетон, т.кип. 56,5°; метиловый спирт, т.кип. 64,7°). Все же путём тщательной ректификации на соответствующих колоннах в технике удаётся почти полностью отделить метиловый спирт от сопутствующего ему ацетона. Неочищенный метиловый спирт называется также «древесным спиртом». [ источник не указан 362 дня ]
В космическом пространстве метанола немного, зато в его скоплениях возникает эффект мазера , что позволило астрономам провести прямые измерения фундаментальных постоянных Вселенной .
Известно несколько способов получения метанола: сухая перегонка древесины и лигнина , термическое разложение солей муравьиной кислоты , синтез из метана через метилхлорид с последующим омылением , метана и получение из синтез-газа .
Первоначально в промышленности был освоен метод получения метанола сухой перегонкой древесины, но впоследствии он потерял своё промышленное значение. Современное производство метанола из монооксида углерода и водорода впервые было осуществлено в Германии компанией BASF в 1923 году. Процесс проводился под давлением 10—35 МПа на цинк-хромовом катализаторе (ZnO/Cr 2 O 3 ) при температуре 320—450 °C .
С тех пор технологические схемы производства метанола совершенствовались, но их основой до настоящего времени остается каталитический синтез метанола из природного газа .
Современный промышленный метод получения — синтез из оксида углерода(II) и водорода на медь-цинковом оксидном катализаторе при следующих условиях: [ источник не указан 362 дня ]
Схема механизма каталитического получения метанола сложна и суммарно может быть представлена в виде реакции:
Синтезы на основе оксида углерода и водорода :
| Процесс | Катализатор | Носитель катализатора | Температура, °С | Давление, МПа | Продукт |
|---|---|---|---|---|---|
| Синтез метана | Ni | ThO 2 или MgO | 250—500 | 0,1 | Метан |
| Синтез метанола | ZnO, Cr 2 O 3 , CuO | — | 200—400 | 5—30 | Метанол |
| Синтез высших спиртов | Fe, Fe-Cr, Zn-Cr | Al 2 O 3 , NaOH |
180—220,
380—490 |
1—3, 15—25 | Метанол и |
Компания BASF разработала способ получения изобутилового спирта , основанный на каталитическом гидрировании монооксида углерода и приводящий к образованию смеси, содержащей 50 % метанола и 11—14 % 2-метилпропанола-1, а также другие продукты. BASF прекратила производить изобутиловый спирт этим методом после разработки и нефтехимического пути синтеза изобутанола .
Производство метанола: [ источник не указан 362 дня ]
| Год | США | Германия | Мир , тыс. т | Цена продажи, $ /т |
|---|---|---|---|---|
| 1928 | 24 | 18 | 140 | 84,7 |
| 1936 | 97 | 93 | 305 | 88,9 |
| 1950 | 360 | 120 | 349 | 83,1 |
| 1960 | 892 | 297 | 3930 | 99,7 |
| 1970 | 2238 | нет данных | 5000 | 89,7 |
| 1980 | 3176 | 870 | 15000 | 236,1 |
| 2004 | 3700 | 2000 | 32000 | 270 |
Больше всего в мире метанола производится и потребляется в КНР , в 2017 году эта страна обеспечила более половины мирового потребления метанола. Крупнейшей компанией по производству метанола является канадская Methanex Corporation , имеющая 11 заводов, которые расположены в 6 странах: Канаде, Чили , Египте , Новой Зеландии , США и Тринидаде и Тобаго . Крупные заводы по производству метанола также имеются в Саудовской Аравии , в Брунее , Малайзии .
Существуют три основных направления использования метанола:
Также развивается новая технология MtO (Methanol to olefins), позволяющая получать олефины (в первую очередь этилен и пропилен ) напрямую из метанола .
В нефтеперерабатывающей промышленности метанол используется как растворитель для очистки бензина от меркаптанов , а также для выделения толуола . В нефтехимии метанол используют для производства изопрена и метилтретбутилового эфира . Метанол используется также в газовой промышленности для борьбы с образованием гидратов (из-за низкой температуры застывания и хорошей растворимости) .
Кроме этого метанол используется для производства муравьиной кислоты , уротропина , диметилтерефталата , ядохимикатов, химических средств защиты растений, для синтеза протеина (белково-витаминного концентрата) .
В России ограничено использование метилового спирта в средствах по уходу за автотранспортом, а также продажа населению указанных средств, содержащих метанол .
Отдельным направлением является использование метанола для переэтерификации жиров в производстве биодизеля .
Метанол в бензин, ( сокращённо MTG) , — это химический процесс производства бензина из метанола.
Процесс полезен для производства бензина из природного газа или угля вместо нефти . Процесс был разработан в 1970-х годах компанией Mobil (сейчас ExxonMobil ) . Уголь или природный газ сначала превращается в синтез-газ , а затем в метанол. Затем метанол дегидратируют до диметилового эфира (ДМЭ). Затем диметиловый эфир дополнительно дегидратируют на катализаторе. Химическая реакция протекает следующим образом:
Степень превращения метанола в углеводороды с пятью или более атомами углерода составляет 80 % . Катализатором обычно является цеолит , например ZSM-5 . ZSM-5 теряет свою активность из-за накопления углерода. Затем катализатор необходимо регенерировать путём выжигания углерода при 500 ° С. Количество возможных регенераций ограничено, и в конечном итоге катализатор необходимо заменить.
Из 1000 тонн метанола в процессе будет получено 387 тонн бензина, 46 тонн сжиженного нефтяного газа, 7 тонн топливного газа и 560 тонн воды, которая рециркулируeтся в качестве технической воды.
, то есть превращение органического соединения в свой гомолог путём внедрения одной или нескольких метиленовых групп, для спиртов была впервые осуществлена в 1940 году — на основе метанола каталитическим путём под воздействием высокого давления был синтезирован этанол :
Реакция гомологизации по своему механизму близка реакции гидроформилирования алкенов, с помощью модифицированных катализаторов кобальта и рутения и добавления йодид-ионов в качестве промоторов в реакции удаётся добиться выхода этанола 90 % .
Исходный метанол также получают из окиси углерода на катализаторе на основе оксидов меди и цинка при давлении 5—10 МПа и температуре 250 °C .
Общая схема выглядит следующим образом:
Побочными продуктами реакции в случае синтеза этанола будут ацетальдегид , этилен и диэтиловый эфир .
В 1940 году впервые была осуществлена катализируемая оксидом кобальта при давлении 600 атм реакция метанола с синтез-газом с образованием в качестве основного продукта этанола… Впоследствии эта реакция, названная гомологизацией, вызвала огромный интерес у химиков. Её привлекательность связана с возможностью получения этилена из угольного сырья Применение в качестве катализаторов карбонила кобальта Со2(СО)8 позволило понизить давление до 250 атм, при этом степень превращения метанола составила 70 %, а основной продукт — этанол образовывался с селективностью 40 %. В дальнейшем были предложены более селективные катализаторы на основе соединений кобальта и рутения с добавками фосфиновых лигандов и было установлено, что реакцию можно ускорить с помощью введения промоторов — иодид-ионов. В настоящее время удалось достичь селективности по этанолу 90 %. Хотя механизм гомологизации до конца не установлен, можно считать, что он близок к механизму карбонилирования метанола.
—
Промышленное разведение морского фитопланктона рассматривалось на рубеже 1980-х как одно из наиболее перспективных направлений в области получения биотоплива .
|
|
В разделе
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
В начале 80-х рядом европейских стран совместно разрабатывался проект, ориентированный на создание промышленных систем с использованием прибрежных пустынных районов. Осуществлению этого проекта помешало общемировое снижение цен на нефть .
Первичное производство биомассы осуществляется путём культивирования фитопланктона в искусственных водоёмах, создаваемых на морском побережье.
Вторичные процессы представляют собой метановое брожение биомассы и последующее метана с получением метанола.
Основными доводами в пользу использования микроскопических водорослей являются следующие:
С точки зрения получения энергии данная биосистема имеет существенные экономические преимущества по сравнению с другими способами преобразования солнечной энергии .
|
|
В разделе
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
Получаемый из газа метанол стоит намного дешевле мазута, бензина или керосина, при этом такое топливо наносит гораздо меньше вреда окружающей среде. Особенно перспективным является использование метанола как судового топлива. Суда с метанольными двигателями ввели в эксплуатацию [ когда? ] сразу несколько крупнейших судоходных компаний мира .
Объёмная и массовая энергоёмкость (теплота сгорания) метанола ( удельная теплота сгорания = 22,7 МДж/кг) на 40—50 % меньше, чем бензина , однако при этом теплопроизводительность спиртовоздушных и бензиновых топливовоздушных смесей при их сгорании в двигателе различается незначительно по той причине, что высокое значение теплоты испарения метанола способствует улучшению наполнения цилиндров двигателя и снижению его теплонапряжённости, что приводит к повышению полноты сгорания спиртовоздушной смеси. В результате этого мощность двигателя повышается на 7—9 %, а крутящий момент на 10—15 %. Двигатели гоночных автомобилей , работающих на метаноле с более высоким октановым числом , чем бензин, имеют степень сжатия , превышающую 15:1 , в то время как в обычном ДВС с искровым зажиганием степень сжатия для неэтилированного бензина как правило, не превышает 11,5:1.
Метанол может использоваться как в классических ДВС, так и в специальных топливных элементах для получения электричества.
При работе классического ДВС на метаноле происходит увеличение индикаторного КПД по сравнению с его работой на бензине. Такой прирост вызван снижением тепловых потерь и может достигать единиц процентов.
| Топливо | Плотность энергии | Смесь воздуха с топливом | Удельная энергия смеси воздуха с топливом | Удельная теплота испарения | Октановое число (RON) | Октановое число (MON) |
|---|---|---|---|---|---|---|
| Бензин | 32 МДж/л | 14,6 | 2,9 МДж/кг воздух | 0,36 МДж/кг | 91—99 | 81—89 |
| Бутанол-1 | 29,2 МДж/л | 11,1 | 3,2 МДж/кг воздух | 0,43 МДж/кг | 96 | 78 |
| Этанол | 19,6 МДж/л | 9,0 | 3,0 МДж/кг воздух | 0,92 МДж/кг | 132 | 89 |
| Метанол | 16 МДж/л | 6,4 | 3,1 МДж/кг воздух | 1,2 МДж/кг | 156 | 92 |
Работа топливных элементов основана на реакции окисления метанола на катализаторе в диоксид углерода . Вода выделяется на катоде. Протоны (H + ) проходят через протонообменную мембрану к катоду, где они реагируют с кислородом и образуют воду. Электроны проходят через внешнюю цепь от анода к катоду, снабжая энергией внешнюю нагрузку.
Реакции:
На аноде
На катоде
Общая для топливного элемента:
|
|
В разделе
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
Низкий уровень примесей метанола может быть использован в топливе существующих транспортных средств с использованием надлежащих ингибиторов коррозии. Т. н. европейская директива качества топлива (European Fuel Quality Directive) позволяет использовать до 3 % метанола с равным количеством присадок в бензине, продаваемом в Европе. Сегодня в Китае используется более 1000 млн галлонов метанола в год в качестве транспортного топлива в смесях низкого уровня, используемых в существующих транспортных средствах, а также высокоуровневые смеси в транспортных средствах, предназначенных для использования метанола в качестве топлива.
Помимо применения метанола в качестве альтернативы бензина существует технология применения метанола для создания на его базе угольной суспензии, которая в США имеет коммерческое наименование « » (methacoal ). Такое топливо предлагается как альтернатива мазута , широко используемого для отопления зданий ( Топочный мазут ). Такая суспензия в отличие от водоуглеродного топлива не требует специальных котлов и имеет более высокую энергоёмкость. С экологической точки зрения такое топливо имеет меньший « углеродный след », чем традиционные варианты синтетического топлива получаемого из угля с использованием процессов, где часть угля сжигается во время производства жидкого топлива .
|
|
В разделе
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
Во время Второй мировой войны Германия использовала метанол в качестве топлив и присадок к топливу, для нужд люфтваффе . Система форсирования авиационного поршневого двигателя MW 50 представлялa собой смесь 50 % воды и 50 % метанола которая распылялась в нагнетатель авиационных двигателей, главным образом из-за её антидетонационного эффекта, позволяя создавать большее давление в цилиндрах. Её побочным эффектом было внутреннее охлаждение двигателя.
Эффект применения MW 50 был значительным. Простое включение системы позволяло двигателю поглотить больше воздуха, благодаря охлаждающему эффекту, тем самым увеличивая производительность примерно на 100 л. с. для двигателей BMW 801 и DB 605 . В дополнение к этому MW-50 позволял нагнетателю работать на более высокой скорости и давлении, вызывая комбинированное увеличение мощности двигателей до 500 л. с. (для двигателей Юнкерс Юмо 211 ).
Немецкий ракетный истребитель-перехватчик времён Второй мировой войны Me-163 имел жидкостный ракетный двигатель, в который подавалась 80-процентная перекись водорода и жидкий катализатор (раствор перманганата калия либо смесь метанола, и воды). В камере сгорания перекись водорода разлагалась с образованием большого объёма перегретой парогазовой смеси, создавая мощную реактивную тягу.