Биоортогональные реакции
- 1 year ago
- 0
- 0

Электрофил (от др.-греч. ἤλεκτρον — «янтарь» + др.-греч. φιλέω — «любить», дословно « любящий электроны ») — реагент или молекула , имеющая свободную орбиталь на внешнем электронном уровне. Как правило такие реагенты являются акцепторами пары электронов при образовании химической связи с нуклеофилом , являющимся донором электронной пары и вытесняет уходящую группу в виде положительно заряженной частицы . Все электрофилы являются кислотами Льюиса .
Электрофилы проявляют свойства электронодефицитных реагентов, стремящихся к заполнению вакантной орбитали электронами. К электрофилам относятся положительно заряженные ионы — катионы (самый простой пример протон H + , карбокатионы , NO 2 + ), электронодефицитные нейтральные молекулы — SO 3 , а также молекулы с сильнополяризованной связью (HCOO - Br + ).
Реакции, протекающие с участием электрофилов:
Реакции электрофильного присоединения Ad E
Характерны для углеводородов с ненасыщенными связями — алкенам , диенам , алкинам . Наиболее распространённой реакцией Ad E является присоединение галогенов к кратной связи. Галогены выступают в роли электрофилов. Механизм присоединения рассмотрен на примере образования 1,2-дибромэтана , в результате взаимодействия этилена с бромом по реакции:
Присоединение брома по кратной связи включает 3 стадии:

Данный механизм относится к реакции бимолекулярного электрофильного присоединения Ad E 2
Присоединение галогеноводородов
Другой важной реакций электрофильного присоединения к ненасыщенным углеводородам является давно известное гидрогалогенирование .
В одной из наиболее сложных реакций гидратации алкенов (в данном примере — этилена ) в качестве катализатора используется концентрированная серная кислота : (с массовой долей не менее 97 %). Эта реакция протекает аналогично реакции присоединения, но имеет дополнительную стадию, при которой гидросульфатная группа OSO 3 H - заменяется гидроксильной группой OH - , образуя молекулу спирта:
Как можно видеть, серная кислота действительно принимает участие в общей реакции, однако она регенерирует в ходе реакции (концентрация остаётся неизменной), поэтому её в данном процессе классифицируют как катализатор.
Механизм реакции гидратации на примере синтеза этанола :
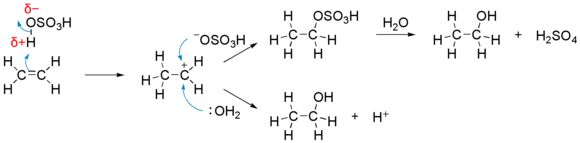
Присоединение молекул воды к алкенам, которые имеют несимметричное строение, протекает по правилу Марковникова .
| Индекс электрофильности | |
| Фтор | 3.86 |
| Хлор | 3.67 |
| Бром | 3.40 |
| Йод | 3.09 |
| Гипохлорит ион | 2.52 |
| Диоксид серы | 2.01 |
| Сероуглерод | 1.64 |
| Бензол | 1.45 |
| Натрий | 0.88 |
| Некоторые выбранные значения (величина безразмерная). | |
Существуют несколько методов для ранжирования электрофилов в порядке их реактивности. Один из них это омега индекс — ω или индекс электрофильности , изобретённый американским физикохимиком Робертом Парром . Омега индекс определяется как:
отношение квадрата электроотрицательности , к так называемой химической твёрдости. Это отношение соответствует уравнению нахождения электрической мощности :
где это электрическое сопротивление и — напряжение . В этом смысле индекс электрофильности является своего рода мощностью того или иного электрофильного реагента. Индекс электрофильности величина безразмерная.
Индекс электрофильности также существует для свободных радикалов
.
Негативные проявления связанные с канцерогенами , возникают вследствие наличия у последних электрофильных свойств, они легко взаимодействуют с нуклеофильными группами азотистых оснований (NH 2 -группы), входящих в состав нуклеиновых кислот , в частности ДНК , образуя с ней ковалентно связанные (зачастую прочно) ДНК-аддукты . Особенно это свойство выражено у генотоксических канцерогенов.