Константа диссоциации кислоты
K
a
(также известная как
константа кислотности
) —
константа равновесия
реакции
диссоциации
кислоты на
катион
водорода
и
анион
кислотного остатка. Для многоосновных кислот, диссоциация которых проходит в несколько стадий, оперируют отдельными константами для разных стадий диссоциации, обозначая их как
K
a1
,
K
a2
и т. д. Чем больше значение
K
a
, тем больше молекул диссоциирует в растворе и, следовательно кислота более сильная.
Примеры расчета
Одноосновная кислота
|
Реакция
|
K
a
|

|
![{\displaystyle K_{{\ce {a}}}={\frac {[{\ce {A^-}}][{\ce {H+}}]}{{\ce {[HA]}}}}}](/images/005/062/5062886/2.jpg?rand=799715)
|
где A
-
— условное обозначение аниона кислоты, [HA] —
равновесная
концентрация в растворе частицы HA.
Двухосновная кислота
|
Реакция
|
K
a
|

|
![K_{a1} = {\left[ H^+ \right] \left[ HA^- \right] \over \left[ H_2A \right]}](/images/005/062/5062886/4.jpg?rand=452446)
|

|
![K_{a2} = {\left[ H^+ \right] \left[ A^{2-} \right] \over \left[ HA^- \right]}](/images/005/062/5062886/6.jpg?rand=684498)
|
Фигурирующая в выражениях концентрация [H
2
A] — это
равновесная
концентрация недиссоциировавшей кислоты, а не изначальная концентрация кислоты до её диссоциации.
Величины pK
a
и
pH
Чаще вместо самой константы диссоциации
 (константы кислотности) используют величину
(константы кислотности) используют величину
 (показатель константы кислотности), которая определяется как
отрицательный десятичный логарифм
самой константы
(показатель константы кислотности), которая определяется как
отрицательный десятичный логарифм
самой константы
 , выраженной в моль/л. Аналогично может быть выражен водородный показатель
pH
.
, выраженной в моль/л. Аналогично может быть выражен водородный показатель
pH
.
-

-
![{\displaystyle {\ce {pH}}=-\lg[{\ce {H+}}]}](/images/005/062/5062886/11.jpg?rand=235482) .
.
Величины
pK
a
и
pH
связаны уравнением Гендерсона — Хассельбаха.
-
![{\displaystyle {\ce {pH}}=\mathrm {p} K_{\mathrm {a} }+\lg \left(\mathrm {\frac {[A^{-}]}{[HA]}} \right)}](/images/005/062/5062886/12.jpg?rand=799058)
Преобразование уравнения
Пусть
 - исходная молярная концентрация кислоты
- исходная молярная концентрация кислоты
 —
степень диссоциации
—
степень диссоциации

|

|

|

|

|

|
|

|
|

|
Преобразуем уравнение
![{\displaystyle {\ce {pH}}=\mathrm {p} K_{\mathrm {a} }+\lg \left(\mathrm {\frac {[A^{-}]}{[HA]}} \right)}](/images/005/062/5062886/23.jpg?rand=925603)


Можно заметить, что при
 имеем
имеем
 , значит
, значит
 показывает такое значение
показывает такое значение
 , при котором кислота диссоциирует наполовину.
, при котором кислота диссоциирует наполовину.

|

|
В более кислой среде диссоциация кислоты уменьшается
|
![{\displaystyle [A^{-}]<[HA]}](/images/005/062/5062886/32.jpg?rand=702715)
|

|

|
Равновесие концентраций кислоты и её соли
|
![{\displaystyle [A^{-}]=[HA]}](/images/005/062/5062886/35.jpg?rand=417336)
|

|

|
В более щелочной среде диссоциация кислоты увеличивается
|
![{\displaystyle [A^{-}]>[HA]}](/images/005/062/5062886/38.jpg?rand=856955)
|
Другая связь pK
a
и pH

|

|

|

|

|

|
|

|
|

|
![{\displaystyle K={[A^{-}][H^{+}] \over [HA]}={[H^{+}]^{2} \over [HA]},\ \ \ [H^{+}]={\sqrt {\mathrm {K_{a}c} }}}](/images/005/062/5062886/47.jpg?rand=271997)

пример нахождения pH
Найти pH раствора 0,1 M Na
2
CO
3
pK
a1
(H
2
CO
3
) = 6.3696
pK
a2
(H
2
CO
3
) = 10.3298
Решение:
Na
2
CO
3
+ H
2
O = NaOH + NaHCO
3

откуда получаем


Значение pH > 7 означает, что соль Na
2
CO
3
даёт щелочную среду
Константа диссоциации основания K
b
 — показатель константы кислотности (от англ. acid — кислота), характеризующий реакцию
отщепления
протона от
кислоты
HА.
— показатель константы кислотности (от англ. acid — кислота), характеризующий реакцию
отщепления
протона от
кислоты
HА.
 — показатель константы основности (от англ. base — основание), характеризующий реакцию
присоединения
протона к
основанию
B.
— показатель константы основности (от англ. base — основание), характеризующий реакцию
присоединения
протона к
основанию
B.
|
Реакция
|
K
|

|
![{\displaystyle K_{{\ce {a}}}={\frac {[{\ce {A^-}}][{\ce {H+}}]}{{\ce {[HA]}}}}}](/images/005/062/5062886/55.jpg?rand=885520)
|

|
![{\displaystyle K_{b}={\frac {[{\mathsf {BH^{+}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {B}}]}}}](/images/005/062/5062886/57.jpg?rand=667714)
|
 —
ионное произведение воды
—
ионное произведение воды


Константы диссоциации некоторых соединений
Кислотность воды
pK
a
(H
2
O) = 15,74
Чем больше
pK
a
,
тем более основное соединение; чем меньше
pK
a
,
тем соединение более кислотное.
Например, по значению
pK
a
можно понять, что
спирты
проявляют основные свойства (их
pK
a
больше, чем у воды), а
фенолы
проявляют кислотные свойства.
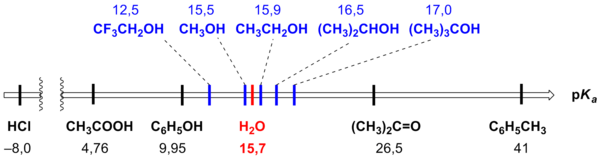
Также по
pK
a
можно установить ряд сил кислот, приведённый в российских школьных учебниках
Ряд сил кислот
|
|
Название
|
Кислота
|
pK
a1
|
pK
a2
|
pK
a3
|
 при С = 1 моль/л, %
при С = 1 моль/л, %
|
|
Сильные
кислоты
|
Йодоводородная
|
HI
|
-10
|
|
|
100
|
|
Хлорная
|
HClO
4
|
-10
|
|
|
100
|
|
Бромоводородная
|
HBr
|
-9
|
|
|
100
|
|
Соляная (хлороводородная)
|
HCl
|
-7
|
|
|
100
|
|
Серная
|
H
2
SO
4
|
-3
|
1.92
|
|
99,90
|
|
Селеновая
|
H
2
SeO
4
|
-3
|
1.9
|
|
99,90
|
|
Гидроксоний
|
H
3
O
+
|
-1.74
|
15.74
|
21
|
98,24
|
|
Азотная
|
HNO
3
|
-1.4
|
|
|
96,31
|
|
Хлорноватая
|
HClO
3
|
-1
|
|
|
91,61
|
|
Иодноватая
|
HIO
3
|
0.8
|
|
|
32,67
|
|
Средние
кислоты
|
Сульфаминовая
|
NH
2
SO
3
H
|
0.99
|
|
|
27,28
|
|
Щавелевая
|
H
2
C
2
O
4
|
1.42
|
4.27
|
|
17,69
|
|
Йодная
|
H
5
IO
6
|
1.6
|
|
|
14,64
|
|
Фосфористая
|
H
3
PO
3
|
1.8
|
6.5
|
|
11,82
|
|
Сернистая
|
H
2
SO
3
|
1.92
|
7.20
|
|
10,38
|
|
Гидросульфат
|
HSO
4
-
|
1.92
|
|
|
10,38
|
|
Фосфорноватистая
|
H
3
PO
2
|
2.0
|
|
|
9,51
|
|
Хлористая
|
HClO
2
|
2.0
|
|
|
9,51
|
|
Фосфорная
|
H
3
PO
4
|
2.1
|
7.12
|
12.4
|
8,52
|
|
Гексаакважелеза (III) катион
|
[Fe(H
2
O)
6
]
3
+
|
2.22
|
|
|
7,47
|
|
Мышьяковая
|
H
3
AsO
4
|
2.32
|
6.85
|
11.5
|
6,68
|
|
Селенистая
|
H
2
SeO
3
|
2.6
|
7.5
|
|
4,89
|
|
Теллуристая
|
H
2
TeO
3
|
2.7
|
7.7
|
|
4,37
|
|
Фтороводородная (плавиковая)
|
HF
|
3
|
|
|
3,11
|
|
Теллуроводородная
|
H
2
Te
|
3
|
12.16
|
|
3,11
|
|
Слабые
кислоты
|
Азотистая
|
HNO
2
|
3.35
|
|
|
2,09
|
|
Уксусная
|
CH
3
COOH
|
4.76
|
|
|
0,4160
|
|
Гексаакваалюминия (III) катион
|
[Al(H
2
O)
6
]
3+
|
4.85
|
|
|
0,3751
|
|
Угольная
|
H
2
CO
3
|
6.37
|
10.33
|
|
0,0653
|
|
Сероводородная
|
H
2
S
|
6.92
|
13
|
|
0,0347
|
|
Дигидрофосфат
|
H
2
PO
4
-
|
7.12
|
12.4
|
|
0,0275
|
|
Хлорноватистая
|
HClO
|
7.25
|
|
|
0,0237
|
|
Ортогерманиевая
|
H
4
GeO
4
|
8.6
|
12.7
|
|
0,0050
|
|
Бромноватистая
|
HBrO
|
8.7
|
|
|
0,0045
|
|
Ортотеллуровая
|
H
6
TeO
6
|
8.8
|
11
|
15
|
0,0040
|
|
Мышьяковистая
|
H
3
AsO
3
|
9.2
|
|
|
0,0025
|
|
Синильная (циановодородная)
|
HCN
|
9.21
|
|
|
0,0025
|
|
Ортоборная
|
H
3
BO
3
|
9.24
|
|
|
0,0024
|
|
Аммоний
|
NH
4
+
|
9.25
|
|
|
0,0024
|
|
Ортокремниевая
|
H
4
SiO
4
|
9.5
|
11.7
|
12
|
0,0018
|
|
Гидрокарбонат
|
HCO
3
-
|
10.4
|
|
|
6,31*10^-4
|
|
Иодноватистая
|
HIO
|
11.0
|
|
|
3,16*10^-4
|
|
Пероксид водорода
|
H
2
O
2
|
11.7
|
|
|
1,41*10^-4
|
|
Гидрофосфат
|
HPO
4
2-
|
12.4
|
|
|
6,31*10^-5
|
|
Гидросульфат
|
HS
-
|
14.0
|
|
|
1,00*10^-5
|
|
Вода
|
H
2
O
|
15.7
|
21
|
|
1,41*10^-6
|
|
Основания
|
Гидроксид
|
OH
-
|
21
|
|
|
3,16*10^-9
|
|
Фосфин
|
PH
3
|
27
|
|
|
0
|
|
Аммиак
|
NH
3
|
33
|
|
|
0
|
|
|
Метан
|
CH
4
|
34
|
|
|
0
|
|
|
Водород
|
H
2
|
38.6
|
|
|
0
|
См. также
Примечания
-
(рус.)
. Дата обращения: 14 октября 2021.
23 октября 2021 года.

