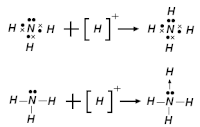Interested Article - Кислота Льюиса

- 2021-07-06
- 1

Кислота́ Лью́иса — любое химическое соединение — молекула либо ион , являющееся акцептором электронной пары и, таким образом, способное принять пару электронов соединения-донора (основания Льюиса) на незаполненную орбиталь с образованием соединения- аддукта .
В рамках электронной теории химических соединений Льюиса химическая связь образуется обобществлённой электронной парой, достраивающей электронные оболочки атомов, образующих связь, до завершенной электронной конфигурации инертного газа ( правило октетов ).
В качестве кислот Льюиса могут выступать как нейтральные молекулы, так и катионы: так, катионы водорода выступают в роли кислоты Льюиса при взаимодействии с водой либо аммиаком, с образованием ионов гидроксония либо аммония .
Кислотами Льюиса являются также координационно ненасыщенные соединения — как металлов, так и неметаллов, например, BF 3 , AlCl 3 , образующие аддукты с различными основаниями Льюиса:
См. также
Примечания
- . Дата обращения: 7 октября 2011. 8 марта 2017 года.
- 2021-07-06
- 1
![{\mathsf {AlCl_{3}+Cl^{-}\rightarrow [AlCl_{4}]^{-}}}](/images/005/062/5062891/2.jpg?rand=468992)
![{\mathsf {SiF_{4}+2F^{-}\rightarrow [SiF_{6}]^{2}-}}](/images/005/062/5062891/3.jpg?rand=566235)