Interested Article - Вода

- 2021-03-14
- 2

Вода́ ( оксид водорода , гидроксид водорода , химическая формула — H 2 O ) — бинарное неорганическое соединение , молекула которого состоит из двух атомов водорода и одного — кислорода , которые соединены между собой ковалентной связью . При нормальных условиях представляет собой прозрачную жидкость , не имеющую цвета (при малой толщине слоя), запаха и вкуса . В твёрдом состоянии называется льдом ( кристаллы льда могут образовывать снег или иней ), а в газообразном — водяным паром . Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях) .
Вода является хорошим сильнополярным растворителем . В природных условиях всегда содержит растворённые вещества ( соли , газы ).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии , возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды . Вода является важнейшим веществом для всех живых существ на Земле . В среднем в организме растений и животных содержится более 50 % воды .
Всего на Земле около 1400 млн км³ воды. Вода покрывает 71 % поверхности земного шара ( океаны , моря , озёра , реки , льды — 361,13 млн км² ). Бо́льшая часть земной воды (97,54 %) принадлежит Мировому океану — это солёная вода, непригодная для сельского хозяйства и питья. Пресная же вода находится в основном в ледниках (1,81 %) и подземных водах (около 0,63 %), и лишь небольшая часть (0,009 %) в реках и озёрах. Материковые солёные воды составляют 0,007 %, в атмосфере содержится 0,001 % от всей воды нашей планеты . В составе мантии Земли воды содержится в 10—12 раз больше, чем в Мировом океане .
Вода — это одно из немногих веществ в природе, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают сурьма , висмут , галлий , германий и некоторые соединения и смеси).
История названия
Слово происходит от др.-русск. вода , далее — от праславянского * voda (ср. ст.-слав. вода , болг. вода́ , сербохорв. во̀да , словен. vóda , чеш. voda , слвц. voda , польск. woda , в.-луж. , н.-луж. woda ), затем — от праиндоевропейского * wed -, родственного лит. vanduõ , жем. unduo , д.-в.-н. waʒʒar «вода», гот. watō , англ. water , греч. ὕδωρ , ὕδατος , арм. գետ «река», фриг. βέδυ , др.-инд. udakám , uda -, udán - «вода», unátti «бить ключом», «орошать», ṓdman - «поток», алб. uj «вода» . Русские слова «ведро», «выдра» имеют тот же корень.
В рамках необщепринятой гипотезы о существовании некогда праностратического языка слово может сравниваться с гипотетическим прауральским * wete (ср., например, фин. vesi , эст. vesi , коми va , венг. víz ), а также с предполагаемыми праалтайскими , прадравидийским и прочими словами, и реконструироваться как * wetV для праязыка .
Химические названия
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2, встречается также устаревшее название окись водорода.
- Гидроксид водорода: соединение гидроксильной группы OH - и катиона (H + )
- Гидроксильная кислота : воду можно рассматривать как соединение катиона H + , который может быть замещён металлом, и «гидроксильного остатка» OH -
- Монооксид дигидрогена
- Дигидромонооксид
Свойства
Физические свойства
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами ( H 2 S , CH 4 , HF ). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д , уступает только синильной кислоте и диметилсульфоксиду ). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода . Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования . Если бы не было водородных связей , вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов ( серы , селена , теллура ), кипела бы при −80 °C, а замерзала при −100 °C .
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении , напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель .
Помимо большой удельной теплоёмкости , вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| Температура, °С | Удельная теплоёмкость воды, кДж/(кг*К) |
|---|---|
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Физические свойства разных изотопных модификаций воды при различных температурах :
| Модификация воды | Максимальная плотность при температуре, °С | Тройная точка при температуре, °С |
|---|---|---|
| Н 2 O | 3,9834 | 0,01 |
| D 2 O | 11,2 | 3,82 |
| T 2 O | 13,4 | 4,49 |
| Н 2 18 O | 4,3 | 0,31 |
Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями [ источник не указан 1057 дней ] .
Вода является хорошим растворителем веществ с молекулами, обладающими электрическим дипольным моментом . При растворении молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды важно для живых существ. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде . Вода необходима для жизни всех без исключения живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности [ уточнить ] .

Чистая вода — хороший изолятор . При нормальных условиях вода слабо диссоциирована на ионы и концентрация протонов (точнее, ионов гидроксония H 3 O + ) и гидроксильных ионов OH − составляет 10 -7 моль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные вещества, например, соли, то есть в растворе присутствуют другие положительные и отрицательные ионы. Поэтому обычная вода хорошо проводит электрический ток. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, чем обусловлен нагрев пищевых продуктов в микроволновой печи .
Агрегатные состояния

По состоянию различают:
- «твёрдое» — лёд
- «жидкое» — вода
- «газообразное» — водяной пар

При нормальном атмосферном давлении (760 мм рт. ст. , 101 325 Па ) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию» ). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм ) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт :
| Давление, атм. | Температура кипения (Т кип ), °C |
|---|---|
| 0,987 (10 5 Па — нормальные условия) | 99,63 |
| 1 | 100 |
| 2 | 120 |
| 6 | 158 |
| 218,5 | 374,1 |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K ) и давлении 22,064 МПа (218 атм ) вода проходит критическую точку . В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют « сверхкритическая жидкость ».
Вода может находиться в метастабильных состояниях — пересыщенный пар , перегретая жидкость , переохлаждённая жидкость . Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Также вода может существовать в виде двух разных жидкостей («вторая вода» возникает при температуре около −70 °C и давлении в тысячи атмосфер), которые при определённых условиях даже не смешиваются друг с другом; гипотеза, что вода может существовать в двух различных жидких состояниях, была предложена примерно 30 лет назад на основе результатов компьютерного моделирования и экспериментально проверена только в 2020 г.
Удельная теплоёмкость
| t, °С | 0 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 | 60 | 65 | 70 | 75 | 80 | 85 | 90 | 95 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Cp, Дж/(кг·град) | 4217 | 4191 | 4187 | 4183 | 4179 | 4174 | 4174 | 4174 | 4177 | 4181 | 4182 | 4182 | 4185 | 4187 | 4191 | 4195 | 4202 | 4208 | 4214 | 4220 |
Эти данные можно аппроксимировать эмпирической формулой:
- .
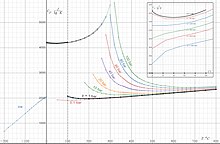
Диэлектрическая проницаемость воды
Статическая (для постоянного электростатического поля ) диэлектрическая проницаемость воды при разной абсолютной температуре при давлении 1 бар в диапазоне температур −13…100 °C выражается эмпирической формулой :
Результаты вычислений по этой формуле :
| T, K | 260 | 273 | 283 | 293 | 298 | 303 | 313 | 323 | 333 | 343 | 353 | 363 | 373 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| -13 | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
| 93,41 | 87,99 | 84,08 | 80,32 | 78,5 | 76,71 | 73,25 | 69,94 | 66,78 | 63,78 | 60,92 | 58,21 | 55,66 |
Оптические свойства
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение , поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Изотопные модификации
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
- лёгкая вода (основная составляющая привычной людям воды) ;
- тяжёлая вода (дейтериевая) ;
- сверхтяжёлая вода (тритиевая) ;
- тритий-дейтериевая вода ;
- тритий-протиевая вода ;
- дейтерий-протиевая вода .
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды ( и ) содержится больше, чем воды : их содержание, соответственно, 1,8 кг и 0,15 кг на тонну .
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней .
По стабильным изотопам кислорода , и существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 разновидностей молекул воды. В действительности природная вода содержит все разновидности молекул.
Химические свойства
Вода является наиболее распространённым растворителем на планете Земля , во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Воду иногда рассматривают как амфолит — и кислоту и основание одновременно ( катион H + анион OH − ). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония ), pK a = p(1,8⋅10 −16 ) ≈ 15,74. Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты . Сольволиз, и в частности гидролиз , происходит в живой и неживой природе, и широко используется в химической промышленности .
Воду можно получать:
- В ходе реакций —
- В ходе реакций нейтрализации —
- Восстановлением водородом оксидов металлов —
Под воздействием очень высоких температур или электрического тока (при электролизе ) , а также под воздействием ионизирующего излучения , как установил в 1902 году при исследовании водного раствора бромида радия , вода разлагается на молекулярный кислород и молекулярный водород :
Вода реагирует при комнатной температуре:
- со фтором и межгалоидными соединениями
- (при низких температурах)
- с солями , образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- с карбидами , нитридами , фосфидами , силицидами , гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
- с углём, метаном
- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора :
- с амидами, эфирами карбоновых кислот
- с ацетиленом и другими алкинами
- с алкенами
- с нитрилами
Волновая функция основного состояния воды
|
|
В разделе
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
В валентном приближении электронная конфигурация молекулы в основном состоянии: Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО) — по два электрона на каждой МО , один со спином , другой со спином , или 8 спин-орбиталей . Волновая функция молекулы, , представленная единственным детерминантом Слэтера Ф, имеет вид
Симметрия этой волновой функции определяется прямым произведением НП, по которым преобразуются все занятые спин-орбитали
Принимая во внимание, что прямое произведение невырожденного НП самого на себя является полносимметричным НП и прямое произведение любого невырожденного представления Г на полносимметричное есть Г, получаем:
Виды
Вода на Земле может существовать в трёх основных состояниях:
- твёрдом
- жидком
- газообразном
Вода может приобретать различные формы, которые могут одновременно соседствовать и взаимодействовать друг с другом:
- водяной пар и облака в небе ;
- морская вода и айсберги ;
- ледники и реки на поверхности земли;
- водоносные слои в земле.
Вода способна растворять в себе множество органических и неорганических веществ. Из-за важности воды как источника жизни, её нередко подразделяют на типы по различным принципам.
Виды воды по особенностям происхождения, состава или применения:
- по содержанию катионов кальция и магния
- по изотопам водорода в молекуле
- лёгкая вода (по составу почти соответствует обычной)
- тяжёлая вода (дейтериевая)
- сверхтяжёлая вода (тритиевая)
- другие виды
- пресная вода
- дождевая вода
- морская вода
- подземные воды
- минеральная вода
- солоноватая вода
- питьевая вода и водопроводная вода
- дистиллированная вода и деионизированная вода
- сточные воды
- или поверхностные воды
- поливода
- структурированная вода — термин, применяемый в неакадемических теориях
- мёртвая вода и живая вода — виды воды со сказочными свойствами
Вода, входящая в состав другого вещества и связанная с ним физическими связями, называется влагой . В зависимости от вида связи, выделяют:
- сорбционную, капиллярную и осмотическую влагу в твёрдых веществах,
- растворённую и эмульсионную влагу в жидкостях,
- водяной пар или туман в газах .
Вещество , содержащее влагу, называют влажным веществом . Влажное вещество, не способное более сорбировать (поглощать) влагу, — насыщенное влагой вещество .
Вещество, в котором содержание влаги пренебрежимо мало при данном конкретном применении, называют сухим веществом . Гипотетическое вещество, совершенно не содержащее влагу, — абсолютно сухое вещество . Сухое вещество, составляющее основу данного влажного вещества, называют сухой частью влажного вещества .
Смесь газа с водяным паром носит название влажный газ ( парогазовая смесь — устаревшее название) .

В природе
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане , а также в виде пара . При конденсации выводится из атмосферы в виде атмосферных осадков ( дождь , снег , град , роса ). В совокупности жидкая водная оболочка Земли называется гидросферой , а твёрдая — криосферой . Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Мировой океан содержит более 97,54 % земной воды, ледники — 1,81 %, подземные воды — около 0,63 %, реки и озёра — 0,009 %, материковые солёные воды — 0,007 %, атмосфера — 0,001 % .
Атмосферные осадки
|
|
Этот раздел статьи
ещё
не написан
.
|
Вода за пределами Земли
Вода — чрезвычайно распространённое вещество в космосе , однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях вакуума космоса, отчего она представлена только в виде пара или льда.
Одним из наиболее важных вопросов, связанных с освоением космоса человеком и возможности возникновения жизни на других планетах , является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда. Не стоит, впрочем, забывать, что не любая водная среда пригодна для жизни.
В результате бомбардировки лунного кратера , проведённой 9 октября 2009 года НАСА с использованием космического аппарата LCROSS , впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объёмах .
Вода широко распространена в Солнечной системе . Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: Энцеладе , Тефии , Европе , Ганимеде и др. Вода присутствует в составе всех комет и многих астероидов. Учёными предполагается, что многие транснептуновые объекты имеют в своём составе воду.
Вода в виде паров содержится в атмосфере Солнца (следы) , атмосферах Меркурия (3,4 %, также большие количества воды обнаружены в экзосфере Меркурия) , Венеры (0,002 %) , Луны , Марса (0,03 %) , Юпитера (0,0004 %) , Европы , Сатурн , Урана (следы) и Нептуна (найден в нижних слоях атмосферы).
Содержание водяного пара в атмосфере Земли у поверхности колеблется от 3—4 % в тропиках и до 2·10 −5 % в Антарктиде .
Кроме того, вода обнаружена на экзопланетах , например HD 189733 A b , HD 209458 b и GJ 1214 b .
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет — наиболее вероятно, на Европе — спутнике Юпитера .
Биологическая роль

Вода играет уникальную роль как вещество , определяющее возможность существования и саму жизнь всех существ на Земле . Она выполняет роль универсального растворителя , в котором происходят основные биохимические процессы живых организмов . Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений.
Благодаря водородной связи , вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить. Существует и другая точка зрения: если бы вода не расширялась при замерзании, то не разрушались бы клеточные структуры, соответственно замораживание не наносило бы ущерба живым организмам. Некоторые существа ( тритоны ) переносят замораживание/оттаивание — считается, что этому способствует особый состав клеточной плазмы, не расширяющейся при замораживании.
Применение
В земледелии
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию .
Для питья и приготовления пищи

Живое человеческое тело содержит от 50 % до 75 % воды , в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды; ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов . Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья .

В спорте
Многими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это подводное плавание , хоккей , лодочные виды спорта, биатлон , шорт-трек и др.
Для смазки
Вода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках .
Исследования
Происхождение воды на планете
Происхождение воды на Земле является предметом научных споров. Некоторые учёные [ кто? ] считают, что вода была занесена астероидами или кометами на ранней стадии образования Земли, около четырёх миллиардов лет назад, когда планета уже сформировалась в виде шара. В 2010-е годы было установлено, что вода появилась в мантии Земли не позже 2,7 миллиардов лет назад .
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой , а также явления и процессы, в них протекающие (испарение, замерзание и т. п.). Предметом изучения гидрологии являются все виды вод гидросферы в океанах , морях , реках , озёрах , водохранилищах , болотах , почвенных и подземных водах .
Также гидрология исследует круговорот воды в природе , влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками .
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию:
- Океанология подразделяется на биологию океана , химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
- Гидрология суши подразделяется на гидрологию рек ( речную гидрологию, потамологию ), озероведение (лимнологию) , болотоведение , гляциологию .
- Гидрогеология — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой. В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений.
См. также
Литература
- Яковлев В. А. // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб. , 1890—1907.
- / Рец. А. А. Соколов. — Л. : Гидрометеоиздат , 1989. — 272 с. — 113 000 экз. — ISBN 5-286-00161-0 .
- Гидробионты в самоочищении вод и биогенной миграции элементов. — М.: МАКС-Пресс. 2008. — 200 с. — ISBN 978-5-317-02625-7 .
- О некоторых вопросах поддержания качества воды и её самоочищения // Водные ресурсы . — 2005. — Т. 32. — № 3. — С. 337—347.
- Андреев В. Г. Влияние протонного обменного взаимодействия на строение молекулы воды и прочность водородной связи // Материалы V Международной конференции «Актуальные проблемы науки в России». — 2008. — Т. 3. — С. 58—62.
- . — М. : Знание , 1973. — 96 с.
- Кульский Л. А. , Даль В. В., Ленчина Л. Г. . — Киев: Радянська школа, 1982. — 120 с.
- Мельник А. Г. // Святая вода в иеротопии и иконографии христианского мира / ред.-сост. А.М. Лидов. — М. : ООО "Феория", 2017. — С. 496—520 . — ISBN 978-5-91796-061-6 .
- . — М. : Стандартинформ, 2015. — iv + 16 с.
- Encrenaz, Thérèse. ISO observations of the giant planets and Titan: what have we learnt? (англ.) // Planetary and Space Science : journal. — 2003. — February ( vol. 51 , no. 2 ). — P. 89—103 . — doi : . — .
Примечания
- англ. International Union of Pure and Applied Chemistry. Nomenclature of Inorganic Chemistry. IUPAC RECOMMENDATIONS 2005. RSC Publishing, 2005. — p. 306.
- Riddick, John (1970). Organic Solvents Physical Properties and Methods of Purification. Techniques of Chemistry. Wiley-Interscience. ISBN 0471927260 .
- — Издательство Кембриджского университета , 2009. — С. 64. — ISBN 9780521899635
- (англ.)
- ↑ Маленков Г. Г. // Физическая энциклопедия . — М. : Советская энциклопедия , 1988. — Т. I. Ааронова — Бома эффект — Длинные линии . — С. 294—297 . 18 августа 2016 года.
- Петрушевский Ф. Ф. , Гершун А. Л. // — СПб. : Брокгауз — Ефрон , 1896. — Т. XVII. — С. 471—473.
- Henniker, J. C. The Depth of the Surface Zone of a Liquid (англ.) // Reviews of Modern Physics : journal. — Reviews of Modern Physics, 1949. — Vol. 21 , no. 2 . — P. 322—341 . — doi : .
- Pollack, Gerald. . University of Washington, Pollack Laboratory. — «Water has three phases – gas, liquid, and solid; but recent findings from our laboratory imply the presence of a surprisingly extensive fourth phase that occurs at interfaces.» Дата обращения: 5 февраля 2011. 15 февраля 2013 года.
- Криволуцкий А. Е. Голубая планета. Земля среди планет. Географический аспект. — М.: Мысль, 1985. — С. 212.
- . Un.org (22 марта 2005). Дата обращения: 25 июля 2010. 15 февраля 2013 года.
- Дата обращения: 27 августа 2008. 22 января 2009 года.
- . Central Intelligence Agency . Дата обращения: 20 декабря 2008. Архивировано из 5 января 2010 года.
- ↑ Marine Science: An Illustrated Guide to Science
- Gleick, P.H. (англ.) . — Oxford University Press , 1993. 5 марта 2016 года.
- (англ.) . American Geophysical Union . Дата обращения: 13 февраля 2013. 15 февраля 2013 года.
- . Дата обращения: 6 апреля 2011. 2 ноября 2011 года.
- Сурьма // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М. : Педагогика , 1990. — С. 235 . — ISBN 5-7155-0292-6 .
- Derksen, Rick. Etymological Dictionary of the Slavic Inherited Lexicon
- М. Фасмер. Этимологический словарь русского языка. Вода
- . Дата обращения: 9 ноября 2019. 9 июля 2019 года.
- . Дата обращения: 8 сентября 2020. 18 января 2021 года.
- ↑ Ларионов А. К. Занимательная гидрогеология. — Москва: Недра , 1979. — С. 5—12. — 157 с.
- ↑ Петрянов И.В. Самое необыкновенное вещество // Химия и жизнь . — 1965. — № 3 . — С. 2—14 .
- . Дата обращения: 24 ноября 2007. 23 января 2009 года.
- Воскресенский П. И. Техника лабораторных работ. 9-е изд. — Л.: « Химия », 1970. — С. 696—697
- от 27 ноября 2020 на Wayback Machine // Вести.ру , 21 ноября 2020
- Thermalinfo ruАвтор11 11 2016 в 15:06. . Thermalinfo.ru . Дата обращения: 30 мая 2022. 23 ноября 2021 года.
- . Desmos . Дата обращения: 30 мая 2022.
- . Desmos . Дата обращения: 3 июня 2022. 6 июня 2022 года.
- . Дата обращения: 16 ноября 2021. 16 ноября 2021 года.
- . Дата обращения: 16 ноября 2021. 16 ноября 2021 года.
- Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 7. Атомы // . — 18-е изд. — М. : Просвещение , 1987. — С. —18. — 240 с. — 1 630 000 экз.
- Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М. : Педагогика , 1990. — С. 200 . — ISBN 5-7155-0292-6 .
- Le Caër S. (англ.) // Water : journal. — 2011. — Vol. 3 . — P. 236 . 23 марта 2014 года.
- , с. 2.
- Перевод тут близок к первому: Земля людей (Перевод Горация Велле). VII. В сердце пустыни // Антуан де Сент-Экзюпери. Земля людей / Пер. с фр. под ред. Е. Зониной. — М. : Государственное издательство художественной литературы , 1957. — С. 181. — (Зарубежный роман XX века). — 165 000 экз.
- Дата обращения: 8 сентября 2020. 20 сентября 2020 года.
- Jane Platt, Brian Bell. . NASA (3 апреля 2014). Дата обращения: 3 апреля 2014. 3 апреля 2014 года.
- Iess, L.; Stevenson, D.J.; Parisi, M.; Hemingway, D.; Jacobson, R.A.; Lunine, J.I.; Nimmo, F.; Armstrong, J.w.; Asmar, S.w.; Ducci, M.; Tortora, P. (англ.) // Science : journal. — 2014. — 4 April ( vol. 344 ). — P. 78—80 . — doi : . 6 апреля 2014 года.
- Solanki, S. K.; Livingston, W.; Ayres, T. New Light on the Heart of Darkness of the Solar Chromosphere (англ.) // Science : journal. — 1994. — Vol. 263 , no. 5143 . — P. 64—66 . — doi : . — . — .
- . Planetary Society (3 июля 2008). Дата обращения: 5 июля 2008. 17 января 2010 года.
- Bertaux, Jean-Loup; Vandaele, Ann-Carine; Korablev, Oleg; Villard, E.; Fedorova, A.; Fussen, D.; Quémerais, E.; Belyaev, D.; Mahieux, A. A warm layer in Venus' cryosphere and high-altitude measurements of HF, HCl, H 2 O and HDO (англ.) // Nature : journal. — 2007. — Vol. 450 , no. 7170 . — P. 646—649 . — doi : . — . — .
- Sridharan, R.; S.M. Ahmed, Tirtha Pratim Dasa, P. Sreelathaa, P. Pradeepkumara, Neha Naika, and Gogulapati Supriya. 'Direct' evidence for water in the sunlit lunar ambience from CHACE on MIP of Chandrayaan I (англ.) // Planetary and Space Science : journal. — 2010. — Vol. 58 , no. 6 . — P. 947 . — doi : . — .
- Donald Rapp. . — Springer, 28 November 2012. — P. 78–. — ISBN 978-3-642-32762-9 . 15 июля 2016 года.
- Atreya, Sushil K.; Wong, Ah-San. (англ.) // Space Science Reviews : journal. — Springer , 2005. — Vol. 116 . — P. 121—136 . — ISSN . — doi : . — . 22 июля 2011 года.
- Jia-Rui C. Cook, Rob Gutro, Dwayne Brown, J. D. Harrington, Joe Fohn. . NASA (12 декабря 2013). Дата обращения: 12 декабря 2013. Архивировано из 15 декабря 2013 года.
- , p. 92.
- Hubbard, W. B. Neptune's Deep Chemistry (англ.) // Science. — 1997. — Vol. 275 , no. 5304 . — P. 1279—1280 . — doi : . — .
- Земля (планета) — статья из Большой советской энциклопедии .
- от 24 августа 2013 на Wayback Machine 12 July 2007 By Laura Blue, Time
- . Дата обращения: 12 апреля 2014. 8 марта 2014 года.
- . Компьюлента (24 февраля 2012). — «Новые наблюдения транзитов GJ 1214 b, удалённой от Земли на 40 световых лет, показали, что вода должна составлять не менее половины от всей массы атмосферы этой «суперземли»». Дата обращения: 21 июля 2013. 29 августа 2013 года.
- Watson, P. E. et al. (1980) Total body water volumes for adult males and females estimated from simple anthropometric measurements, The American Journal for Clinical Nutrition, Vol. 33, № 1, pp. 27—39.
- Моргунова Г. С. Вода, которую мы пьём // Химия и жизнь . — 1965. — № 3 . — С. 15—17 .
- Sharma B. K. . — 1994. — P. 408—409. 10 июля 2014 года.
- Воскресенский В. А., Дьяков В. И. Глава 2. Смазочные вещества и их физико-химические свойства // Расчет и проектирование опор скольжения (жидкостная смазка): Справочник. — М. : Машиностроение , 1980. — С. 15. — (Библиотека конструктора). — ISBN ББК 34.42, УДК 621.81.001.2 (031).
- . ТАСС . Дата обращения: 26 апреля 2016. 4 мая 2016 года.
- 2021-03-14
- 2










































































