Чернов, Гелий Васильевич
- 1 year ago
- 0
- 0

| 2 |
Гелий
|
|
|
|
| 1s 2 | |
Ге́лий ( химический символ — He , лат. He lium ) — химический элемент 18-й группы (по устаревшей классификации — главной подгруппы восьмой группы, VIIIA) первого периода периодической системы химических элементов Д. И. Менделеева , с атомным номером 2.
Простое вещество , гелий — инертный одноатомный газ без цвета , вкуса и запаха .
По распространённости во Вселенной и по лёгкости занимает второе место после водорода . Его температура кипения — самая низкая среди всех известных веществ.

18 августа 1868 года французский учёный Пьер Жансен , находясь во время полного солнечного затмения в индийском городе Гунтур , впервые исследовал хромосферу Солнца . Жансену удалось настроить спектроскоп таким образом, чтобы спектр короны Солнца можно было наблюдать не только при затмении, но и в обычные дни. На следующий же день спектроскопия солнечных протуберанцев наряду с линиями водорода — синей, зелёно-голубой и красной — выявила очень яркую жёлтую линию, первоначально принятую Жансеном и другими наблюдавшими её астрономами за линию D натрия . Жансен немедленно написал об этом во Французскую академию наук . Впоследствии было установлено, что ярко-жёлтая линия в солнечном спектре не совпадает с линией натрия и не принадлежит ни одному из ранее известных химических элементов .
Спустя два месяца, 20 октября, английский астроном Норман Локьер , не зная о разработках французского коллеги, также провёл исследования солнечного спектра. Обнаружив неизвестную жёлтую линию с длиной волны 588 нм (более точно — 587,56 нм ), он обозначил её D 3 , так как она была очень близко расположена к фраунгоферовым линиям D 1 (589,59 нм ) и D 2 (588,99 нм ) натрия. Спустя два года Локьер совместно с английским химиком Эдуардом Франклендом , в сотрудничестве с которым он работал, предложил дать новому элементу название «гелий» (от др.-греч. ἥλιος — «солнце») .
Интересно, что письма Жансена и Локьера пришли во Французскую Академию наук в один день — 24 октября 1868 года, однако письмо Локьера, написанное им четырьмя днями ранее, пришло на несколько часов раньше. На следующий день оба письма были зачитаны на заседании Академии. В честь нового метода исследования протуберанцев Французская академия решила отчеканить медаль. На одной стороне медали были выбиты портреты Жансена и Локьера над скрещёнными ветвями лавра , а на другой — изображение мифологического бога света Аполлона , правящего в колеснице четвёркой коней, скачущей во весь опор .
В 1881 году итальянец Луиджи Пальмьери опубликовал сообщение об открытии им гелия в вулканических газах фумарол . Он исследовал светло-жёлтое маслянистое вещество, оседавшее из газовых струй на краях кратера Везувия . Пальмьери прокаливал этот вулканический продукт в пламени бунзеновской горелки и наблюдал спектр выделявшихся при этом газов. Учёные круги встретили это сообщение с недоверием, так как свой опыт Пальмьери описал неясно. Спустя многие годы в составе фумарольных газов действительно были найдены небольшие количества гелия и аргона .
Через 27 лет после своего первоначального открытия гелий был обнаружен на Земле — в 1895 году шотландский химик Уильям Рамзай , исследуя образец газа, полученного при разложении минерала клевеита , обнаружил в его спектре ту же ярко-жёлтую линию, найденную ранее в солнечном спектре. Образец был направлен для дополнительного исследования известному английскому учёному-спектроскописту Уильяму Круксу , который подтвердил, что наблюдаемая в спектре образца жёлтая линия совпадает с линией D 3 гелия. 23 марта 1895 года Рамзай отправил сообщение об открытии им гелия на Земле в Лондонское королевское общество , а также во Французскую академию через известного химика Марселена Бертло .
Шведские химики П. Клеве и смогли выделить из клевеита достаточно газа, чтобы установить атомный вес нового элемента .
В 1896 году Генрих Кайзер , , а в 1898 году окончательно доказали присутствие гелия в атмосфере .
Ещё до Рамзая гелий выделил также американский химик ( англ. Hillebrand ), однако он ошибочно полагал, что получил азот , и в письме Рамзаю признал за ним приоритет открытия.
Исследуя различные вещества и минералы, Рамзай обнаружил, что гелий в них сопутствует урану и торию . В 1906 году Э. Резерфорд и Т. Ройдс установили, что альфа-частицы радиоактивных элементов представляют собой ядра гелия . Эти исследования положили начало современной теории строения атома .

В 1908 году нидерландский физик Хейке Камерлинг-Оннес получил жидкий гелий . Он использовал дросселирование (см. Эффект Джоуля — Томсона ), после того как газ был предварительно охлаждён в кипевшем под вакуумом жидком водороде. Попытки получить твёрдый гелий ещё долго оставались безуспешными даже при температуре в 0,71 K , которую достиг ученик Камерлинг-Оннеса — немецкий физик Виллем Хендрик Кеезом . В 1926 году, применив давление выше 35 атм и охладив сжатый гелий в кипящем под разрежением жидком гелии, он выделил кристаллы .
В 1932 году Кеезом исследовал характер изменения теплоёмкости жидкого гелия с температурой. Он обнаружил, что около 2,19 K медленный и плавный подъём теплоёмкости сменяется резким падением, и кривая теплоёмкости приобретает форму греческой буквы λ (лямбда). Отсюда температуре, при которой происходит скачок теплоёмкости, присвоено условное название « λ -точка » . Более точное значение температуры в этой точке, установленное позднее, — 2,172 K . В λ -точке происходят глубокие и скачкообразные изменения фундаментальных свойств жидкого гелия — одна фаза жидкого гелия сменяется в этой точке на другую, причём без выделения скрытой теплоты; имеет место фазовый переход II рода . Выше температуры λ -точки существует так называемый гелий-I , а ниже её — гелий-II .
В 1938 году советский физик Пётр Леонидович Капица открыл явление сверхтекучести жидкого гелия-II , которое заключается в резком снижении коэффициента вязкости , вследствие чего гелий течёт практически без трения . Вот что он писал в одном из своих докладов про открытие этого явления :
… такое количество тепла, которое фактически переносилось, лежит за пределами физических возможностей, что тело ни по каким физическим законам не может переносить больше тепла, чем его тепловая энергия, помноженная на скорость звука. С помощью обычного механизма теплопроводности тепло не могло переноситься в таком масштабе, как это наблюдалось. Надо было искать другое объяснение.
И вместо того, чтобы объяснить перенос тепла теплопроводностью, то есть передачей энергии от одного атома к другому, можно было объяснить его более тривиально — конвекцией, переносом тепла в самой материи. Не происходит ли дело так, что нагретый гелий движется вверх, а холодный опускается вниз, благодаря разности скоростей возникают конвекционные токи, и таким образом происходит перенос тепла. Но для этого надо было предположить, что гелий при своем движении течет без всякого сопротивления. У нас уже был случай, когда электричество двигалось без всякого сопротивления по проводнику. И я решил, что гелий так же движется без всякого сопротивления, что он является не сверхтеплопроводным веществом, а сверхтекучим.
… Если вязкость воды равняется 10⋅10 −2 П , то это в миллиард раз более текучая жидкость, чем вода …
Название произошло от греч. ἥλιος — «Солнце» (см. Гелиос ). В названии элемента было использовано характерное для металлов окончание «-ий» (на лат. «-um» — «Helium»), так как Локьер предполагал, что открытый им элемент является металлом. По аналогии с другими благородными газами логично было бы дать ему имя «гелион» («Helion») . В современной науке название « гелион » закрепилось за ядром лёгкого изотопа гелия — гелия-3 .
Гелий занимает второе место по распространённости во Вселенной после водорода — около 23 % по массе . Однако на Земле этот элемент редок. Практически весь гелий Вселенной образовался в первые несколько минут после Большого взрыва , во время первичного нуклеосинтеза . В современной Вселенной почти весь новый гелий образуется в результате термоядерного синтеза из водорода в недрах звёзд (см. протон-протонный цикл , углеродно-азотный цикл ). На Земле он образуется в результате альфа-распада тяжёлых элементов ( альфа-частицы , излучаемые при альфа-распаде, — это ядра гелия-4) . Часть гелия, возникшего при альфа-распаде и просачивающегося сквозь породы земной коры , захватывается природным газом , концентрация гелия в котором может достигать 7 % от объёма и выше.
В рамках восемнадцатой группы гелий по содержанию в земной коре занимает второе место (после аргона ) .
Содержание гелия в атмосфере (образуется в результате распада тория , урана и их дочерних радионуклидов) — 5,27⋅10 −4 % по объёму, 7,24⋅10 −5 % по массе . Запасы гелия в атмосфере , литосфере и гидросфере оцениваются в 5⋅10 14 м³ . Гелионосные природные газы содержат, как правило, до 2 % гелия по объёму. Исключительно редко встречаются скопления газов, гелиеносность которых достигает 8—16 % .
Среднее содержание гелия в земном веществе — 0,003
мг/кг
, или 0,003
г/т
. Наибольшая концентрация гелия наблюдается в минералах, содержащих уран, торий и
самарий
:
клевеите
,
,
самарските
,
гадолините
,
монаците
(
в Индии и Бразилии),
торианите
. Содержание гелия в этих минералах составляет
0,8—3,5 л/кг
, а в торианите оно достигает 10,5
л/кг
. Этот гелий является радиогенным и содержит лишь изотоп
4
He
, он образуется из альфа-частиц, излучаемых при альфа-распаде урана, тория и их дочерних радионуклидов, а также других природных альфа-активных элементов (самарий, гадолиний и т. д.).
В 2016 году норвежские и британские ученые обнаружили залежи гелия в районе озера Виктория в Танзании. По примерным оценкам экспертов, объём запасов — 1,5 млрд кубических метров .
Значительные запасы гелия содержатся в восточносибирских газовых месторождениях в России. Запасы гелия в Ковыктинском месторождении оцениваются в 2,3 млрд кубометров , в Чаяндинском месторождении — в 1,4 млрд кубометров .
Гелий извлекают из природного и нефтяного газов; мировые запасы оцениваются в 45,6 млрд м³ .
Мировой рынок гелия — 170—190 млн м³/год Основная доля мирового производства гелия приходится на США и Катар ; с 2015 года доля Соединённых Штатов в мировом производственном балансе снизилась с 67 % до примерно 56 % и продолжает сокращаться, Катар и Алжир занимают соответственно около 28 и 9 % рынка.
Россия сама обеспечивает себя этим газом; внутренний спрос на 2020 год не превышал 5 млн м³ . До последнего времени практически весь гелий производился на гелиевом заводе ООО « Газпром добыча Оренбург » из газа с низким содержанием гелия (до 0,055 % об.), поэтому имел высокую себестоимость.
9 июня 2021 года возле города Свободный Амурской области состоялся запуск крупнейшего в мире по производству гелия Амурского газоперерабатывающего завода мощностью 60 млн м³ гелия в год . Ресурсной базой для него служит газ Чаяндинского месторождения с содержанием гелия на порядок более высоким — что позволяет намного снизить его себестоимость. Россия с 2021 года планирует стать одним из крупнейших экспортёров гелия .
С 2018 года Иркутская нефтяная компания ведет строительство двух гелиевых заводов в Иркутской области. Плановая мощность — 15-17 млн л гелия в год, запуск первого завода — 2022 год.
Актуальной проблемой является дальнейшее освоение и комплексная переработка природных газов крупных месторождений Восточной Сибири , отличающихся сходным с Чаяндинским высоким содержанием гелия (0,15—1 % об.).
Гелий добывается из природного газа процессом низкотемпературного разделения — фракционной дистилляцией либо путём мембранного газоразделения .
В промышленности гелий получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие более 0,1 % гелия). От других газов гелий отделяют методом глубокого охлаждения, используя то, что он сжижается труднее всех остальных газов.
Охлаждение производят дросселированием в несколько стадий, очищая его от CO 2 и углеводородов . В результате получается смесь гелия, неона и водорода. Эту смесь, так называемый сырой гелий (70—90 % гелия по объёму) очищают от водорода (4—5 %) с помощью CuO при 650—800 К .
Окончательная очистка достигается охлаждением оставшейся смеси кипящим под вакуумом N 2 и адсорбцией примесей на активированном угле в адсорберах , также охлаждаемых жидким N 2 . Производят гелий технической чистоты (99,80 % гелия по объёму) и высокой чистоты (99,985 %).
Качественно гелий определяют с помощью анализа спектров испускания (характеристические линии 587,56 нм и 388,86 нм ), количественно — масс-спектрометрическими и хроматографическими методами анализа, а также методами, основанными на измерении физических свойств (плотности, теплопроводности и др.) .


Гелий — практически инертный химический элемент.
Простое вещество
гелий нетоксично, не имеет цвета, запаха и вкуса. При нормальных условиях представляет собой одноатомный газ. Его точка кипения (
T
= 4,215 K
для
4
He
) наименьшая среди всех веществ;
твёрдый гелий
получен лишь при давлениях выше 25
атмосфер
— при атмосферном давлении он не переходит в твёрдую фазу даже при
абсолютном нуле
. Экстремальные условия также необходимы для создания немногочисленных химических соединений гелия, все они нестабильны при
нормальных условиях
.
Гелий 3 Не и 4 Не не имеют основной тройной точки (в которой равновесные фазы находятся в различных агрегатных состояниях — твёрдом , жидком и газообразном ) — в обоих случаях линии равновесия твёрдой фазы с жидкими (Не I и Не II) и жидких фаз с газообразной нигде не пересекаются: твёрдая фаза находится в равновесии только с жидкой . Другие вещества с такой особенностью неизвестны . Наличие на фазовой диаграмме гелия кривой сосуществования твёрдой и жидкой фаз и отсутствие на диаграмме кривой сосуществования твёрдой и газовой фаз означает, что твёрдый гелий может плавиться, но не может испаряться .
Гелий — наименее химически активный элемент 18-й группы (
инертные газы
) и вообще всей
таблицы Менделеева
. Все химические соединения гелия (как и аргона, неона) существуют только в виде так называемых
эксимерных молекул
(крайне нестабильных), у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние. Гелий образует двухатомные молекулы He
+
2
, фторид HeF, хлорид HeCl (
эксимерные
молекулы образуются при действии электрического разряда или
ультрафиолетового излучения
на смесь гелия с
фтором
или
хлором
).
Также существует возможность связи атома гелия силами Ван-дер-Ваальса , например, с молекулой фуллерена или с атомом неона , однако в таких структурах другие атомы не влияют на электронную структуру атома гелия .
В 2013 году вышла работа международного коллектива учёных под руководством Артёма Романовича Оганова о теоретической возможности существования соединения гелия с натрием состава Na 2 He при давлениях выше 113 ГПа (наиболее стабильная структура Na 2 He обнаружена при 300 ГПа, доказана механическую стабильность этого соединения до 500 ГПа ), а также на алмазных наковальнях на практике доказано существование данного соединения. Данное соединение представляет собой электрид, с локализованными в междоузлиях электронными парами, образующими восьмицентровые двухэлектронные связи внутри пустых кубов Na 8 . Также предсказано существование Na 2 HeO с аналогичной структурой при давлениях выше 15 ГПа . Известны и иные соединения гелия, все они стабильны при сверхвысоких давлениях — Li 5 He 2 , соединения гелия с азотом . Существуют теоретические работы, предсказывающие соединений гелия с железом (например FeHe 2 ) в недрах планет-гигантов и белых карликов , а учёт устойчивости соединений гелия с кремнием (HeSiO 2 ) при давлениях 600-4000 ГПа помогут создавать более сложные внутренние модели планет-гигантов .
Энергия связи молекулярного иона гелия He
+
2
составляет 58
ккал/моль
, равновесное
межъядерное расстояние
— 1,09
Å
.
При нормальных условиях гелий ведёт себя практически как идеальный газ . При всех условиях гелий является моноатомным веществом. При стандартных условиях (ст.у.: 0 °C, 10 5 Па) его плотность составляет 0,17847 кг/м³ , он обладает теплопроводностью 0,1437 Вт/(м·К) , а его удельная теплоёмкость чрезвычайно высока: с р = 5,193 кДж/(кг·К) ; для сравнения — для Н 2 она равна 14,23 кДж/(кг·К) . Удельная теплоёмкость при постоянном объёме с v = 3,116 кДж/(кг·К) (ст.у.) . Скорость звука в гелии равна 972,8 м/с (ст.у.) . Таким образом, теплопроводность, удельная теплоёмкость, скорость звука и удельный объём (величина, обратная плотности) у гелия больше, чем у всех других газов, за исключением водорода .

Гелий менее растворим в воде, чем любой другой известный газ. В 1 л воды при 20 °C растворяется около 8,8 мл (9,78 при 0 °C , 10,10 при 80 °C ), в этаноле — 2,8 мл/л при 15 °C и 3,2 мл/л при 25 °C .
Скорость диффузии сквозь твёрдые материалы , которая в первом приближении обратно пропорциональна корню из молекулярной массы, у гелия в три раза выше, чем у воздуха , и составляет приблизительно 65 % от скорости диффузии водорода .
Коэффициент преломления гелия ближе к единице, чем у любого другого газа при равных условиях. Например, для излучения с длиной волны 589,6 нм ( спектральная линия натрия D) показатель преломления (ст.у.) у гелия равен n D = 1 + 35·10 −6 , у водорода 1 + 132·10 −6 , у азота 1 + 298·10 −6 .
Этот газ имеет отрицательный коэффициент Джоуля — Томсона при нормальной температуре среды, то есть он нагревается при дросселировании через пористые перегородки или маленькие отверстия, но, как и все газы, охлаждается при любой температуре при адиабатическом расширении. Только ниже температуры инверсии Джоуля — Томсона (приблизительно 40 К при нормальном давлении) он остывает в процессе дросселирования.
После охлаждения ниже этой температуры гелий может быть превращён в жидкость при расширительном охлаждении. Такое охлаждение производится при помощи детандера .


При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску. По мере уменьшения давления происходит смена цветов на розовый, оранжевый, жёлтый, ярко-жёлтый, жёлто-зелёный и зелёный. Это связано с присутствием в спектре гелия нескольких серий линий, расположенных в диапазоне между инфракрасной и ультрафиолетовой частями спектра. Важнейшие линии гелия в видимой части спектра лежат между 706,62 нм и 447,14 нм . Уменьшение давления приводит к увеличению длины свободного пробега электрона , то есть к возрастанию его энергии при столкновении с атомами гелия. Это приводит к переводу атомов в возбуждённое состояние с бо́льшей энергией, в результате чего и происходит смещение спектральных линий от красного к фиолетовому краю видимого спектра.
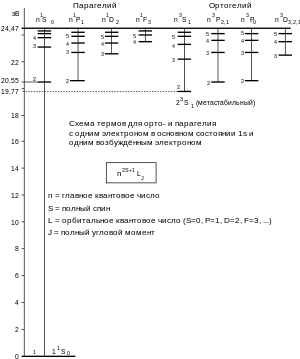
Хорошо изученный спектр гелия имеет два резко различных набора серий линий — единичных ( 1 S 0 ) и триплетных ( 3 S 1 ), поэтому в конце XIX века Локьер , Рунге и Пашен предположили, что гелий состоит из смеси двух газов; один из них, по их предположению, имел в спектре жёлтую линию 587,56 нм , другой — зелёную 501,6 нм . Этот второй газ они предложили назвать астерием ( Asterium ) от греч. «звёздный». Однако Рамзай и Траверс показали, что спектр гелия зависит от условий: при давлении газа 7—8 мм рт. ст. наиболее ярка жёлтая линия; при уменьшении давления увеличивается интенсивность зелёной линии. Спектры атома гелия были объяснены Гейзенбергом в 1926 году (см. Обменное взаимодействие ). Спектр зависит от взаимного направления спинов электронов в атоме — атом с противоположно направленными спинами (дающий зелёную линию в оптических спектрах) получил название парагелия , с сонаправленными спинами (с жёлтой линией в спектре) — ортогелия . Линии парагелия — одиночные, линии ортогелия — весьма тесные триплеты. Атом гелия в нормальных условиях находится в одиночном ( синглетном ) состоянии. Чтобы атом гелия перевести в триплетное состояние, нужно затратить работу в 19,77 эВ . Переход атома гелия из триплетного состояния в синглетное сам по себе осуществляется чрезвычайно редко. Такое состояние, из которого переход в более глубокое сам по себе маловероятен, носит название метастабильного состояния . Вывести атом из метастабильного состояния в стабильное можно, подвергая атом внешнему воздействию, например, электронным ударом или при столкновении с другим атомом с передачей последнему непосредственно энергии возбуждения . В атоме парагелия (синглетного состояния гелия) спины электронов направлены противоположно и суммарный спиновый момент равен нулю. В триплетном состоянии (ортогелий) спины электронов сонаправлены, суммарный спиновый момент равен единице. Принцип Паули запрещает двум электронам находиться в состоянии с одинаковыми квантовыми числами, поэтому электроны в низшем энергетическом состоянии ортогелия, имея одинаковые спины, вынуждены иметь различные главные квантовые числа : один электрон находится на 1 s -орбитали, а второй — на более удалённой от ядра 2 s -орбитали (состояние оболочки 1 s 2 s ). У парагелия оба электрона находятся в 1 s -состоянии (состояние оболочки 1 s 2 ).
Спонтанный (то есть сопровождающийся изменением суммарного спина) переход с излучением фотона между орто- и парагелием чрезвычайно сильно подавлен, однако возможны безызлучательные переходы при взаимодействии с налетающим электроном или другим атомом.
В бесстолкновительной среде (например, в межзвёздном газе ) спонтанный переход из нижнего состояния ортогелия 2 3 S 1 в основное состояние парагелия 1 0 S 1 возможен путём или в результате однофотонного магнитно-дипольного перехода (M1). В этих условиях расчётное время жизни атома ортогелия за счёт двухфотонного распада 2 3 S 1 → 1 0 S 1 + 2 γ составляет 2,49⋅10 8 с , или 7,9 года . Первые теоретические оценки показывали , что время жизни за счёт магнитно-дипольного перехода на порядки больше, то есть что доминирует двухфотонный распад. Лишь через три десятилетия, после неожиданного открытия запрещённых триплетно-синглетных переходов некоторых подобных гелию ионов в спектрах солнечной короны , было обнаружено , что однофотонный магнитно-дипольный распад 2 3 S 1 -состояния значительно более вероятен; время жизни при распаде по этому каналу составляет «всего» 8⋅10 3 с .
Время жизни первого возбуждённого состояния атома парагелия 2 0 S 1 также крайне велико по атомным масштабам. Правила отбора для этого состояния запрещают однофотонный переход 2 0 S 1 → 1 0 S 1 + γ , а для двухфотонного распада время жизни составляет 19,5 мс .
В 1908 году Х. Камерлинг-Оннес впервые смог получить жидкий гелий . Твёрдый гелий удалось получить лишь под давлением 25 атмосфер при температуре около 1 K ( В. Кеезом , 1926). Кеезом также открыл наличие фазового перехода гелия-4 при температуре 2,17 K ; он назвал фазы гелий-I и гелий-II (ниже 2,17 K ). В 1938 году П. Л. Капица обнаружил, что у гелия-II отсутствует вязкость (явление сверхтекучести ). В гелии-3 сверхтекучесть возникает лишь при температурах ниже 0,0026 К . Сверхтекучий гелий относится к классу так называемых квантовых жидкостей , макроскопическое поведение которых может быть описано только с помощью квантовой механики .
В 2004 году появилось сообщение об открытии сверхтекучести твёрдого гелия (т. н. эффект суперсолид ) при исследовании его в торсионном осцилляторе, однако многие исследователи сходятся во мнении, что обнаруженный в 2004 году эффект не имеет ничего общего со сверхтекучестью кристалла. В настоящее время продолжаются многочисленные экспериментальные и теоретические исследования, целью которых является понимание истинной природы данного явления. [ источник не указан 1362 дня ]
Природный гелий состоит из двух стабильных
изотопов
:
4
He
(
изотопная распространённость
— 99,99986 %) и гораздо более редкого
3
He
(0,00014 %; содержание гелия-3 в разных природных источниках может варьироваться в довольно широких пределах). Известны ещё шесть искусственных радиоактивных изотопов гелия.

Для транспортировки газообразного гелия используются стальные баллоны ( ГОСТ 949-73) коричневого цвета, помещаемые в специализированные контейнеры. Для перевозки можно использовать все виды транспорта при соблюдении соответствующих правил перевозки газов.
Для перевозки жидкого гелия применяются специальные транспортные сосуды Дьюара типа СТГ-10, СТГ-25 и т. п. светло-серого цвета объёмом 10, 25, 40, 250 и 500 литров , соответственно. При выполнении определённых правил транспортировки может использоваться железнодорожный , автомобильный и другие виды транспорта . Сосуды с жидким гелием обязательно должны храниться в вертикальном положении.
Гелий широко используется в промышленности и народном хозяйстве:
Кроме того, нуклид
3
He
используется как рабочее вещество газовых нейтронных детекторов, в том числе
, в технике
в качестве
поляризатора
. Гелий-3 является также перспективным топливом для
термоядерной энергетики
. Растворение гелия-3 в гелии-4 используется для получения сверхнизких температур.
Гелий — удобный индикатор для геологов . При помощи гелиевой съёмки можно определять на поверхности Земли расположение глубинных разломов . Гелий как продукт распада радиоактивных элементов , насыщающих верхний слой земной коры , просачивается по трещинам, поднимается в атмосферу. Около таких трещин и особенно в местах их пересечения концентрация гелия более высокая. Это явление было впервые установлено советским геофизиком И. Н. Яницким во время поисков урановых руд . Эта закономерность используется для исследования глубинного строения Земли и поиска руд цветных и редких металлов .
Также гелий может использоваться для выявления геотермальных источников . Согласно опубликованным исследованиям, концентрации гелия в почвенном газе над геотермальными источниками превышает фоновые значения в 20—200 раз .
Повышенные концентрации гелия в почвенном газе могут указывать на наличие залежей урана
В честь гелия назван астероид (895) Гелио , открытый в 1918 году.
Гелий, насколько это известно, не несёт какой-либо биологической функции.
Вдыхание гелия может быть опасно для здоровья в связи с тем, что в лёгкие не попадает кислород, однако гелиокс и тримикс (кислород, азот, гелий) считаются относительно безопасными дыхательными смесями .