Лав-Канал
- 1 year ago
- 0
- 0

| Трихлорэтилен | |
|---|---|
|
|
| Химическое соединение | |
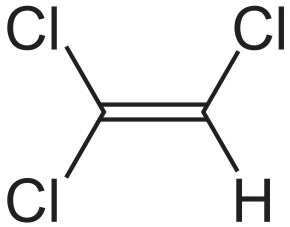
| Брутто-формула | C 2 HCl 3 |
| CAS | |
| PubChem | |
| DrugBank | |
| Состав | |
| Классификация | |
| АТХ | |
| Другие названия | |
| Трихлорэтилен для наркоза | |
Трихлорэтилен
(
Trichloraetylenum
), трихлорэтен —
хлорорганическое соединение
, бесцветная, прозрачная, подвижная, летучая жидкость со сладким запахом, напоминающим запах хлороформа, и сладким, жгучим вкусом. Приблизительно в полтора раза плотнее воды.
Хорошо смешивается с органическими растворителями. Практически нерастворим в воде.
Трудногорюч (в нормальных условиях не воспламеняется и не взрывается).
Под действием света и воздуха разлагается с образованием
фосгена
и галогенсодержащих
кислот
, при этом приобретает розовое окрашивание. Для стабилизации трихлорэтилена к нему добавляют 0,01 %
тимола
или 0.001%
фенола
.
Наркотик, токсичен.
Трихлорэтилен используется в промышленности в качестве растворителя и сырья для органического синтеза.
В нормальных условиях трихлорэтилен находится в жидкой фазе. Замерзает при -73 °C, кипит при 86,7 °C .
Относительная плотность 1,462—1,466, 1,4642 .
Теплопроводность жидкости: 0,142 Вт/м·К при -40 °C, 0,138 Вт/м·К при 20 °C, 0,099 Вт/м·К при 80 °C . Теплопроводность пара: 0,00833 Вт/м·К при 86,7 °C .
Трихлорэтилен с водой образует азеотропную смесь с температурой кипения 73 °C (73 % трихлорэтилена, 7 % воды). В воде плохо растворяется, массовая доля в растворе от 0,017 % до 0,125 % в диапазоне температур 10–60 °C .
Трихлорэтилен нельзя хранить на свету, так как в присутствии кислорода воздуха он разлагается с образованием токсичного (и воспламеняющегося) продукта - дихлорацетилена , который, в свою очередь, разлагается на фосген , угарный газ и хлороводород . Реакцию катализируют пары йода , минеральные кислоты и натронная известь . [ источник не указан 1296 дней ]
При окислении трихлорэтилена
озоном
образуются фосген,
хлористый водород
и
оксиды углерода
.
При окислении трихлорэтилена
кислородом
образуется окись трихлорэтилена и
дихлорацетилхлорид
.
В присутствии катализаторов и при высоких температурах может образовывать другие хлорорганические соединения, чаще предельного строения.
В присутствии хлорида алюминия трихлорэтилен взаимодействует с хлороводородом , при этом происходит конденсация , полимеризация и осмоление .
Взаимодействует с фтором , хлором , бромом с образованием 1,2-дигалоген-1,2,2-трихлорэтанов. При хлорировании превращается в пентахлорэтан . С йодом не реагирует .
Трихлорэтилен получают путём каталитического высокотемпературного хлорирования отходов производства винилхлорида или дихлорэтана (смесь хлорэтанов и хлорэтиленов ). Также получают из дихлорэтана и других отдельных соединений. Температуры каталитического хлорирования — от 350° до 450 °С в зависимости от состава сырья и катализатора .
Являясь хорошим растворителем, трихлорэтилен широко применяется в промышленности и быту. Используется для улучшения свойств инсектицидов . Применяется для обезжиривания металлов, для химической чистки тканей .
Используется в органическом синтезе для очистки полученных веществ и в качестве полупродукта. Добавляется в инсектициды для улучшения их свойств. Используется при синтезе лекарств, например, является промежуточным продуктом при синтезе левомицетина .
На основе трихлорэтилена разработаны удобные процессы получения разнообразных веществ. С его помощью изготавливают пестициды и инсектициды, среди его производных — огнезащитные агенты, пламегасители, регуляторы молекулярного веса в производстве синтетических материалов, полилактоны .
Трихлорэтилен является токсичным наркотическим веществом . Накапливается в организме, представляет опасность для сердечно-сосудистой и нервной систем, органов дыхания, зрения. При продолжительном воздействии на кожу вызывает её повреждение и дерматиты .
Трихлорэтилен до 500% повышает риск развития болезни Паркинсона
В организм человека трихлорэтилен, помимо проглатывания, может попадать при дыхании, проникает через кожу .
Предельно допустимая концентрация (ПДК) паров трихлорэтилена в атмосферном воздухе 1 мг/м³ (максимальная разовая — 4 мг/м³). Имеет третий класс опасности по ГОСТ 12.1.005. ПДК в воде — 0,06 мг/дм³ .
По данным ПДК в воздухе рабочей зоны равна 10 мг/м 3 среднесменная и 30 мг/м 3 максимально разовая. Порог восприятия запаха может достигать 538 мг/м 3 и 440-580 мг/м 3 . Соответственно, замена противогазных фильтров у СИЗОД по ощущению появления запаха в маске (как это советуют поставщики респираторов) приведёт к тому, что хотя бы часть работников будет менять фильтры запоздало. Необходимо использовать современные безопасные способы .
Ранее трихлорэтилен применялся для наркоза и обезболивания в качестве ингаляционного анестетика . В большинстве стран, в том числе в России, в этом качестве ныне не используется .
Ототоксичен (может ухудшать слух) .
Трихлорэтилен хранится в сухом, прохладном, защищённом от света месте. [ источник не указан 1296 дней ]