Дифтордихлорметан
- 1 year ago
- 0
- 0
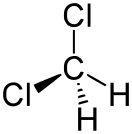
Дихлормета́н (метилѐнхлори́д, хлóристый метилéн, ДХМ, фреон 30, хладон 30) — органическое соединение с формулой CH 2 Cl 2 , двукратно замещённый галогеналкан , производное метана , прозрачная легкоподвижная и легколетучая жидкость с характерным для галогенпроизводных запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету.
Получают прямым хлорированием метана хлором в условиях при 400—500 °C при соотношении, равном 5:1:
Общая реакция:
В результате получается смесь всех возможных хлоридов: хлорметан , дихлорметан, хлороформ и четырёххлористый углерод , которые потом разделяются ректификацией .
Растворимость в воде 2 % по массе (20 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °C), образует азеотропную смесь с водой (т.кип. 38,1 °C, 98,5 % дихлорметана). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористого углерода . С иодом при 200 °C даёт СН 2 I 2 , с бромом при 25—30 °C в присутствии алюминия — . При нагревании с водой гидролизуется до и . При нагревании со спиртовым раствором NH 3 до 100—125 °C образует гексаметилентетрамин . Реакция с водным раствором NH 3 при 200 °C приводит к метиламину , муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlCl 3 метиленхлорид вступает в реакцию Фриделя — Крафтса , например с бензолом образует дифенилметан .
Дешевизна, высокая способность растворять многие органические вещества , лёгкость удаления, относительно малая токсичность привела к широкому применению его как растворителя для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности его используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Также нашёл применение для растворения смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов .
Также используется в хроматографии .
В промышленности в смеси с полимерами используют для создания формы, которая быстро застывает за счёт испарения дихлорметана. Он также используется для склеивания пластмасс: полистирола , поликарбонатов , полиэтилентерефталата , АБС-пластиков , и некоторых других. Ввиду высокой летучести дихлорметана его применение в склеивании полипропилена и полиэтилена ограничено.
Дихлорметан используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент , в качестве хладагента .
Контакт дихлорметана с щелочными металлами приводит к взрыву. Работы с дихлорметаном следует проводить при работающей вытяжной вентиляции.
Дихлорметан способен вызвать наркоз . Он также токсичен: воздействует на печень , почки и селезёнку, способен проникать через кожу , гематоэнцефалический и плацентарный барьеры .
При остром отравлении при вдыхании дихлорметана наблюдаются раздражение слизистых оболочек глаз и верхних дыхательных путей, головокружение, головные боли, , рвота и понос . В случае тяжёлого отравления происходит потеря сознания вследствие наркоза вплоть до остановки дыхания. При хронических отравлениях наблюдаются постоянные головные боли, головокружение, потеря аппетита, поражение внутренних органов. Длительный покровный контакт с дихлорметаном может вызвать его накопление в жировых тканях и привести к ожогу . Также при длительной работе с ним возможно поражение печени и возникновение диабетической нейропатии .
В организме дихлорметан метаболизируется до монооксида углерода , что может вызвать интоксикацию данным веществом .
На крысах показано, что дихлорметан может вызывать рак лёгких, печени и поджелудочной железы .
В Евросоюзе запрещены краски с дихлорметаном как для личного пользования, так и для профессионального применения.
Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые .
ПДК в рабочей зоне 50 мг/м³ (по ГОСТ 12.1.005-76), в воде водоёмов не более 7,5 мг/л. Концентрационный предел воспламенения 12—22 %. Не горюч, но поддерживает горение, от огня даёт вспышку, но не горит сам, горит в смеси с другими горящими материалами? внося свой вклад при пожаре, однако пролить на стол около спиртовки его не так опасно? как горючие растворители, скорее как масло [ источник не указан 2254 дня ] .