Изолированные кластеры
- 1 year ago
- 0
- 0
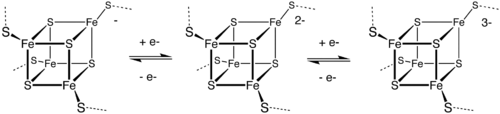

Железосерные кластеры (также Fe—S-кластеры ) — элементоорганические соединения , группа белковых кофакторов , обладающих окислительно-восстановительным (Red/Ox) потенциалом в районе от −500 м В до +300 мВ . Red/Ox-потенциал зависит от структуры и конформации белка, что делает эти кофакторы важнейшими участниками окислительно-восстановительных реакций в клетке . Железосерные кластеры способны принимать или отдавать электроны (см. рисунок). Белки, содержащие железосерные кластеры, являются эволюционно древними и распространены во всех царствах, включая животных, растения, грибы , бактерии и археи . Мутации по генам метаболизма Fe—S-кластеров являются причиной многих тяжёлых заболеваний или летальны.

На начальном этапе развития жизни Земля имела восстановительную атмосферу, отсутствовал кислород , вулканическая активность сопровождалась выбросами сероводорода, а в океане было растворено значительное количество двухвалентного железа . Как будет раскрыто ниже, из элементов именно в этих (Fe 2+ и S 2− ) степенях окисления синтезируются новые железосерные кластеры в клетках живых организмов . Предположительно, неорганические структуры, подобные железосерным кластерам, образовывались в таких условиях спонтанно, а древние живые организмы приспособили данные структуры, включив их в состав белковых молекул .
Способность переносить электроны у образовавшихся белков оказалась тесно связанной с обменом энергии в клетках, поэтому эти ферменты продолжали эволюционировать, и их гены закрепились во всех живых организмах.

Модельными организмами для изучения синтеза и передачи железосерных кластеров в клетке являются дрожжи S. cerevisiae , кишечная палочка ( E. coli ), сенная палочка ( B. subtilis ), резуховидка Таля ( A. thaliana ) и многие другие организмы; исследуются эти процессы и на клетках человека.
Для бактериальных организмов известно три системы белков, участвующих в синтезе железосерных кластеров :
Для эукариот выделяют четыре системы:
В качестве основного модельного организма для описания выберем дрожжи ( S. cerevisiae ), это необходимо, чтобы не создавать путаницу в названиях белков, гомологи которых в разных организмах называются по-разному.
Для непосредственного синтеза необходимо образование комплекса белков Nfs1 и Isu1. Nfs1, кроме функции образования комплекса, выступает в роли донора серы, которая передается с остатков Cys при участии пиридоксальфосфата в качестве кофактора. Isu1 крайне важен для сборки всего кластера, так как он принимает донируемые атомы серы и Fe 2+ и укладывает их необходимым образом для образования 2Fe—2S- или 4Fe—4S-кластеров за счёт собственных остатков Cys.[2,3]
У дрожжей также существует изоформа Isu2, образованная дупликацией гена Isu1. Обе изоформы могут принимать участие в синтезе кластеров.
Также показано, что для образования железосерных кластеров необходимо связывание Nfs1 с гораздо более мелким белком Isd11. Этот механизм возник эволюционно давно, так как присутствует во многих организмах.
Было показано, что источником железа является Yfh1 (у человека frataxin). Его связывание с собранным комплексом белков стимулирует формирование готового железосерного кластера на Isu1.
Ионы железа должны быть доставлены в митохондрии через малопроницаемую внутреннюю мембрану. Этот процесс осуществляется митохондриальными транспортерами Mrs3 и Mrs4, которые могут пропускать только Fe
2+
. Это железо и связывается Yfh1. Возможны и другие пути транспорта железа в
матрикс митохондрий
.
При создании кластера сера должна быть восстановлена до степени окисления −2. Электроны передаются от NADH через ферредоксин Yah1 и ферредоксин-редуктазу Arh1.
В изъятии сформированного кластера из Isu1 главную роль играет шаперон Ssq1 (из семейства HSP70), кошаперон Jac1 и фактор обмена нуклеотидов Mge1. Известно, что Jac1 активирует АТФазную активность Ssq1, эта энергия расходуется на взаимодействие с высококонсервативным участком Isu1, из-за чего Fe—S-кластеры оказываются доступны для передачи в другие белки. Фактор обмена нуклеотидов Mge1 нужен для извлечения АДФ из Ssq1 .
У бактерий фактор обмена нуклеотидов не обязателен.
Передача доступных кластеров с Isu1 к белкам-реципиентам может осуществляться напрямую или через белки-посредники, например Grx5.
Одни из важнейших белков, содержащих Fe—S-кластеры, в матриксе — аконитазы Aco1 и Lys4, биотинсинтаза Bio2 и синтаза липоевой кислоты Lip5. Передача кластеров к этим белкам осуществляется только при наличии белков Isa1 и Isa2, и связывающегося с ними обоими белка Iba57. Фенотипы грибов с подавленной экспрессией Isa1, Isa2, Iba57 схожи, а данные об их взаимодействии указывает на участие в одном процессе .
Митохондрии — двумембранные органеллы эукариотической клетки. Многие вещества плохо транспортируются сквозь гидрофобный слой мембран, поэтому для существуют сложные белки-переносчики, каналы и рецепторы. Как правило, наиболее сложной задачей является транспорт через внутреннюю мембрану митохондрий, на которой в норме поддерживается мембранный потенциал, необходимый для работы АТФ-синтазы . Для создания этого потенциала мембрана должна быть крайне слабо проницаемой даже для протонов. Естественно, что транспорт сквозь такую мембрану связан с повышенными трудностями.
Транспорт молекул весом менее 10 к Да сквозь внешнюю мембрану митохондрий осуществляется сквозь пори́н (белок VDAC), позволяющий проходить даже небольшим белкам. Наличие поринов во внешней мембране делает межмембранное пространство (ММП) схожим по составу с цитоплазмой, за исключением белкового состава.
Внешняя мембрана митохондрий гораздо более удобна для исследований, поэтому пути транспорта сквозь внутреннюю мембрану менее изучены.
На данный момент неизвестно, в составе каких молекул железосерные кластеры транспортируются из митохондрий[2,3], однако поиск этого переносчика представляется крайне интересной задачей, так как, помимо доставки кластеров, этот компонент может принимать участие в регуляции метаболизма клетки, в том числе в контроле концентрации железа в клетке и в митохондриях, а также влиять на транскрипцию и трансляцию целого ряда генов. Вместе с тем считается, что транспорт сквозь внутреннюю мембрану осуществляется сквозь Atm1 (белок из семейства АВС-транспортеров), который обладает АТФазной активностью. Эта активность увеличивалась при добавлении пептидов с доступными группами —SH цистеинов. Так как обычно активность ABC-транспортеров индуцируется транспортируемыми ими компонентами, вероятно, гипотетический переносчик содержит свободные группы —SH .
Транспорт облегчается сульфгидгидоксидазой Erv1, растворенной в межмембранном пространстве (ММП) митохондрий. Для Erv1, помимо каталитической активности, связанной с окислением групп —SH, показана возможность обеспечивать транспорт в ММП, обусловленный образованием связей S—S .
Третьим необходимым для транспорта из митохондрий компонентом является глутатион .
Для дрожжей предполагается отсутствие синтеза железосерных кластеров в цитоплазме , однако, в клетках млекопитающих синтез Fe—S-кластеров за пределами митохондрий протекает наравне с синтезом в митохондриях . При этом значение митохондриального синтеза оказывается выше, если судить по реакции клеток в ответ на пониженный объём синтеза (запускаются механизмы «экономии» уже имеющихся кластеров и увеличивается концентрация Fe в митохондриях).
У дрожжей железосерные кластеры из митохондрий передаются на белки Tah18 и Dre2. Далее кластеры принимает димер Cfd1-Nbp35, который может взаимодействовать с другими белками и передавать им железосерные кластеры, необходимые для созревания этих белков. В процессе передачи участвуют два белка-адаптора: Nar1 и Cia1. Показано, что Nar1 сам по себе содержит Fe—S-кластеры и образует комплексы с Cia1 и Nbp35. Cia1 по структуре является бета-пропеллером и, вероятно, способен помогать взаимодействию белков-акцепторов Fe—S-кластеров с несущим их комплексом Cfd1-Nbp35-Nar1.
На клетках человека показано, что человеческие аналоги huNfs1, huIsu1, huNfu1, frataxin имеют изоформы без сигналов митохондриальной локализации (huNfs1, huIsu1, huNfu1 при трансляции со второго старт-кодона не получают эти сигналы) и присутствуют в меньших количествах в цитоплазме и ядре. Это присутствие строго необходимо в норме, так как без него запускаются сигналы, увеличивающие содержание Fe в клетке и митохондриях, уменьшающие синтез гемов и расход железосерных кластеров. Вероятно, таким образом клетка осуществляет контроль за нормальным синтезом кластеров и пытается предотвратить собственную гибель при их недостатке.
Некоторые паразитические организмы в ходе эволюции утратили митохондрии вместе с осуществляемыми в них процессами синтеза гемов и дыхания. Однако без синтеза железосерных кластеров обойтись они не смогли, поэтому в их
гидрогеносомах
(редуцированных митохондриях) есть аналоги систем синтеза железосерных кластеров. Примерами таких организмов являются
лямблии
и
микроспоридии
.
Из этого правила существуют и исключения, например, у
белки Isu1 и frataxin расположены в цитоплазме, а Nfs1, Isd11 и Ssq1 — в
митосомах
; а у
системы ISC найти не удалось, но есть гомологи белков NifS и NifU
.
Обычно самые важные процессы в клетке имеют несколько путей осуществления, чтобы в случае поломки основного механизма выжить за счёт наличия запасного (примерами могут служить различные варианты репарации ДНК, взаимодополняющие друг друга процессы апоптоза и некроза ). В данном случае альтернативных путей синтеза железосерных кластеров не возникло, поэтому осуществляется строгий контроль за его работой. В данном случае контроль многократно дублируется.
Так как смещение количества реагентов смещает равновесие реакции в сторону образования продуктов, то при увеличении количества доступного железа должно возрасти количество собираемых железосерных кластеров.
Так как белки синтеза и транспорта железосерных кластеров кодируются в ядре (даже если они локализованы в митохондриях), то в случае поломки сигнал должен дойти до ядра.
Очень важную роль в регуляции метаболизма железа играют транскрипционные факторы Aft1 и Aft2. Aft1 при понижении уровня железа в клетке транспортируется в ядро с помощью импортина Pse1 и взаимодействует с генами так называемого регулона железа ( англ. iron regulon ), активируя их транскрипцию. Среди этих генов есть гены транспортёров железа, которые увеличивают общее количество железа в клетке.
Ещё одной мишенью Aft1 является РНК-связывающий белок Cth2, который под действием Aft1 начинает уничтожать матричные РНК использующих железо белков, уменьшая потребление железа.
Механизма детектирования уровня железа белком Aft1 доподлинно не известно. Предполагается, что митохондрии экспортируют некий фактор, напрямую связанный с интенсивностью работы аппарата синтеза железосерных кластеров. Одним из кандидатов на роль данного фактора является белок-переносчик железосерных кластеров из митохондрий, передающий кластеры цитоплазматической системе CIA ( cytosolic ISP assembly ).
Aft2 считается более мягким и медленным регулятором, фенотипически оказывающим тот же эффект, что и Aft1.
Первым ферментом, воспринимающим недостаток Fe—S-кластеров, является фермент IRP1, который может включать Fe—S-кластер в свою структуру и имеет разные конформации — с кластером и без кластера. Он располагается в цитоплазме и получает кластер от системы CIA, поэтому чувствует все поломки в системе синтеза и транспорта Fe—S-кластеров.
Без Fe—S-кластера IRP1 имеет каталитически активный домен, взаимодействующий с IRE (
англ.
iron-responcible region
) РНК некоторых белков. Существует 2 типа взаимодействий:
Помимо IRP1, в клетке присутствует фактор IRP2, который действует аналогично IRP1, однако не содержит железосерных кластеров, и механизм чувствительности IRP2 пока не определён.
тРНК имеет устойчивую третичную структуру, обеспечиваемую образованием комплементарных взаимодействий и водородных связей внутри самой цепи РНК. Для участия в трансляции синтезированная тРНК должна правильно свернуться и претерпеть некоторые изменения. Одним из таких изменений является тио-модификация урацилов U34 и U35 у дрожжей и млекопитающих в цитоплазматических и митохондриальных тРНК. Тио-модификации есть и у бактерий.
Данные модификации зависят от Fe—S-содержащих белков, и нарушения в их синтезе вызывают повсеместные нарушения в трансляции, приводят к гибели. Механизм, посредством которого осуществляется связь между синтезом Fe—S-кластеров и данной модификацией, на данный момент изучен мало.
Ионы железа являются хорошим неорганическим катализатором распада перекиси водорода. Перекись распадается на гидроксильные радикалы, которые крайне активны и опасны для клеток. Радикалы в первую очередь запускают перекисное окисление липидов мембран митохондрий, а также их ферменты и ДНК. Митохондрии работают с кислородом и могут образовывать его активные формы (ROS — reactive oxygen species). Таким образом процесс замыкается, ускоряется, а митохондрии и вся клетка портится, в результате чего она может гибнуть от апоптоза/некроза или переродиться в раковую из-за мутаций.
Как было показано выше, нарушения в работе аппарата синтеза железосерных кластеров приводят к увеличению количества железа, а значит, и катализаторов образования активных форм кислорода.
Заметим, что нарушение по любому из генов синтеза или транспорта железосерных кластеров блокирует (как минимум у дрожжей) их доставку в цитоплазму, поэтому часто симптомы заболеваний схожи.
Обычно эти заболевания очень редки, связаны лишь с нарушением или уменьшением синтеза Fe—S-содержащих белков, так как полное отсутствие тех или иных белков обычно летально.